组织蛋白酶B在肝星状细胞HSC-T6中的动态表达和意义
2012-12-07李春艳陈永平申春燕
李春艳 陈永平 申春燕
肝纤维化是多种慢性肝病共同的病理过程,在肝损伤过程中,肝星状细胞增殖并向肌成纤维样细胞分化,这一过程是可以逆转的。肝纤维化的发病机制主要是肝星状细胞的增殖和凋亡是否能达到平衡,若HSC的活化增加或其凋亡减少,都会导致肝纤维化的发生。因此抑制肝星状细胞的活化与增殖、诱导其凋亡都会对肝纤维化过程起到预防和治疗作用[1,2]。尽管近年来对这方面的研究很多,但具体的分子机制和调控过程还待进一步研究。
组织蛋白酶B(cathepsin B)是溶酶体内最重要的组织蛋白酶,属于木瓜蛋白家族,广泛分布于各种组织细胞的溶酶体中,主要降解各种组织蛋白。近年发现组织蛋白酶B除参与重要的生理功能外还与人类多种疾病如肿瘤的浸润和转移、关节炎、骨质疏松、多发性硬化症、动脉粥样硬化、肾纤维化、肺纤维化、肝纤维化、皮肤光老化等慢性疾病有关,因此备受关注[3~11]。
材料与方法
1.实验材料及试剂:大鼠肝星状细胞T6系,购自湖南湘雅医学院细胞库。胎牛血清(FBS)、DMEM高糖培养基购自美国Gibico公司;α-SMA鼠多克隆一抗购自美国Sigma公司;组织蛋白酶B兔多克隆一抗购自美国Santa cruz公司;组织蛋白酶B抑制剂(Z-FA-FMK)购自美国Santa cruz公司;磷酸甘油脱氢酶(GAPDH)小鼠单克隆一抗、辣根过氧化物酶(HRP)二抗购自北京中衫公司;组织/细胞强效裂解液、BCA蛋白检测试剂盒(购自上海碧云天生物技术研究所);RNA Iso试剂盒(购自大连宝生物公司)。
2.实验分组及细胞培养:分对照组和抑制剂组,细胞培养至第3代时,以2×105接种到六孔板中,待细胞完全贴壁,对照组12、24、36、48h 的细胞只换培养液;抑制剂组 12、24、36、48h的细胞换培养液后分别加入26nmol/L的Z-FA-FMK。将冻存的HSC-T6细胞接种于含10%FBS的DMEM培养液中,置37℃ 5%CO2的培养箱中培养。当细胞贴壁生长铺满培养板的85%左右时,用0.25%胰酶消化后传代,24h换液,72h再次传代,每次试验均在呈指数生长的细胞中进行。
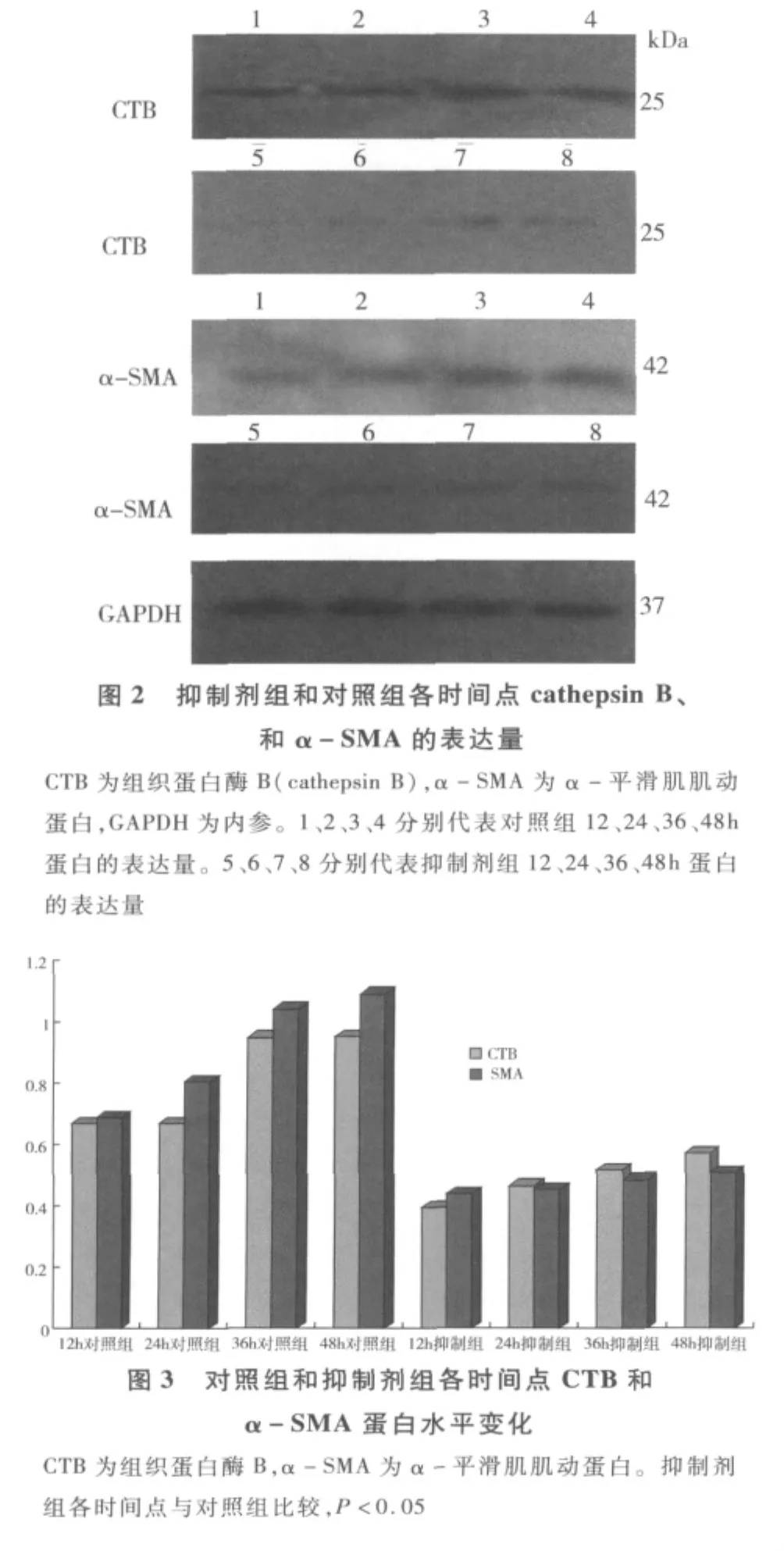
3.Western blotting法检测 cathepsin B、α -SMA:采用放射免疫沉淀测定(RIPA)组织/细胞强效裂解液抽提对照组和抑制剂组12、24、36、48h的 HSC-T6细胞总蛋白,用 BCA 蛋白检测试剂盒检测蛋白浓度,浓度测定后用裂解液进行配平,使得各时间点总的蛋白浓度相同。所有操作参照Western blotting实验指南进行。cathepsin B和α-SMA一抗1∶800稀释,内参GAPDH一抗1∶1000稀释,小鼠抗大鼠辣根过氧化物酶标记二抗1∶5000稀释,羊抗兔辣根过氧化物酶标记二抗1∶3000稀释。底物增强型化学发光显色,洗片显带,胶片扫描,用Gel-pro3.1软件测量 cathepsin B、α -SMA 和 GAPDH的平均光密度,用cathepsin B、α-SMA与GAPDH的比值表示各蛋白的相对表达量。
4.RNA提取:采用RNA Iso试剂盒,按说明书提取HSCT6细胞总RNA。采用分光光度法测定提取的总RNA含量和纯度,A260nm/A280nm比值在1.8~2.0范围。
5.RT-PCR检测cathepsin B mRNA、TGF-βmRNA和α-SMA mRNA:RT-PCR按鸟类成髓细胞瘤病毒(AMV)试剂盒按说明书操作。采用Premer5软件设计引物序列,由上海捷瑞公司合成。TGF-β、α-SMA、cathepsin B与actin-β的PCR引物序列及反应条件见表1。PCR产物在1.5%琼脂糖凝胶中电泳,凝胶成像系统扫描,用Gel-pro3.1分别测量TGF-β、α-SMA、cathepsin B、actin-β的平均积分吸光度。用TGF-β、α-SMA、cathepsin B与actin-β的比值来表示各自mRNA的相对表达量。
6.统计学方法:所有数据采用SPSS 17.0统计软件分析,对计数资料进行正态性检验,计数资料用均数±标准差s)表示。样本均数比较采用配对t检验进行分析。双变量均服从正态分布的相关性讨论采用Pearson直线相关分析,否则采用Spearman秩相关,p<0.05表示差异有统计学意义。

表1 PCR引物序列及反应条件
结 果
1.倒置显微镜观察结果:抑制剂组细胞12h后有细胞脱落,悬浮于上清中,随时间的增加,上述情况有所改善。较对照组细胞明显减少,细胞间隙较宽,细胞皱缩,核染色质浓集呈球形,见图1A。对照组HSC-T6细胞随着时间的延长,形态和数量都有明显的变化,12h时细胞形态不规则,呈圆形、梭形、三角形等,细胞数量较少;24h时细胞呈星形,星芒状突起丰富,高倍镜下细胞核呈圆形或不规则形,核仁圆形,清晰可见,细胞数量较多。对照组24h细胞呈肌成纤维细胞样细胞(myofibroblast- like cell,MFB)外形,未见到核染色质浓集,见图1B。

图1 对照组和抑制剂组各时间点的细胞生长状态
2.Western blotting印迹法检测 cathepsin B、α -SMA结果:HSC随着培养时间的延长,向成纤维肌样细胞转化,在培养过程中不同时间点cathepsin B的表达也不同,结果显示,对照组随着时间的延长cathepsin B的表达增加,进一步说明cathepsin B参与了HSC的增殖和分化;抑制剂组在加入组织蛋白酶B抑制剂 Z-FA-FMK后由 cathepsin B表达量(0.49±0.04)较对照组(0.68 ±0.09)明显减少,差异具有统计学意义(t= -6.31,P <0.05),说明 Z -FA-FMK能有效抑制cathepsin B蛋白的表达,见图2、图3。实验结果还发现α-SMA的变化趋势与cathepsin B的变化趋势相平行。α-SMA作为HSC向肌成纤维细胞转化的标志,对照组随时间的延长α-SMA的表达量增加;抑制剂组在加入Z-FA-FMK 12、24、36、48h 后,α - SMA 的表达量(0.64 ±0.03)较对照组(0.79±0.01)有所降低,差异具有统计学意义(t= -6.18,P <0.05)(图 2、图3)。
3.RT-PCR 检测 cathepsin B mRNA、TGF-β mRNA和α-SMA mRNA结果:对照组cathepsin B mRNA的表达量随着时间的延长而增加,抑制剂组cathepsin B mRNA 的表达量(2.00±0.11较对照组(2.24±0.47)有所下降,且差异具有统计学意义(t=-3.41,P <0.05)。对照组 TGF-β mRNA 随着时间的延长表达量增加,抑制剂组TGF-βmRNA的表达量(1.43 ±0.16)较对照组(1.81 ±0.21)有所减少,且差异具有统计学意义(t=6.44,p<0.05)。对照组α-SMA mRNA随着时间的延长表达量增加,抑制剂组α-SMA mRNA的表达量(0.40±0.06)较对照组(0.81±0.08)有所减少,且差异具有统计学意义(t=-4.28,P <0.05)(图 4、图 5)。
4.相关性分析:cathepsin B与α-SMA的表达量呈正相关(蛋白水平:r=0.97,P <0.05;mRNA 水平:r=0.84,P <0.05),说明 α -SMA 的表达量的变化与cathepsin B表达量的变化平行。
讨 论
肝纤维化是肝脏对各种病因所致的慢性肝损伤的一种修复反应,其实质是以胶原分泌为主的细胞外基质(ECM)的过度沉积,HSC在肝纤维化进程中起关键作用,是肝纤维化时ECM合成的主要来细胞。TGF-β是调控肝纤维化发生发展的核心因子,以表达α-SMA为标志的活化的肝星状细胞(HSC)是肝内ECM的主要来源
组织蛋白酶B是主要的溶酶体蛋白酶,肿瘤的发生和转移归因于广泛的细胞外基质重塑和细胞死亡途径的调控[4]。尽管已有研究证明组织蛋白酶参与肝纤维化形成,但它们在HSC生物性调控和纤维形成中的作用还不清楚[8,10]。本实验研究结果显示,组织蛋白酶B参与了HSC的增殖和分化;同时还发现α-SMA的变化趋势与组织蛋白酶B的变化趋势相平行。证明了HSC随着培养时间的延长会向成纤维肌样细胞转化,抑制cathepsin B的活性能够减缓或抑制HSC的增殖以及向成纤维肌样细胞转化,为组织蛋白酶B在肝纤维化发病机制中的作用提供了依据。
Okuyama的研究显示分泌的CTB可下调PDGFβR,使 PDGF不能诱导静止期 HSC 的增殖[12]。Anna Moles所做的研究显示组织蛋白酶B通过异常的机制能直接调控HSC增殖[10]。组织蛋白B的遗传和药理性拮抗作用都能抑制活化的鼠HSC或永生的人Lx2细胞。而不是通过调节降低PDGFβR对与其配对的PDGF,组织蛋白酶的抑制通过PDGF影响AKT的磷酸化。这些研究结果显示组织蛋白酶B确实通过PDGF调控PI3K/AKT途径。PDGF在体外激发后cathepsin B活性的缺失后AKT的活化减低的确切机制和参与这一过程的主要蛋白是今后最重要也是最有价值的研究。
组织蛋白酶和内涵体早晚期的标记共区域化显示溶酶体组织蛋白的释放是随着分泌途径来调节ECM成分和质膜HSC受体的[10]。本实验研究显示,在HSC-T6细胞培养过程中,cathepsin B的表达量随时间的延长而增加,Z-FA-FMK作用后cathepsin B的表达量较对照组有所减少,且差异具有统计学意义。此外,cathepsin B防止HSC增殖,下调负性调控HSC活化的表型标志物的表达,如A-SMA,TGF-β。本实验研究还表明cathepsin B的变化趋势与肝纤维化常用指标TGF-β和α-SMA表达量的变化趋势一致,且较对照组明显减少。这些结果都显示半胱氨酸组织蛋白酶直接调控HSC活化后早期转分化和永生化,是调控他们潜在纤维化和最终肝纤维化的关键。然而,Anna Moles等发现在原始小鼠HSC中TGF-β的表达减少,TGF-βmRNA的表达的水平在LX2细胞中没有变化,表明这些细胞比5天的小鼠HSC更加分化,并且在这一分化阶段TGF-β的调控可能不同[13,14]。本实验研究显示HSC-T6细胞TGF-β的表达量随时间的延长而增加,但抑制剂作用后TGF-β与TGF-βmRNA的表达量都较对照组有所降低,且差异具有统计学意义。
许多文献显示在炎症过程中组织的局部会出现PH的降低,有利于分泌的组织蛋白酶的活化。事实上,组织蛋白酶的分泌和许多肿瘤实质的侵袭和转移都有关,说明组织蛋白酶B通过降解ECM成分或激活其他基质降解蛋白如尿激酶型纤维蛋白酶原激活剂来促进侵入[3,15]。假如组织蛋白酶 B对活化的HSC的增殖和纤维形成有作用,我们将进一步研究他们对体内肝纤维化的影响。之前Canbay在胆道结扎的肝纤维化模型中的研究认为组织蛋白酶B参与了肝脏的胆汁淤积引起的炎症、细胞凋亡、最终导致肝纤维化形成,敲除CTB基因或用CTB药物抑制剂后大鼠肝脏炎性损伤及纤维化形成减轻[9]。
Anna Moles分析了cathepsin B在CCL4诱导的肝纤维化模型中的作用[10]。Anna Moles所做的研究显示对cathepsin B进行药理学抑制能防止α-SMA的增加、胶原合成和CCl4诱导引起的中性粒细胞的侵润。组织蛋白酶抑制剂不能改善由CCl4导致的肝损伤,反映了组织蛋白酶B与肝细胞损害有刺激依赖性[7,16]。此外,CCl4作用在 HSC 后 cathepsin B 的表达量增加,在肝细胞中未被检出,由组织蛋白酶活性的生化检查和GFAP染色法,我们不能排除cathepsin B参与肝脏其他成肌纤维细胞样细胞群。
cathepsin B参与了人类多种重要的生理功能及病理进程,本实验研究证明cathepsin B调控HSC的增殖和分化,它的抑制剂可以下调纤维化指标α-SMA、TGF-β的表达,进而参与了肝纤维化形成过程,这一研究为进一步探索肝纤维化形成的机制提供了理论基础,cathepsin B可作为今后治疗肝纤维化治疗的靶点。
1 Friedman SL.mechanisms of disease:mechanisms of hepatic fibrosis and therapeutic implications[J].Nat Clin Pract Gastroenterol Hepatol,2004,1(2):98 - 105
2 Friedman SL.Hepatic stellate cells:protein,multifunctional,and enigmatic cells of the liver[J].Physiol Rev,2008,88(1):125 - 172
3 Klose A,Wilbrand-Hennes A,Zigrino P,et al.Contact of highinvasive,but not low - invasive,melanoma cells to native collagen i induces the release of mature cathepsin b[J].Int JCancer,2006,118(11):2735-2743
4 Mohamed MM,Sloane BF.Cysteine cathepsins:multifunctional enzymes in cancer[J].Nat Rev Cancer,2006,6(10):764 - 775
5 Werle B,Lotterle H,Schanzenbacher U,et al.Immunochemical analysis of cathepsin b in lung tumours:an independent prognostic factor for squamous cell carcinoma patients[J].Br J Cancer,1999,81(3):510-519
6 Elsaid KA,Jay GD,Chichester CO.Reduced expression and proteolytic susceptibility of lubricin/superficial zone protein may explain early elevation in the coefficient of friction in the joints of rats with antigen - induced arthritis[J].Arthritis Rheum,2007,56(1):108 -116
7 Koslowski R,Knoch K,Kuhlisch E,et al.Cathepsins in bleomycin -induced lung injury in rat[J].Eur Respir J.2003,22(3):427 - 435
8 Yamamoto H,Murawaki Y,Kawasaki H.Collagenolytic cathepsin b and l activity in experimental fibrotic liver and human liver[J].Res Commun Chem Pathol Pharmacol,1992,76(1):95 -112
9 Canbay A,Guicciardi ME,Higuchi H,et al.Cathepsin b inactivation attenuates hepatic injury and fibrosis during cholestasis[J].J Clin Invest,2003,112(2):152 -159
10 Moles A,Tarrats N,Fernandez-Checa JC,et al.Cathepsins b and d drive hepatic stellate cell proliferation and promote their fibrogenic potential[J].Hepatology,2009,49(4):1297 - 1307
11 Zheng Y,Lai W,Wan M,et al.Expression of cathepsins in human skin photoaging[J].Skin Pharmacol Physiol,2011,24(1):10 - 21
12 Okuyama H,Shimahara Y,Kawada N,et al.Regulation of cell growth by redox-mediated extracellular proteolysis of platelet-derived growth factor receptor beta[J].J Biol Chem,2001,276(30):28274-28280
13 Xu L,Hui AY,Albanis E,et al.Human hepatic stellate cell lines,lx -1 and lx - 2:new tools for analysis of hepatic fibrosis[J].Gut,2005,54(1):142 -151
14 Liu C,Gaca MD,Swenson ES,et al.Smads2 and 3 are differentially activated by transforming growth factor-beta(tgf-beta)in quiescent and activated hepatic stellate cells.Constitutive nuclear localization of smads in activated cells is tgf- beta - independent[J].JBiol Chem,2003,278(13):11721 -11728
15 Joyce JA,Baruch A,Chehade K,et al.Cathepsin cysteine proteases are effectors of invasive growth and angiogenesis during multistage tumorigenesis[J].Cancer Cell,2004,5(5):443 - 453
16 Li Z,Berk M,McIntyre TM,et al.The lysosomal-mitochondrial axis in free fatty acid - induced hepatic lipotoxicity[J].Hepatology,2008,47(5):1495-1503