大豆球蛋白的水解研究
2012-12-05邹险峰吴修利陈星高长城
邹险峰 ,吴修利 ,陈星 ,高长城 ,*
(1.长春大学 农产品深加工重点实验室,吉林 长春 130022;2.长春大学 生物技术学院,吉林 长春 130022)
大豆球蛋白的水解研究
邹险峰1,吴修利2,陈星1,高长城1,*
(1.长春大学 农产品深加工重点实验室,吉林 长春 130022;2.长春大学 生物技术学院,吉林 长春 130022)
采用Nagano法从豆粕中分离大豆球蛋白,利用大豆蛋白改性酶解大豆球蛋白制备水解肽,以单因素试验和正交试验确定酶解最佳条件,通过高效液相法分析大豆球蛋白水解肽的分子量分布。结果显示:在20 g/L的底物浓度下的最佳条件为酶和底物比10000 U/g,温度55℃,pH8.0,水解时间4 h。优组合条件下的水解度为69.6%。大豆球蛋白水解肽主要为130 u~1000 u的短肽,占肽总量的86.5%,说明大豆球蛋白水解肽的均一性极高。
大豆球蛋白;大豆球蛋白水解肽;大豆蛋白改性酶
中国是大豆的故乡,大豆不仅提供了丰富的大豆植物油,而且也是优质的植物蛋白源。大豆蛋白质含量高达干重的40%,其中80%~88%为水溶性蛋白质,而球蛋白占水溶性蛋白质的94%,球蛋白主要由大豆球蛋白(glycinin)和 β-伴大豆球蛋白(β-conglycinin)组成,分别占大豆蛋白质总量的50%和33%。大豆蛋白质含有全部人体的8种必需氨基酸,且比例合理,赖氨酸含量可以与动物蛋白相媲美,是食品加工业的重要原料。研究表明,大豆蛋白水解肽具有更好的生物活性和营养价值,因此,对大豆蛋白质的利用已经进入肽阶段。目前大豆肽的生产方法主要有酶解法和微生物发酵法,其中以酶解法最为常用。酶解用酶主要包括动物蛋白酶如胰蛋白酶、胃蛋白酶等;植物蛋白酶如木瓜蛋白酶菠萝蛋白酶等;微生物蛋白酶如碱性蛋白酶、中性蛋白酶等。目前市售大豆肽均为大豆蛋白水解获得,但由于大豆蛋白为混合蛋白质,得到的大豆肽成分繁杂,均一性较差。本研究采用先将大豆蛋白质分离纯化的方法得到大豆球蛋白,采用了大豆蛋白改性酶作为水解酶,通过酶解大豆球蛋白制备大豆肽,对水解条件进行了优化,并对水解肽的分子量分布进行分析,为大豆肽的生产提供了新的酶类,也为工业生产高品质的大豆肽提供了理论参考。
1 材料与方法
1.1 主要材料与试剂
脱脂豆粕:吉林省通榆蛋白质厂;大豆蛋白改性酶:南宁庞博生物工程有限公司;蛋白质分子量标准品(Holotransferrin,77000u;Apomyoglobin,16951u;Ribonuclease A,13700 u;Cytochrome C,12400 u)、肽分子量标准品(Gly-Tyr,239.2 u;Val-Tyr-Val,379.5 u;Leu-enkephal in,569.7u;Met-ekephalin,573.7u;Angiotensin Ⅱ,1296u):美国Sigma公司;其他化学试剂均为分析纯。
1.2 仪器与设备
FDU-2100型冷冻干燥仪:日本EYELA公司;J-26XP型高速冷冻离心机:美国BECKMAN COULTER公司;AlphaImager HP型凝胶成像系统:美国Alpha公司;LC-20AD型高效液相色谱仪:日本岛津公司。
1.3 方法
1.3.1 大豆球蛋白的分离和表征
大豆球蛋白的分离采用优化的Nagano法[1],表征采用SDS-PAGE还原电泳。
1.3.2 指标测定
蛋白酶活力测定采用福林法[2];蛋白质含量测定采用凯氏定氮法[3];水解度(the Degree of Hydrolysis,DH)的测定采用三氯乙酸(TCA)法[4]。
1.3.3 酶解工艺路线和酶解条件优化
1.3.3.1 酶解工艺路线
大豆球蛋白→调浆→酶解→灭酶→酸沉→离心→上清液冷冻干燥
1.3.3.2 单因素试验
以DH为指标研究不同的底物浓度、酶与底物比、水解时间、pH和温度对大豆蛋白改性酶水解大豆球蛋白的影响。
1.3.3.3 正交试验
在单因素试验基础上,选择酶与底物比、酶解时间、酶解温度和pH作为考察因素,采用正交表L9(34)进行正交试验,以DH为考察指标,利用数据DPS3.01处理系统进行方差分析,筛选大豆球蛋白的最佳酶解条件,并对最佳条件进行验证试验。
1.3.4 大豆球蛋白水解肽的分子量分布
大豆球蛋白水解肽的分子量测定采用高效液相法[5]。
2 结果与分析
2.1 大豆球蛋白的表征
通过Nagano法分离得到大豆球蛋白,分离效果用SDS-PAGE分析,结果见图1。
从图1可以看出,大豆球蛋白中混有少量的β-伴大豆球蛋白。通过AlphaInnotech-AlphaView软件的光密度扫描分析得出大豆球蛋白含量为86.6%。

图1 大豆球蛋白的SDS-PAGE电泳图谱Fig.1 SDS-PAGE of the glycinin
2.2 大豆蛋白改性酶水解大豆球蛋白的单因素试验
2.2.1 底物浓度对水解的影响
水解条件:酶和底物比8000 U/g,温度50℃,pH 7.5,水解时间 4 h。以 DH 为指标研究 10、20、30、40、50 g/L的底物浓度对水解的影响,结果见图2。
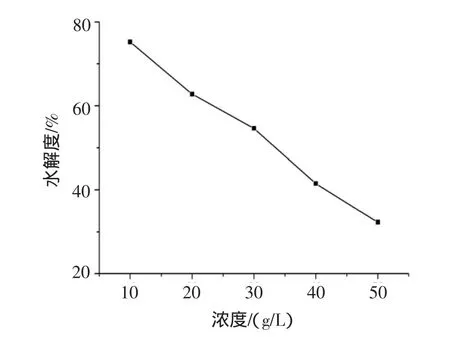
图2 底物浓度对水解度的影响Fig.2 Effects of substrated concentration on DH of hydrolysate
大豆蛋白改性酶水解大豆球蛋白在水溶液中进行,大豆球蛋白可溶解于水,由图2可以看出,底物浓度对水解度的影响很大,在10 g/L~50 g/L的底物浓度范围内,大豆球蛋白的水解度均随着底物浓度的增加而显著下降。虽然10 g/L的底物浓度下水解度最大,但在实际生产主要考虑生产效率,因此选择20 g/L的蛋白浓度。
2.2.2 酶与底物比对水解的影响
水解条件:底物浓度20g/L,温度50℃,pH7.5,水解时间 4h。以 DH 为指标研究 4000、6000、8000、10000、12000 U/g的酶与底物比对水解的影响。结果见图3。在工业生产中,酶浓度是影响成本的重要因素。由图3可以看出,在底物浓度一定时,水解度与酶浓度呈正相关,当酶与底物比达到8000 U/g时,大豆球蛋白水解度基本达到最大,继续增加酶与底物比水解度也不再增加。因此,可以选择的酶与底物比对为8000 U/g。

图3 酶与底物比对水解度的影响Fig.3 Effects of enzyme concentration on DH of hydrolysate
2.2.3 水解时间对水解的影响
水解条件:底物浓度20 g/L,酶和底物比8000 U/g,温度 50℃,pH 7.5。以 DH为指标研究2、3、4、5、6 h的水解时间对水解的影响。结果见图4。

图4 水解时间对水解度的影响Fig.4 Effects of time on DH of hydrolysate
水解时间是影响酶解反应的重要因素,对工业生产效率也有直接的影响。由图4可以看出,水解度与酶解时间呈正相关。大豆球蛋白的水解度在4 h左右达到最大值。因此,选择4 h的水解时间。
2.2.4 pH对水解的影响
水解条件:底物浓度20 g/L,酶和底物比8000 U/g,温度50℃,水解时间4 h。以DH为指标研究7.0、7.5、8.0、8.5的pH对水解的影响,结果见图5。
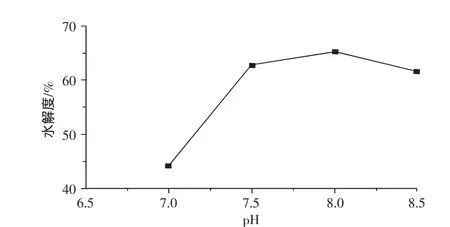
图5 pH对水解度的影响Fig.5 Effects of pH on DH of hydrolysate
pH是影响酶催化活性的重要因素。由图5可以看出,大豆蛋白改性酶水解大豆球蛋白的最适pH为8.0。
2.2.5 水解温度对水解的影响
水解条件:底物浓度20 g/L,酶和底物比8000 U/g,pH 7.5,水解时间4 h。以DH为指标研究40、45、50、55、60℃的水解温度对水解的影响,结果见图6。

图6 水解温度对水解度的影响Fig.6 Effects of temperature on DH of hydrolysate
水解温度对大豆蛋白改性酶水解大豆球蛋白有双重影响。一方面温度增加会降低溶液的黏度,提高蛋白质的分散性,有利于酶与底物的结合,提高水解度;另一方面,过高的温度会加速酶的变性导致水解度降低。由图6可以看出,在低温条件下,蛋白水解度较低,随着温度的增加,蛋白水解度逐渐增大,在55℃左右达到最大,继续升高温度会导致蛋白水解度的下降。因此,大豆球蛋白的最适温度为55℃。
2.3 酶解反应的正交试验
根据以上的单因素试验,初步认定大豆蛋白改性酶水解大豆球蛋白反应的适宜条件为:酶和底物比8000U/g,温度55℃,pH8.0,水解时间4h。选取了 20g/L的底物浓度作为试验浓度。根据单因素试验的结果,对酶和底物比、水解时间、温度和pH 4种因素各取3个水平,进行L9(34)正交试验,正交试验的因素、水平设计见表1,正交试验结果见表2。
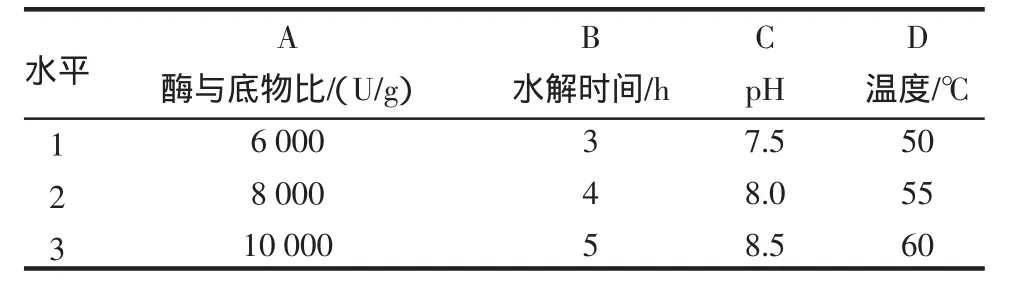
表1 正交试验因素水平Table 1 The factors and levels of orthogonal experiment
由极差分析可知,各因素对水解度的影响大小顺序为A>D>C>B,即酶和底物比>温度>pH>水解时间根据K值大小得到酶解反应条件的优组合为A3B2C2D2,即酶和底物比 10000 U/g,温度 55 ℃,pH8.0,水解时间4 h。优组合条件下的水解度为69.6%。
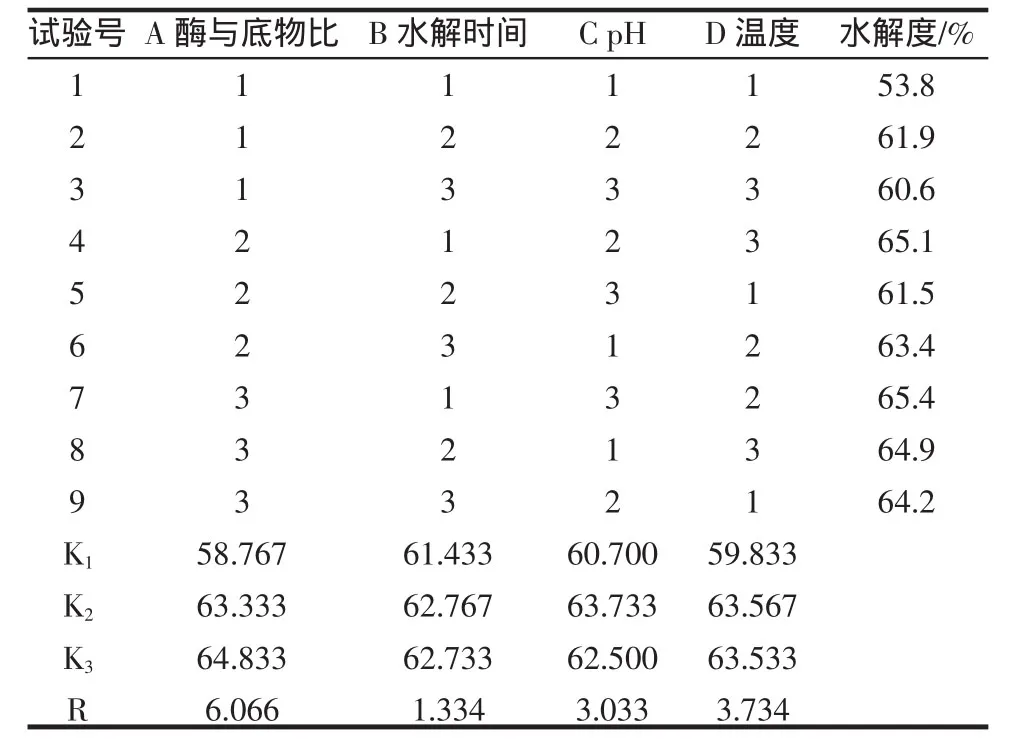
表2 正交试验结果Table 2 Results of orthogonal experiment
2.4 大豆球蛋白水解肽的分子量分布
对大豆球蛋白水解肽进行高效分子排阻色谱分析,洗脱图谱见图7,通过GPC软件计算后分子量分布情况见表3。

图7 大豆球蛋白水解肽的高效分子排阻色谱分析Fig.7 HPLC(TSKgel G2000swxl,300 mm×7.8 mm)of glycinin peptide.Flow phase:acetonitrile/water/TFA=10/90/0.1(v/v/v);Wavelength:220 nm;Flow rate:0.5 mL/min;Injection volume:20 μL;Temperature:25℃.
由表3可以看出,大豆球蛋白水解肽的分子量主要分布在130 u~1000 u之间,占肽总量的86.5%。其中300 u~1000 u为2个~8个氨基酸残基的短肽,这部分占肽总量的64.7%;130 u~300 u占21.8%,根据数均分子量和重均分子量分析,其主要成分为二肽;还有10%的分子量为1000 u~5000 u的寡肽及少量的氨基酸,小于130 u的部分主要为单氨基酸,由于分子量处在标准曲线之外,所以分子量的数值偏低。说明了大豆蛋白改性酶对大豆球蛋白的水解充分,水解产物具有良好的均一性,单氨基酸的含量很低,有利于产物的分离纯化和性质鉴定,并且对于发挥大豆肽的功能性具有重要意义。

表3 大豆球蛋白水解肽的分子量分布Table 3 Molecular weight distribution of glycinin peptide peptides
3 结论
采用大豆蛋白改性酶水解大豆球蛋白,结果表明,在20 g/L的蛋白浓度下最佳的酶解条件为酶和底物比10000 U/g,温度55℃,pH8.0,水解时间4 h。优组合条件下的水解度为69.6%。高效分子排阻色谱分析表明大豆球蛋白水解肽主要为130 u~1000 u的短肽,占肽总量的86.5%,表现出良好的均一性。大豆球蛋白水解肽的生理功能需要进一步研究。本研究为工业生产大豆肽提供了理论依据。
[1]刘春,王红玲,崔竹梅,等.大豆籽粒贮藏蛋白11S和7S组分提取分离方法的优化[J].中国油脂,2006,31(2):31-36
[2]中华人民共和国国家标准.GB/T 23527-2009蛋白酶制剂[S].北京:中国标准出版社,2009:6-8
[3]中华人民共和国国家标准.GB/T 5009.5-2010食品中蛋白质的测定[S].北京:中国标准出版社,2010:1-4
[4]肖凯军,高孔荣,曾庆孝.酶解大豆分离蛋白的特性研究[J].广州食品工业科技,1995,11(2):5-10
[5]中华人民共和国国家标准.GB/T 22492-2008大豆肽粉[S].北京:中国标准出版社,2008:4-5
Study on Hydrolysis of Glycinin
ZOU Xian-feng1,WU Xiu-li2,CHEN Xing1,GAO Chang-cheng1,*
(1.Key Laboratory of Agricultural Products Processing in Changchun University,Changchun 130022,Jilin,China;2.College of Biological Sci&Tech,Changchun University,Changchun 130022,Jilin,China)
According to Nagano method,glycin in was isolated from soybean cake and was hydrolyzed by soy protein modification enzyme to produce hydrolysate peptide.Optimum enzymatic hydrolysis conditions were determined by single-factor and orthogonal test.Then the distribution of glycinin hydrolysate peptide was detected by means of HPLC.Results showed that these optimum conditions were followed:10000 U/g of enzyme concentration,55℃,pH 8.0 and 4 h of reaction time when substrate concentration was 20 g/L,and the degree of hydrolysis(DH)was 69.6%in these conditions.Glycinin hydrolysate peptides of 130 u-1000 u occupied 86.5%in total peptides,which showed that the peptide possessed excellent uniformity.
glycinin;glycinin hydrolysate peptide;soy protein modification enzyme
吉林省教育厅“十一五”科学技术研究项目(2008365);吉林省教育厅“十一五”科学技术研究项目(2009229);长春市科技计划项目(08YJ18)
邹险峰(1971—),男(汉),讲师,博士研究生,研究方向:食品生物技术。
*通信作者
2011-07-29
