黄参不同溶剂提取物抗氧化活性研究
2012-12-05周瑞田呈瑞高春燕郝果高亚妮康宇新孟友武
周瑞,田呈瑞,*,高春燕,郝果,高亚妮,康宇新,孟友武
(1.陕西师范大学食品工程与营养科学学院,陕西 西安 710062;2.山丹军马场食品公司,甘肃 山丹 734104)
黄参不同溶剂提取物抗氧化活性研究
周瑞1,田呈瑞1,*,高春燕1,郝果1,高亚妮1,康宇新1,孟友武2
(1.陕西师范大学食品工程与营养科学学院,陕西 西安 710062;2.山丹军马场食品公司,甘肃 山丹 734104)
采用DPPH抗氧化、对羟基自由基致DNA氧化损伤保护的评价方法,研究了黄参正己烷提取物、二氯甲烷提取物、乙酸乙酯提取物以及甲醇提取物的抗氧化活性的差异。结果表明,黄参不同溶剂提取物均对DPPH自由基具有很好的清除作用,并且能够较好的保护DNA防止羟基自由基对其的损伤,但是不同溶剂提取物的抗氧化能力存在显著差异;在不同溶剂的黄参提取物中,甲醇的提取率最高,但乙酸乙酯提取物的抗氧化活性最强并且其总酚含量最高。在对DPPH自由基清除试验中,溶剂提取物其总酚含量和抗氧化性的趋势不一致,说明在黄参提取物中除酚类物质外,还存在其它的抗氧化物质。结合Folin-Ciocalteu、DPPH自由基清除率法和DNA损伤保护法分别测定黄参不同溶剂提取物中总酚的含量和抗氧化力,可初步评价黄参的抗氧化特性。
黄参;提取物;DPPH;DNA损伤
黄参[Sphallerocarpus gracilis(Bess.)K-Pol.]为伞形科(Umbelliferae)迷果芹属的单种属植物,生长在海拔1700 m~4000 m的高寒阴湿环境,广泛分布于黑龙江、吉林、辽宁、河北、山西、内蒙古、甘肃、新疆以及青海等地,是多年生纯天然草本植物[1]。黄参资源丰富,其通体金黄,根肉质,且富含人体必需的多种营养元素,具有重要的药用价值[2]。据《本草纲目》记载,黄参味甘、性温,有补气养血等功效,被誉为“小人参”[3-4]。黄参富含人体必需的多种氨基酸、矿物质和微量元素,是一种纯天然保健食品。因此黄参是一种极具开发前景的药食兼用的植物资源。但目前对黄参的研究甚少,为有效开发黄参资源,本文对黄参不同溶剂提取物的抗氧化活性进行了初步研究。本实验采用Folin-Ciocalteu法测定黄参不同溶剂提取物中总酚的含量,并通过DPPH抗氧化、对DNA氧化损伤的保护的评价方法,比较了不同溶剂提取物清除DPPH自由基以及对DNA氧化损伤的保护的能力,为黄参作为天然抗氧化剂的研究开发提供了坚实的基础。
1 材料与方法
1.1 材料与试剂
黄参:采于甘肃省山丹县境内。秋季成熟时采收,除去杂质,将其根部阴干,磨碎,过40目筛,装入保鲜袋密封贮于冰箱中备用。
Folin-Ciocalteu试剂没食子酸标准品 2,2-diphenyl-1-picrylhydrazyl(DPPH·):Sigma公司;pBR322质粒DNA:购于大连宝生生物公司;正己烷、二氯甲烷、乙酸乙酯、甲醇、无水碳酸钠、磷酸二氢钠、磷酸氢二钠等均为分析纯。
1.2 仪器与设备
DYY-10C型电脑三恒多用电泳仪:北京六一仪器厂;722-分光光度计:上海光谱仪器有限公司;SN-D-2000超声波直插式处理仪器:广州市辛诺科超声设备有限公司;HH-S4型电热恒温水浴锅、101型电热鼓风干燥箱:北京科伟永兴仪器有限公司;电子分析天平:北京塞多利斯天平有限公司;SHZ-D(Ⅲ)循环水式真空泵:巩义市子华仪器有限责任公司;RE-52旋转式蒸发器:上海安亭实验仪器有限公司;0.5 μL~1000 μL微量移液器:法国Gilson公司。
1.3 方法
1.3.1 黄参不同溶剂提取物的制备
准确称取5.0 g黄参置于三角瓶中,按固液比1:10(g/mL)加入正己烷,在超声功率为160 W、时间30 min、室温条件下,超声提取3次,过滤,合并滤液并减压蒸馏回收溶剂,得浸膏,称重,用甲醇定容至10 mL,备用。采用同样的方法,依次用二氯甲烷、乙酸乙酯和甲醇对滤渣进行超声提取,分别得到了黄参的正己烷提取物、二氯甲烷提取物、乙酸乙酯提取物和甲醇提取物[5-7]。
1.3.2 黄参不同溶剂提取物对DPPH自由基清除试验
在试管中依次加入3.4 mL 50 μmol/L DPPH甲醇溶液和0.6 mL不同浓度的样品提取液或甲醇,剧烈振荡,保存于室温黑暗中30 min,在517 nm处测定吸光值。试验数据均为3管平均值,按下式计算DPPH自由基清除率。以样品的加入量和DPPH清除率作图,得到清除50%DPPH自由基所需要的黄参不同溶剂提取物的浓度,即 IC50值[8-9]。

1.3.3 黄参不同溶剂提取物对羟基自由基致DNA氧化损伤的保护试验
在 0.25 mL的 PCR管中依次分别加入 1 μL pBR322 质粒 DNA、10 μL 磷酸缓冲液(pH=7.4)、5 μL样品提取液、2 μL 1mmol/L的FeSO4-EDTA溶液和2 μL 3%的H2O2溶液,充分混匀并于37℃水浴锅中温育30 min。反应完后将该反应物置于1.0%的琼脂糖凝胶中电泳,并用凝胶成像仪成像[10-12]。用磷酸缓冲液代替样品提取液的管作为阳性对照,其余试剂和样品管相同。
1.3.4 没食子酸标准曲线的制作
分别取 0.04、0.06、0.08、0.1、0.12、0.14 mL 浓度为200 μg/L的没食子酸标准液于试管中,加入100 μL浓度为1 mol/L的酚试剂,混匀后加入2 mL 10%的Na2CO3溶液,并用蒸馏水定容至5 mL,摇匀室温避光反应40 min,于760 nm处测其吸光值。以没食子酸标准品的浓度C为横坐标,吸光度A为纵坐标,绘制标准曲线[13]。用最小二乘法进行线性回归,得到回归方程A=0.1167C+0.0128,并求得相关系数r=0.9993。
1.3.5 黄参不同溶剂提取物中总酚含量的测定
采用Folin-Ciocalteu方法测定[14-15]。按照上述没食子酸标准曲线制作的方法,用样品提取液来代替没食子酸标准液,其余不变。黄参不同溶剂提取物中总酚含量以100 g提取物中含有相当没食子酸的毫克数表示。
2 结果与分析
2.1 黄参不同溶剂提取物中总酚的含量测定
黄参中的抗氧化成分主要是酚类化合物[16],在不同溶剂中具有不同的溶解度,以正己烷、二氯甲烷、乙酸乙酯和甲醇为溶剂,采用超声波处理依次对黄参进行提取获得相应的提取物,并测定了不同溶剂提取物的提取率以及提取物中的总酚的含量,总酚定量以没食子酸(GA)为标准,结果表示为每100克提取物中没食子酸的毫克数。每个测定均重复3次,结果见表1。
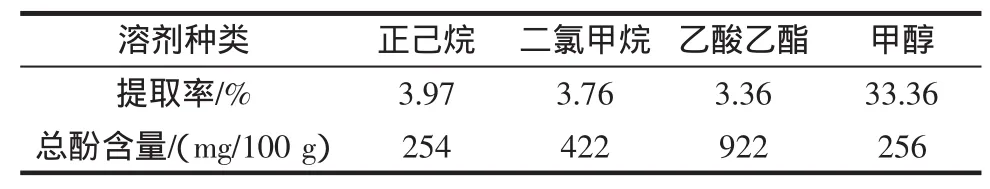
表1 黄参不同溶剂的提取率及提取物中的总酚含量Table 1 Extract rates and total phenolic contents of S.gracilis extracts with different solvents
传统的提取方法多为索氏提取等加热方法,容易使其中的活性物质发生变化,影响最后的效果,因此采用超声波提取的方法,实现了常温下充分提取并且尽可能保存了其中的活性物质,取得了较好的提取效果。由表1可以看出,虽然黄参的乙酸乙酯提取物中的总酚的含量高于正己烷、二氯甲烷以及甲醇的提取物,但是黄参甲醇提取物的得率明显高于其它几种溶剂的提取得率。
2.2 黄参不同溶剂提取物对DPPH自由基清除作用
清除质子自由基的能力是评价抗氧化物质的抗氧化性的一种重要体系。DPPH在有机溶剂中很稳定,是一种被广泛应用的自由基[16]。DPPH的有机溶剂呈紫红色,在517 nm处有一个特征吸收峰,但是当其遇到抗氧化剂时会褪色,吸光度变小。颜色越淡,吸光度越小,说明抗氧化剂的抗氧化能力越强[17]。本试验采用IC50值表示,提取物的IC50值越小,表示其抗氧化能力越强。黄参不同溶剂提取物对DPPH自由基的清除效果见表2和图1。
根据表2中不同溶剂黄参提取物清除DPPH自由基的IC50值可知:4种溶剂提取得到的黄参提取物对DPPH自由基均有一定的清除作用,如图1所示,清除作用的强弱顺序为:乙酸乙酯提取物>甲醇提取物>正己烷提取物>二氯甲烷提取物,用乙酸乙酯提取得到的提取物清除DPPH自由基效果最好。根据表1可知,不同溶剂提取物中总酚的含量由多到少排序为:乙酸乙酯提取物>二氯甲烷提取物>甲醇提取物>正己烷提取物,此顺序和对DPPH自由基的清除作用的强弱顺序不完全一致,说明在提取物中除酚类物质外,还有其它的具有抗氧化活性的物质存在,有待进一步研究。
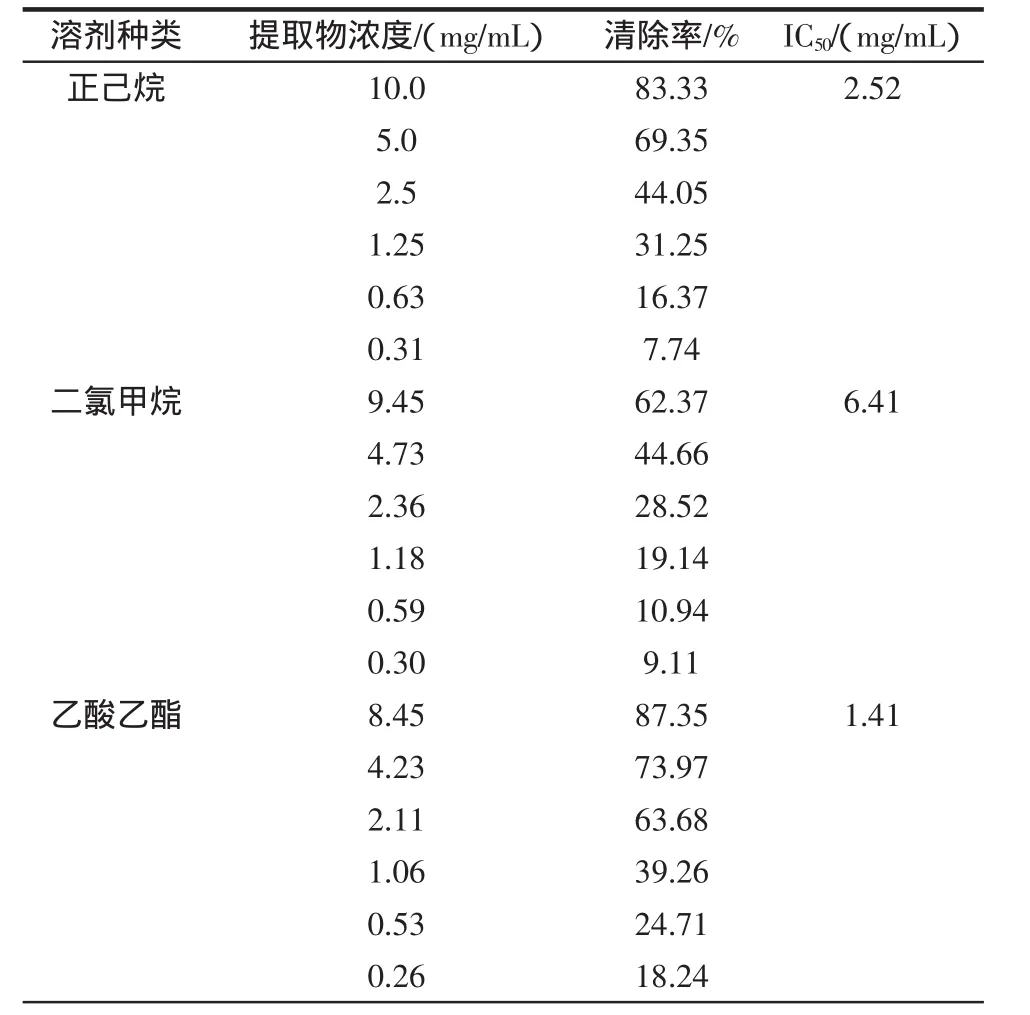
表2 黄参不同溶剂提取物对DPPH自由基清除能力评价参数表Table 2 DPPH free radical scavenging activities of S.gracilis extracts with different solvents
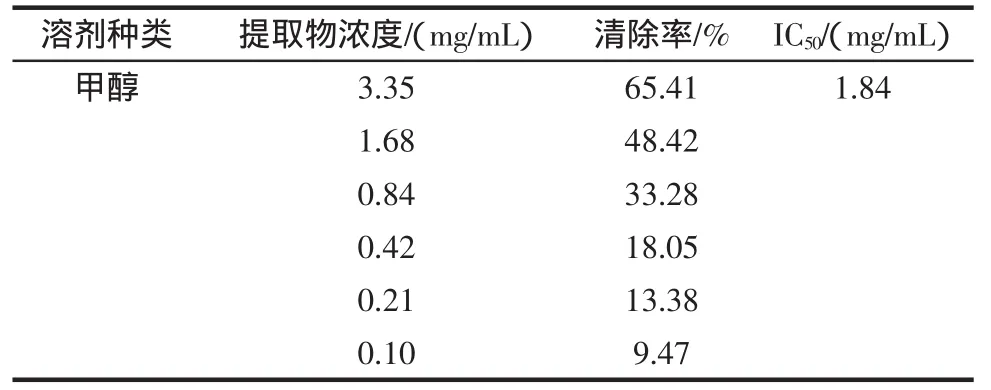
续表2 黄参不同溶剂提取物对DPPH自由基清除能力评价参数表Continue table 2 DPPH free radical scavenging activities of S.gracilis extracts with different solvents

图1 黄参不同溶剂提取物对DPPH自由基清除能力比较Fig.1 Comparison of the DPPH free radical scavenging activities of S.gracilis extracts with different solvents
2.3 黄参不同溶剂提取物对羟基自由基致DNA氧化损伤的保护作用
pBR322质粒DNA是一种环状负超螺旋DNA(SC),当pBR322质粒DNA受到损伤时,其分子中的1条链或者2条链会断裂,于是形成带切口环状(OC)和线型DNA分子(Linear)。SC、OC和Linear这3种形态的分子因其分子质量不同,所以其分子涌动的速度存在差异。在Fenton体系中pBR322质粒DNA受到了羟基自由基的损伤,因其损伤程度不同,3种形态的分子所占的比例不相同,SC所占比例越低说明羟基自由基对质粒DNA的损伤程度越大[18]。因此,对DNA损伤的保护程度可用来评价抗氧化剂的抗氧化性。图2为黄参不同溶剂提取物对DNA氧化损伤的保护作用。可知,在电场中涌动速度由快到慢的顺序依次为:SC>Linear>OC。当DNA受到羟基自由基的攻击后,分子受到破坏,形成Linear和OC两种分子形态,但是当在反应体系中加入黄参提取物后,DNA受到不同程度的保护。在提取物浓度相同的情况下,二氯甲烷提取物和乙酸乙酯提取物对羟基自由基致DNA氧化损伤的保护作用较强,正己烷和甲醇提取物之间的保护作用的强度较弱但差异都不显著。根据试验结果可以看出,黄参不同溶剂的提取物均对DNA的损伤有保护作用,其保护程度的强弱与提取物中总酚含量的多少基本相对应,说明酚类物质对DNA氧化损伤具有很好的保护作用。DNA可受化学物质,辐射等多种伤害,可能引发疾病,对身体造成极大地损伤,因此对DNA的保护十分重要。
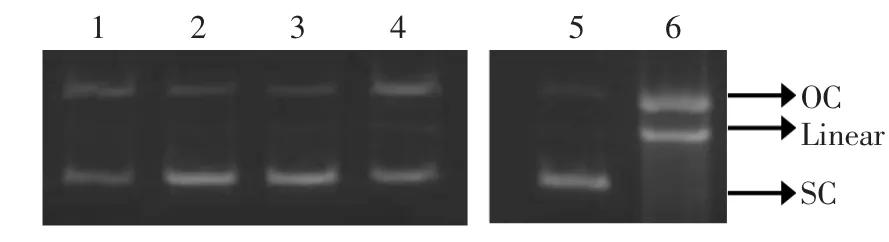
图2 黄参不同溶剂提取物对DNA氧化损伤的保护作用Fig.2 Protective effects of S.gracilis extracts with different solvents on hydroxyl radical mediated DNA degradation
3 结论
黄参的不同溶剂提取物均具有较强的抗氧化活性,可以很好的清除DPPH自由基,并且对羟基自由基致DNA氧化损伤具有较好的保护作用。不同溶剂提取物中总酚的含量由多到少的顺序为:乙酸乙酯提取物>二氯甲烷提取物>甲醇提取物>正己烷提取物;但是对DPPH自由基的清除作用的强弱顺序为:乙酸乙酯提取物>甲醇提取物>正己烷提取物>二氯甲烷提取物,和总酚含量的趋势不完全一致,说明在提取物中可能存在其它的抗氧化物质对DPPH自由基具有清除作用;在对DNA损伤的保护试验中,乙酸乙酯提取物和二氯甲烷提取物的保护作用明显高于其余2种提取物的保护作用,基本和总酚含量的趋势保持一致,说明酚类物质对DNA的损伤具有较好的保护作用,但是也不排除其它影响DNA氧化损伤的物质的存在,需要进一步的研究。
总之,黄参各溶剂提取物均不失为良好的天然抗氧化剂,具有开发和利用的价值,如果对其粗提物进行进一步分离纯化,从中可筛选出具有生物活性的单体化合物,将更具有研究价值和开发前景。
[1]陈叶,刘玉环,王治江,等.野生黄参的特征特性及栽培技术[J].中国种业,2010(7):94-95
[2]邵志宇,张云海,蒋科技,等.藏药迷果芹根中的化学成分[J].天然产物研究与开发,2003,15(3):196-198
[3]陈叶,陈天仁,罗光宏.黄参营养价值及加工工艺技术研究[J].食品科技,2003(11):96-100
[4]罗光宏,陈叶.河西走廊野生可食植物资源及利用研究[J].食品科学,2002,23(8):298-300
[5]杨再,陈佳铭,黄晓兰,等.天然植物有效成分的超声提取技术[J].工艺与设备,2008(2):41-44
[6]Sune Sporring,Soren Bowadt,Bo Svensmark,et al.Comprehensive comparison of classic Soxhlet extraction with Soxtec extraction,ultrasonication extraction,supercritical fluid extraction,microwave assisted extraction and accelerated solvent extraction for the determination of polychlorinated biphenyls in soil[J].Journal of chromatography A,2005(1090):1-9
[7]Bin Zhao,Clifford A Hall.Composition and antioxidant activity of raisin extracts obtained from various solvents[J].Food chemistry,2008(108):511-518
[8]Francis M Awah,Peter N Uzoegwu,Julius O Oyugi,et al.Free radical scanvenging activity and immunomdulatory effect of Stachytarpheta angustifolia leaf extract[J].Food chemistry,2010(19):1409-1416
[9]Brigita Lapornik,MIrko Prosek,Alenka Golc Wondra.Comparison of extracts prepared from plant by-products using different solvents andextractiontime[J].Journaloffoodengineering,2005(71):214-222
[10]Wan-Ibrahim W I,Sidik K,Kuppusamy U R.A high antioxidant level in edible plants is associated with genotoxic properties[J].Food chemistry,2010(122):1139-1144
[11]Vijayalaxmi,Tice R R,Strauss G H S.Assessment of radiationinduced DNA damage in human blood;lymphocytes using the single cell gel electroohoresis technique[J].Mutal Res,1992(271):243-252
[12]安文林,李林,朴景华,等.单细胞凝胶电泳技术分析过氧化氢对大鼠外周血淋巴细胞DNA的损伤作用[J].中国老年学杂志,2000,5(20):296-299
[13]潘英明,梁英,朱志仁,等.槐花米抗氧化成分的提取及其活性研究[J].林产化学与工业,2007,27(2):41-44
[14]Goupy P,hugues M,Boivin P,et al.Antioxidant composition and activity of barley (Hordeum vulare)and malt extracts of isolate phenolic xompounds[J].Journal of science food agriculture,1999(79):1625-1634
[15]Cengiz Sarikurkcu,Kadir Arisoy,Bektas,et al.Studies on the antioxidant activity of essential oil and different solvent extract of Vitex agnus castus L fruits from Turkey[J].Food and chemical toxicology,2009(47):2479-2483
[16]王凯,朱志仁,潘英明,等.罗汉果茎不同溶剂提取物抗氧化活性研究[J].食品工业科技,2008,29(3):57-62
[17]陆建,樊伟,孔维宝,等.大麦总多酚不同溶剂提取物对DPPH自由基清除能力的影响[J].食品与生物技术学报,2008,27(1):57-61
[18]Wiseman H,Halliwell B.Damage to DNA by reactive oxygen and nitrogen species:role in inflammatory disease and progression to cancer[J].Biochem J,1996(313):17-29
Study on Antioxidant Activity of Different Solvents Extracts of Sphallerocarpus Gracilis
ZHOU Rui1,TIAN Cheng-rui1,*,GAO Chun-yan1,HAO Guo1,GAO Ya-ni1,KANG Yu-xin1,MENG You-wu2
(1.College of Food Engineering and Nutritional Science,Shaanxi Normal University,Xi'an 710062,Shaanxi,China;2.Shandan Junmachang Food Company,Shandan 734104,Gansu,China)
To examine the antioxidant activity of the different solvent extracts of Sphallerocarpus gracilis.Antioxidant activities of the samples were determined by two different test systems,DPPH and DNA oxidative damages induced by positioned and non-positioned hydroxyl free radicals assays.In all systems,the extracts exhibited different antioxidant activity in DPPH and DNA assays because of the different solvents.Ethyl acetate extract exhibited excellent activity potential than those of other extracts (hexane,dichloromethane and methanol).As expected,amount of total phenolics was very high in this extract,but others were different.No positive correlation was observed between the antioxidant activity potential and total phenolic level of the extract,so maybe there were other antioxidants in the extracts of the S.gracilis with different solvents.Uses of Folin-Ciocalteu,DPPH and DNA oxidative damages are important to determine the antioxidant activity of S.gracilis.
Sphallerocarpus gracilis;extracts;DPPH;DNA oxidative damage
周瑞(1987—),女(汉),硕士研究生,研究方向:食品科学。
*通信作者:田呈瑞(1955—),男(汉),教授,学士,研究方向:食品科学。
2011-12-30
