猪软骨Ⅱ型胶原蛋白的制备及结构表征
2012-12-05刘高梅任海伟王永刚
刘高梅,任海伟 ,王永刚
(1.山西轻工职业技术学院轻工化工工程系,山西 太原 030013;2.兰州理工大学生命科学与工程学院,甘肃 兰州 730050)
猪软骨Ⅱ型胶原蛋白的制备及结构表征
刘高梅1,任海伟2,*,王永刚2
(1.山西轻工职业技术学院轻工化工工程系,山西 太原 030013;2.兰州理工大学生命科学与工程学院,甘肃 兰州 730050)
从猪软骨中提取纯化Ⅱ型胶原蛋白,并对其进行结构表征。结果表明,猪软骨Ⅱ型胶原蛋白的最佳提取条件为温度35℃、加酶量0.8%胃蛋白酶、时间25 h,该条件下胶原蛋白提取率可达49.28%,纯度为92.65%。SDS-PAGE结果显示Ⅱ型胶原蛋白有2条α链和1条β链。红外光谱和电镜扫描结果显示该胶原蛋白具有典型的酰胺基团,有完整的三股螺旋结构。
猪软骨;Ⅱ型胶原蛋白;提取;结构表征
胶原蛋白是一种天然高分子化合物,是结缔组织重要的结构蛋白质,广泛存在于动物的皮、骨、软骨、牙齿、肌腱、韧和血管中[1]。胶原蛋白分子由3条α多肽链紧紧环绕形成三螺旋结构,每条α多肽链由重复的三联体序列(Gly-X-Y)n组成,X和Y一般是脯氨酸(Pro)和羟脯氨酸(HyP)。目前已报道的胶原蛋白类型共有19种,其中Ⅰ、Ⅱ、Ⅲ、和Ⅴ型是纤维状的胶原蛋白。胶原蛋白具有一定的凝胶强度、乳化能力和低黏度等功能性质以及生物相容性、低免疫原性、可降解性、止血与促进细胞生长、吸水保湿等医学特性[2]。Ⅱ型胶原蛋白是软骨基质中含量最高的主要有机成分,为软骨组织的特征性蛋白,与糖胺多糖形成紧密的结合,使软骨具有柔韧性,能吸收冲击和承受负载。Ⅱ型胶原蛋白特有的结构和化学组成不仅使其在生物医学材料、药物输送载体、组织工程、化妆品及食品等领域得到了广泛应用[3],而且对于治疗类风湿关节炎、诱导性关节炎和骨肿瘤等疾病方面也起着重要的作用[4-6]。
软骨是畜禽加工的副产物,主要应用于食品与饲料工业中。研究表明,猪Ⅱ型胶原蛋白与人关节内的Ⅱ型胶原蛋白同源性较高。因此,为了扩展Ⅱ型胶原蛋白来源途径,并有效利用猪软骨资源,本文以猪软骨为原料,采用酸酶结合法提取Ⅱ型胶原蛋白,并研究其结构特性,以期为猪软骨胶原蛋白在生物医学材料领域的应用提供理论参考。
1 材料与方法
1.1 材料与试剂
新鲜猪软骨,市售,生理盐水清洗后切成薄片状(0.5 cm×0.5 cm),烘干粉碎后得到猪软骨粉,备用。猪软骨粉成分为:水分7.17%,灰分9.31%,蛋白质53.38%,脂肪1.47%,碳水化合物28.67%。
Ⅱ型胶原蛋白(纯度>98%):sigma公司;羟脯氨酸(纯度>98%):上海索莱宝生物科技有限公司;胃蛋白酶:郑州荔诺生物科技有限公司;氯胺T、N,N-甲叉双丙烯酰胺:上海艾研生物科技有限公司;考马斯亮蓝R250:上海佳和生物科技有限公司;单体丙烯酰胺、对二甲氨基苯甲醛、正丙醇、异丙醇等试剂均为分析纯。
1.2 仪器与设备
CARY 50紫外可见分光光度计:美国VARIAN公司;HPX-9162MBE数显鼓风干燥箱:上海博讯实业有限公司;FD-1-55真空冷冻干燥机:北京博医康实验仪器有限公司;UNIVERSAL32R冷冻高速离心机:German公司;DYY-12电泳仪:北京市六一仪器厂;Nexus670 FT-IR傅里叶变换红外光谱仪:美国尼高力公司。
1.3 方法
1.3.1 猪软骨原料的成分分析
水分含量测定参照GB 5009.3-2010《食品中水分的测定》;脂肪含量测定参照GB/T 14772-2008《食品中粗脂肪的测定》;蛋白质含量测定参照GB 5009.5-2010《食品中蛋白质的测定》,灰分含量测定参照GB 5009.4-2010《食品中灰分的测定》,碳水化合物含量测定采用蒽酮比色法。
1.3.2 猪软骨胶原蛋白的提取纯化工艺流程
软骨粉→乙醚脱脂(4℃,48h)→脱除盐溶性杂蛋白(1 mol/LNaCl)→脱钙(0.1 mol/L EDTA,48 h)→去除蛋白多糖(4mol/L盐酸胍,4℃,24h)→离心(12000r/min,20 min)→沉淀→含有胃蛋白酶的乙酸溶液(乙酸浓度0.5 mol/L)→离心(条件同上)→上清液→盐析(3 mol/L NaCl,4 ℃,36 h)→透析(4 ℃,48 h)→DEAE-52 离子交换树脂洗脱(0.2 mol/L NaCl-Tris-HCl)→分步收集→真空冷冻干燥→胶原蛋白纯品[7]。
1.3.3 胶原蛋白含量的测定
胶原蛋白含量以羟脯氨酸含量计,参照GB/T 9695.23-2008/ISO3496:1994《肉与肉制品羟脯氨酸含量测定》中方法测定。首先建立羟脯氨酸标准品的浓度与吸光度的标准曲线,拟合回归方程为C=0.21734A-0.00005(R2=0.9987),式中:C 为羟脯氨酸浓度,(mg/L);A为吸光度值。然后对本试验提取的胶原蛋白按标准曲线测定方法测定其吸光度,按回归方程换算出样品中的羟脯氨酸浓度。计算胶原蛋白提取率和纯度[1]。胶原蛋白提取率计算公式为:

1.3.4 SDS-聚丙烯酰胺凝胶电泳检测(SDS-PAGE)
[8]和[9]进行。
1.3.5 傅里叶变换红外光谱分析
参考文献[10]。
1.3.6 电镜扫描
委托中科院兰州化学物理研究所检测。
2 结果与分析
2.1 胶原蛋白提取工艺研究
2.1.1 加酶量对胶原蛋白提取率的影响
加酶量对胶原蛋白提取率的影响,见图1。
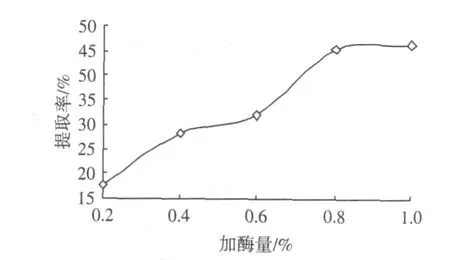
图1 加酶量对胶原蛋白提取率的影响Fig.1 Effect of enzyme addition amount on extraction rate of collagen
由图1可知,在加酶量为0.2%~0.8%范围内,随着加酶量的增加,胶原蛋白提取率逐渐提高,当加酶量大于0.8%时提取率趋于稳定。这是因为,如果加酶量过低,则与底物不能充分反应,而加酶量过高则会引起酶分子之间的相互作用,阻止酶解反应的顺利进行。因此,最适加酶量确定为0.8%。
2.1.2 时间对胶原蛋白提取率的影响
时间对胶原蛋白提取率的影响,见图2。

图2 时间对胶原蛋白提取率的影响Fig.2 Effect of time on extraction rate of collagen
由图2可知,随着时间的延长,胶原蛋白提取率逐渐增加,但时间25 h后提取率减缓,甚至有下降趋势,说明时间的适当延长有利于胶原蛋白提取率的最大化。这是因为,天然胶原是不可溶的,必须使用胃蛋白酶切除三股螺旋链两端的端肽才能转变为可溶性胶原蛋白。当提取时间较短时,胃蛋白酶作用有限,Ⅱ型胶原还不能完全溶解到溶液中,而当Ⅱ型胶原蛋白的提取率达到某一极限值时,即使延长提取时间提取率也不会有明显的增加,反而使无规卷曲结构增加。因此,提取时间确定为25 h。
2.1.3 温度对胶原蛋白提取率的影响
胶原蛋白的变性温度在pH中性时为40℃~41℃,酸性时为38℃~39℃,因此胶原蛋白最好在低温环境进行提取。温度对胶原蛋白提取率的影响,见图3。

图3 温度对胶原蛋白提取率的影响Fig.3 Effect of temperature on extraction rate of collagen
由图3可知,随着温度的升高,胶原蛋白提取率呈现先增加后减小的趋势,温度30℃时提取率最高为49.27%。这是因为,一方面,在酶促反应中,温度的升高有利于使更多酶的能量达到反应的活化能,从而加快酶解反应的速度并提高提取率;另一方面,温度超过胃蛋白酶的最适温度后,酶活力反而下降甚至酶失活。另外,温度过高还会裂解胶原蛋白的氢键和共价键,导致其分子结构遭到破坏而变性,影响其生理活性。温度35℃~40℃时提取率最低,说明该温度范围已接近Ⅱ型胶原的变性温度,可能有部分Ⅱ型胶原已经发生变性。综合考虑确定提取温度为30℃。
2.2 结构表征
2.2.1 傅里叶变换红外光谱
FT-IR可以表征胶原蛋白的三股螺旋结构,猪软骨胶原蛋白红外图谱,见图4。可知,3330 cm-1处吸收峰为酰胺A带N-H伸缩振动,而且N-H伸缩与氢键形成了缔合体;3095 cm-1吸收峰是酰胺B带C-H伸缩振动,1656 cm-1处出现酰胺I带的C=O伸缩强振动峰,也是形成三股螺旋内氢键的C=O基团的振动峰;1558 cm-1处是酰胺Ⅱ带的N-H弯曲振动吸收蜂;1456cm-1处属于胶原蛋白氨基酸残基的侧链基团,应是苯环骨架振动造成的,说明有苯环存在。1240 cm-1为酰胺Ⅲ带的N-H伸缩振动变形峰。图谱中相应的波数符合胶原的吸收峰位,可以证明本实验所提取的样品为具有完整三股螺旋的胶原蛋白[11]。

图4 猪软骨胶原蛋白红外图谱Fig.4 FT-IR spectrum of collagen from porcine articular cartilage
2.2.2 SDS-PAGE电泳
SDS-PAGE电泳,见图5。

图5 SDS-PAGE电泳图谱Fig.5 SDS-PAGE electrophoretic spectrum of collagen
由图5可知,胶原蛋白含2条α链(α1和α2)和聚合链β,说明本实验所提取的猪软骨胶原蛋白是Ⅱ型胶原蛋白,其中α1链的相对分子量约为120 ku,α2链相对分子量约为111 ku,β链相对分子量约为200 ku。
2.2.3 电镜扫描
软骨胶原蛋白电镜扫描图,见图6。

图6 软骨胶原蛋白电镜扫描图Fig.6 Scanning electron microscope of collagen
由图6电镜扫描结果可知,猪软骨Ⅱ型胶原蛋白由胶原纤维形成,且胶原纤维排列致密,直径很细,并相互交织成网状,具有三螺旋结构的成纤胶原蛋白特征。
3 结论
采用酸酶结合法提取猪软骨Ⅱ型胶原蛋白,最佳提取条件为温度35℃、胃蛋白酶的加酶量0.8%、提取时间25 h,该条件下胶原蛋白提取率可达49.28%,纯度为92.65%。SDS-PAGE结果显示Ⅱ型胶原蛋白有2条α链和1条β链。红外光谱和电镜扫描结果显示该Ⅱ型胶原蛋白具有典型的酰胺基团,有完整的三股螺旋结构。这说明提取过程中,胃蛋白酶对猪软骨Ⅱ型胶原蛋白的结构没有破坏,可使胶原二级结构保持稳定,该提取工艺可行。
参考文献:
[1]段宙位,申铉日,陈秀明,等.罗非鱼尾胶原蛋白的提取与鉴定[J].食品科学,2012,33(6):59-64
[2]李兴武,李洪军.微波辅助提取猪皮胶原蛋白工艺优化[J].食品科学,2012,33(6):11-14
[3]曹慧,许时婴.酶解工艺对Ⅱ型胶原蛋白分子结构及提取率的影响[J].食品与发酵工业,2010,36(1):52-55
[4]彭燕豪,叶春婷,邹海燕,等.猪软骨Ⅱ型胶原的制备及理化性能分析[J].生物药学工程与临床,2001,5(3):125-127
[5]曹慧,张忠慧,许时婴.鸡胸软骨酶解产物的表征及对类风湿关节炎大鼠的免疫调节作用[J].食品科学,2012,33(3):243-247
[6]姜旭淦,陈盛霞,丁建霞,等.猪软骨Ⅱ型胶原蛋白的提取纯化与鉴定[J].江苏大学学报:医学版,2006,16(10):389-391
[7]王孟津,汪海波,桂萌,等.草鱼鱼鳞胶原蛋白的提取及其理化性质研究[J].食品科学,2009,30(18):113-116
[8]汤俊,魏东芝,张国钧,等.胶原蛋白的高效制备及与明胶的鉴别[J].食品科学,2010,31(7):54-60
[9]张俊杰,段蕊,许晓静,等.鱿鱼鱼皮酶溶性胶原蛋白部分生化性质研究[J].食品与发酵工业,2009,35(12):57-60
[10]任海伟,王永刚,宋育璇,等.胶原多肽制备工艺优化的研究[J].食品工业科技,2009,30(4):261-263
[11]刘志娟,张朝辉,赵雪,等.单环刺螠体壁胶原蛋白的提取及其理化性质[J].食品科学,2012,33(7):37-40
Preparation Technology and Structure Characterization of Collagen TypeⅡfrom Porcine Cartilage
LIU Gao-mei1,REN Hai-wei2,*,WANG Yong-gang2
(1.School of Light Industrial Chemical Engineering,Shanxi Light Industry Technical College,Taiyuan 030013,Shanxi,China;2.College of Life Science and Engineering,Lanzhou University of Technology,Lanzhou 730050,Gansu,China)
Collagen typeⅡ was isolated from porcine cartilage and characterized.In the present study,the effects of enzyme addition amount,temperature,and time on extraction rate of collagen typeⅡwere explored.The results showed that the optimal conditions for collagen typeⅡextraction were pepsin dose 0.8%(calculated based on crude protein weight),temperature of 35℃,and time of 25 h.Under these conditions,the extraction efficiency of collagen was 49.28%,the purity reached 92.65%.It was revealed that three protein chains(i.e.two α chains and one β chain)existed in collagen type II by SDS-PAGE electrophoresis.Furthermore,a complete triple helix structure was also noticed by FT-IR and electron microscope scanning.
porcine cartilage;collagen type II;extraction;structure characterization
刘高梅(1969—),女(汉),讲师,硕士,研究方向:食品科学。
*通信作者
2012-06-25
