基于同步辐射的不同时期肿瘤新生血管形态结构定量的初步分析
2012-12-05向秋静李晶刘苹孙建奇
【作 者】向秋静,李晶,刘苹,孙建奇
1 上海交通大学生命科学技术学院,上海,200240
2 上海交通大学生物医学工程学院和MED-X研究院,上海,200030
0 引言
乳腺癌是女性中常见的恶性肿瘤。2008年世界卫生组织对各种疾病死亡的统计结果显示,乳腺癌在高收入国家中位于前十位。 早期发现,改善乳腺癌结果和提高生存率,仍然是乳腺癌控制的基石[1]。
由于实验观察到在没有血管新生条件下肿瘤生长受到限制,Folkman最早提出了血管依赖性理论[2-3]。进一步有实验证明,肿瘤恶变与血管新生之间有某种联系[4]如肿瘤内微血管网络与肿瘤发生、生长和转移间的关系[5-8]。越来越多的研究表明,瘤内微血管网络的密度[9]、弯曲度[10-11]、分叉类型[12]和分形维度(Fractal dimesion,FD)[13-14]等指标能够有助于区分正常血管和肿瘤血管。随着成像技术的发展,同步辐射光源的产生解决了传统的血管造影术分辨率不高的问题[15-16],其对离体肿瘤内微血管网络成像分辨率可达几十mm或更小[17-20,30],能够获取较为完整的肿瘤微血管网络。这样为接下来通过数字图像处理技术定量分析肿瘤微血管网络结构提供了可能。本文针对肿瘤微血管的异常形态和成像所得到的庞大数据量,设计了分块加载的双阈值分割方法进行定量前的准备。
目前,微血管密度度(Microvessel densitl,MVD)和肿瘤分级是临床常用的指导肿瘤治疗的定量指标。大量研究指出,乳腺肿瘤的MVD越高意味着较高的复发率和较低的生存率[9,21-23]。另外,通过活体显微成像手段观测实体恶性瘤内部新生血管,可得出这样的结论:高度紊乱、缠绕呈囊状、分布高度不均匀、血管间距变化大、异常弯曲和扩张、旁通、闭环、过度分叉和混乱分流[24-27]。对于肿瘤血管网络这种混乱的结构来说,分形的采用恰好弥补了欧式几何无法描述复杂无规则物体描述的缺陷。它用单一数值(分形维度)描述不规则物体的复杂度,同时也反映出该物体的生长类型[13]。然而目前关于分形的运用大都集中于2D平面上[28-29]。有别于以前大部分针对2D图像进行的分形分析,Laurent Risser实验小组进行同步CT成像的肿瘤模型的分形分析,得到小鼠模型的神经胶质瘤的FD为1.9到2.2之间,明显高于对照组的结果[30]。
本文基于同步辐射的CT吸收成像,提取5个不同生长时间点的肿瘤内微血管网络,采用自主设计的分块加载双阈值方法进行大数据量三维血管的分割,并对随时间增长肿瘤内微血管网络的变化,结合观察结果和定量指标(MVD和FD)进行初步分析。
1 材料和方法
1.1 样品准备
5周龄BALB/c雌性裸鼠(购买于上海西普尔必凯实验动物公司),饲养于IVC独立鼠笼中,整个环境严格消毒并人工控制12小时昼夜变换光照。裸鼠自由摄取钴60辐射灭菌饲料及高温灭菌水。用DMEM培养基贴壁培养鼠源4T1乳腺癌细胞于37oC、5% CO2细胞培养箱内,细胞贴壁生长,呈相互连接的片状。细胞达80%-90%密度时,等量培养基终止后离心,去上清,PBS重悬成细胞悬液,细胞计数为3×106个/ml,冷冻待用。取0.1 ml细胞悬液分别注入小鼠右侧股部背侧皮下。
接种后待小鼠清醒后放回专用无菌鼠笼中喂养,提供灭菌后的鼠粮和水,并且定期对鼠笼进行杀菌清洁。待肿瘤接种一定时间后,进行血管灌注和离体肿瘤样本的采集。实验共分为5个时间点,分别为20 d、25 d、30 d、35 d和40 d,每个时间点为3个样本。肿瘤血管灌注采用常见的研究微循环的造影剂microfil(Flow Tech Inc.)。经反复实验论证,较传统造影剂硫酸钡能到达更细小的微血管。灌注过程中用到实验室自主设计的双点滴灌注系统,使用0.016g/ml的戊巴比妥钠溶液,按0.5 ml/100g小鼠体重的比例将小鼠麻醉后,仰卧固定,从剑突至耻骨联合开口后,仔细打开胸腔。用0.6×0.25 mm静脉注射针自心尖扎入左心室,先用40U/ml肝素生理盐水灌注5 min,然后用福尔马林溶液灌注5 min,之后匀速推入microfil 大约5 ml。4oC冰箱过夜后,取出肿瘤组织用于成像。
1.2 成像
将灌注后的离体肿瘤放于特制的样品台上,利用上海光源X 射线成像及生物医学应用光束线站(BL13W)的同步辐射系统进行离体肿瘤样本的CT成像,使用的探测器最小分辨率为9 mm,探测器距光源为25 cm,能量为20 kev。每个样本共获1200CT张断层图,每张断层拍摄角度步进速度为(180/1200)度/张,需时约15 min。得到肿瘤组织新生血管的三维断层图像后。利用常规滤波反投影算法对投影数据进行重建,最终的断层图转换为8位无压缩tif数据格式进行存储,由于造影剂和肿瘤周围组织吸收的巨大差异,使得结果具有很好的对比度,能够较完整的保留微血管结构。对断层图进行简单的光照强度归一化后,导入三维图像处理软件Amira (Mercury Computer Systems,Inc./TGS Group),观察肿瘤新生血管的三维图像。
2 图像分析
2.1 图像处理
由于大量的微血管直径约为20mm左右,采用单一阈值分割势必会过分割或欠分割,无法较好地提取完整而正确的肿瘤新生血管网络,因此采用双阈值完成血管的分割。首先,利用Frangi提出的基于不同尺度空间的血管增强滤波器,进行细小血管的增强[31]。由于该滤波器能够自主选择想要增强的管状物体的尺度,因此仅采用较小尺度(sigma=1,2)增强细小血管,也避免了由于大尺度所造成的血管过度平滑和粘连的现象。另外,该滤波器对于背景噪声也有较好的抑制作用,有利于接下来利用单一阈值进行细小血管的分割。然后,分别对增强前后的图像进行阈值分割,得到较大的血管和较小的血管。将两种图像进行叠加,运用形态学闭操作填补叠加后的断层血管内部的空洞,同时运用开操作和重构去掉长度过短(根据实验样本测试得出结构元素取线型,长度取15像素效果最好)的物体后,得到最终的分割结果。
2.2 图像分区
如图1所示,取肿瘤中间三分之一段的三维图像进行统计分析,并且按照不同的半径将选区分为三个互不相交的子分区,分别称作外围区域(R1)、过度区域(R2)和中心区域(R3),其目的在于探讨肿瘤生长过程中不同区域内血管生长变化与分布的关系。(a)20 d肿瘤的部分采样区域的体绘制;(b)以不同颜色来分别表示不同的分区,从外到内依次为1区、2区、3区。重建后的数据,首先经过预处理解决断层之间光照不均的现象,接着利用双阈值法分割,最后对分割后的血管网络进行血管密度和分形维度的统计分析。
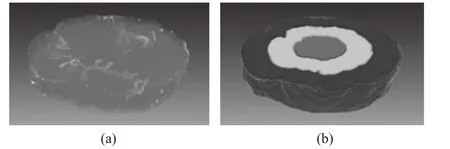
图1 肿瘤分区示意图。Fig.1 A simple illustration of rezoning from a vertical view
2.3 定量指标
对每一个样品的不同区域分别计算MVD和FD。
分形维度描述分形物体对其所在空间填充程度,其计算方法主要有豪斯多夫维数、计盒维数和沙盘维数等,其中最常用是盒维数。盒维数的计算是通过用无数个边长为r均匀分割的网格来划分分形物体,然后数出最少需要多少个网格来覆盖这个分形,记为N。这样对网格逐渐精细下去,所需用来覆盖的网格数逐渐增加,因此网格大小、覆盖所需网格数和分形维度之间的关系如下:

当 r I 0 时,可得到:
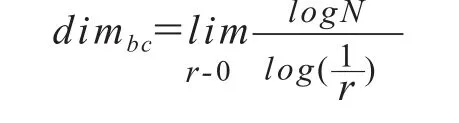
本实验中采用盒维数来代表肿瘤微血管的分形维度,简称FD。
3 结果
3.1 肿瘤体积变化
将4T1乳腺癌细胞接种于小鼠右侧股部背侧皮下,待该瘤体生长20 d、25 d、30 d、35 d、40 d时,测得肿瘤体积分别为(0.088±0.025)cm3、(0.195±0.058)cm3、(0.512±0.068)cm3、(0.686±0.151)cm3、(0.988±0.276)cm3。肿瘤体积随时间一直在不断增大,并且在20 d到25 d变化较为缓慢,而25 d到30 d的增幅最大。
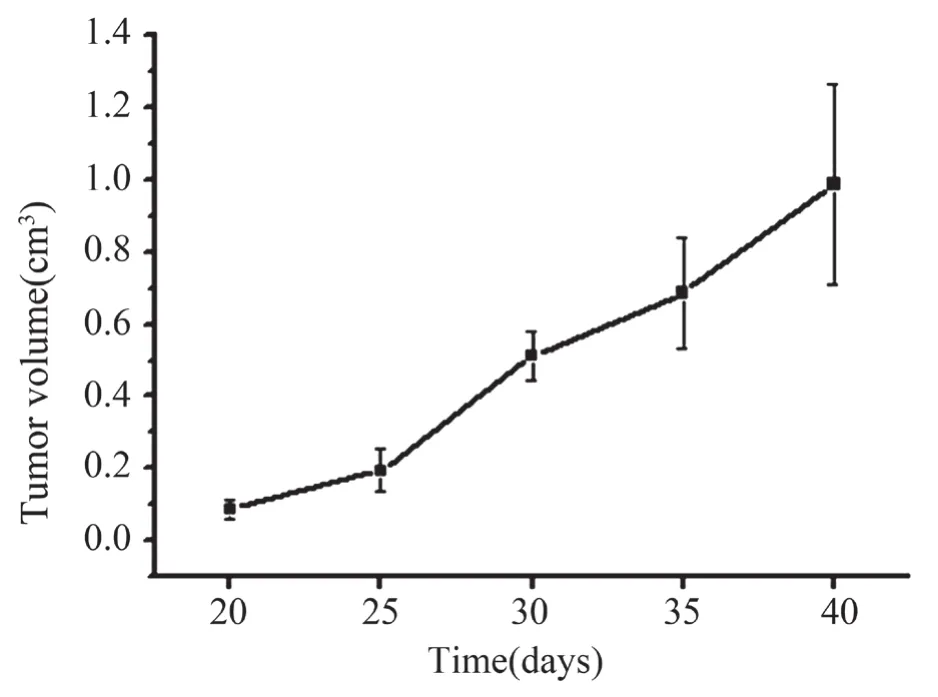
图2 皮下接种4T1细胞后肿瘤的生长曲线 (n=3)Fig.2 Growth of tumor after injected subcutaneous transplantation of 4T1 cells(n=3)
3.2 瘤内微血管形态变化
从肿瘤的CT图像重建后的体绘制图(图3和图4)可以看出,肿瘤内部新生血管分布不均匀,局部血管呈絮状,分布密集,杂乱无章,有许多较大的无血管区域。20 d的肿瘤血管较粗;20 d到25 d肿瘤血管迅速增加,且以细小血管为主,极为密集;到30 d MVD明显下降,形成大片的无血管区域;随后肿瘤MVD递减,到40 d仅剩在靠近肿瘤边缘的地方有少量血管。

图3 随时间增长瘤内微血管的形态变化Fig.3 Development of tumor microvascular over time
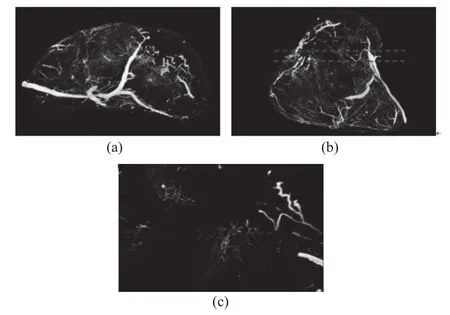
图4 20 d肿瘤血管的三维重建图Fig.4 Visualization of reconstructed tumor microvessel structure of Day 20
3.3 分区定量结果
为了更好的研究肿瘤血管不同区域的分布情况,将肿瘤中间三分之一段取出,然后按半径从外到内依次划分为三个区域(图1),分别称作外围区域(1区)、过度区域(2区)和中心区域(3区),对肿瘤进行分区域的MVD和FD计算,结果图5所示。每个分区内的血管密度随时间呈抛物线分布,25 d时MVD最大,40 d时MVD最小。从观察MVD的空间分布(图3)来看,20 d到25 d时血管分布较为均匀,25 d以后中心血管密度减少较快。与MVD结果一致的是FD也在25 d达到最大,此后逐渐递减,到40d时FD最小,且越往中心FD越小。预示着肿瘤血管在量变的同时也有着“质”的变化,即结构复杂度的变化。FD的数值范围,与以前关于脑肿瘤分形结果相符[30]。
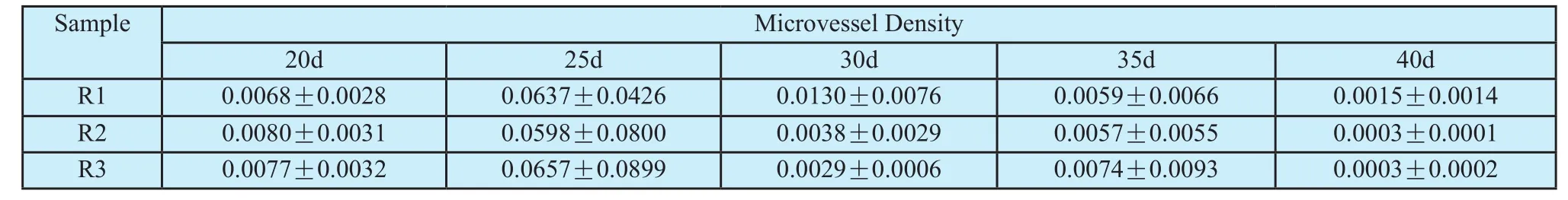
表1 不同生长时间、不同分区的肿瘤微血管密度的统计结果Tab.1 Quantitative estimates of microvessel density(MVD)of different growth periods and different subregions.
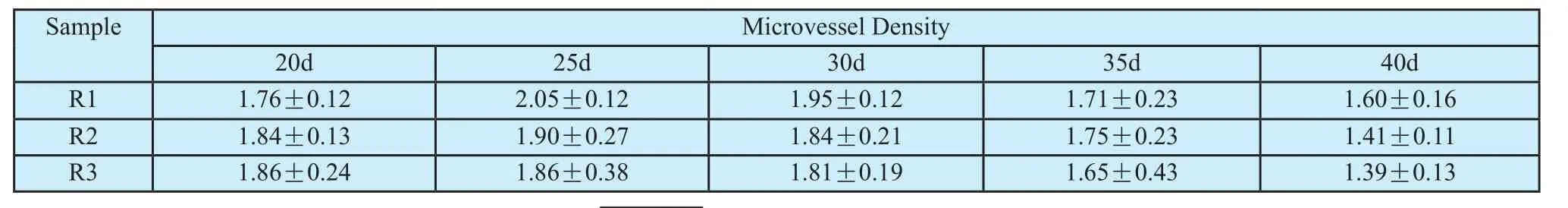
表2 不同生长时间、不同分区的肿瘤微血管分形维度的统计结果Tab.2 Quantitative estimates of microvessel fractal dimension(FD)of different growth periods and different subregions

图5 不同时间和不同分区内的MVD和FD分布图(n=3)Fig.5 Microvessel density and fractal dimension distribution at different time and in different locations(n=3).
5 讨论
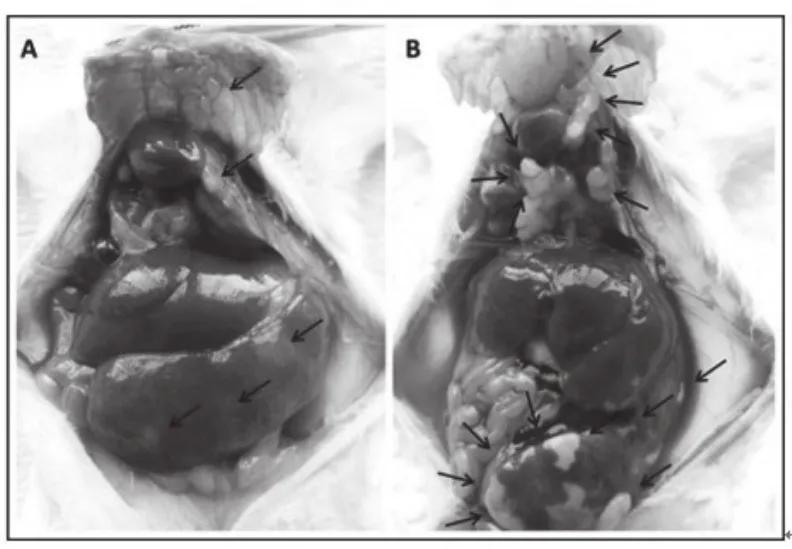
实验得出的不同生长时间肿瘤微血管网络的分形维度的变化趋势与MVD的变化趋势基本一致,均为先增大后减小,体现出肿瘤从增长到退化的一个生长周期。这个生长周期也包含着肿瘤内部微血管网络密度和复杂度的共同变化。肿瘤从无到有再到40 d的生长时间过程中,25 d时肿瘤血管分行维度和血管密度同时达到最大,与直观的观测结果一致,体现肿瘤目前正处于高度活跃状态,形态结构最为复杂。然而,从分别比较各个时间点的不同区域血管定量结果来看,中心区域血管密度始终较边缘低,且血管体积在25 d到30 d这个过渡期出现了迅速飞跃,血管密度在25 d前后有着骤升和骤降的过程。由此推断乳腺肿瘤在生长过程的前期(25 d前)和后期(25 d后)与肿瘤血管的生长速度变化有关。在肿瘤生长前期即20 d到25 d这段时间,肿瘤新生血管迅速增长,依次比较三个分区,第25 d的平均血管密度分别约为第20 d的9倍、7倍、9倍,而肿瘤平均体积由0.088增大到0.195,增大约2.2倍;第25 d到第30 d时,体积由0.195迅速增至0.512,增大约2.6倍。而各个分区内的平均血管密度则分别由0.0637、0.0598、0.0657下降了至0.0130、0.0038、0.0074,下降了至少约5倍以上,体积增长的速度远远大于血管新生的速度,使得血管密度在25 d到30 d的时候迅速下降。这可能与4T1细胞株的高度恶性有关,其生长后期肿瘤细胞繁殖过快与血管新生速度不匹配,导致营养供给跟不上,造成肿瘤内大量坏死和转移。从实际解剖结果也可以看到,不同时间点肿瘤的肺转移,符合该类恶性肿瘤的基本特征。
尽管FD变化趋势与MVD一致,但是FD的统计方差却远远小于MVD的。这不仅证明肿瘤血管并非预想中的单纯由外向内的渗透性生长,或者即使是渗透型生长模式,那在不同区域其生长的速度也必然受到局部微环境的影响而会有所不同,个体差异显著。另外,还证明分形与血管密度间的关系,不仅仅是单纯意义上的百分比,更重要分形描述的是不同尺度下密度分布的相似性。这一特性使FD更适用于对于肿瘤血管的大面积筛查,而不必认为应选血管密集区域(如hot-spot[6]),进行定量,降低了人为因素的干扰,大大提高了定量结果的客观性。
本研究以同步辐射CT成像为基础,得到微米级的肿瘤内部微血管网络,采用自主设计的分块加载双阈值分割方法进行定量前的准备,通过观察不同时间的肿瘤体积和不同分区的血管密度和分形维度的变化趋势,初步分析肿瘤随时间变化的生长过程。实验证明了分形分析对于研究肿瘤血管的潜力,也说明了对于复杂的肿瘤血管定量,不能靠单一指标进行描述,而需要多个指标进行综合评定。这样才能更加全面解读肿瘤新生血管对于肿瘤生长的重要意义。
[1]Ingrid Schreer,Jutta Lüttges.Breast cancer: Early detection[M].2005,Part 7: 767-784.
[2]Folkman J.Tumor angiogenesis: therapeutic implications[J].N.Engl.J.Med,1971,285(21): 1182-1186.
[3]Folkman J.Anti–angiogenesis: new concept for therapy of solid tumors[J].Ann Surg,1972,175: 409–416.
[4]Michael A.Gimbrone,Jr,Leapman SB,Cotran RS,et al.Tumor dormancy in vivo by prevention of neovascularization[J].J.Exp.Med.1972,136(2): 261-276.
[5]Folkman,J.Angiogenesis[J].Annu.Rev.Med,2006,57: 1-18.
[6]Weidner N,Semple JP,Welch WR,Folkman J.Tumor angiogenesis and metastasis-Correlation in invasive breast carcinoma[J].N Engl J Med,1991,324(1): 1-8.
[7]Fernandez A,Udagawa T,Schwesinger C,et al.Angiogenic potential of prostate carcinoma cells overexpressing Bcl-2[J].J.Natl.Cancer Inst,2001,93(3): 208-13.
[8]Bruce R.Zetter.Angiogenesis and tumor metastasis[J].Annu.Rev.Med,1998,49: 407-24.
[9]Bermard Uzzan,Patrick Nicolas,Michel Cucherat,et al.Microvessel density as a prognostic factor in women with breast cancer: a systematic review of the literature and meta-analysis[J].Cancer Research,2004,64:2941-2955.
[10]Elizabeth Bullitt,Matthew G.Ewend,Stephen Aylward,et al.Abnormal vessel tortuosity as a marker of treatment response of malignant gliomas: preliminary report[J].Technol Cancer Res Treat,2004,3(6): 577-584.
[11]Elizabeth Bullitt,Donglin Zeng,Guido Gerig,et al.Vesseltortuosity and brain tumor malignancy: A blinded study[J].Acad Radiol.2005,12:1232-1240.
[12]Joanne R.Less,Thomas C.Skalak,Eva M.Sevick,et al.Microvascular Architecture in a mammary carcinoma: branching patterns and vessel dimensions[J].Cancer Res,1991,51:265-273.
[13]Y.Gazit,JW.Baish,N.Safabakhsh,et al.Jain.Fractal characteristics of tumor vascular architecture during tumor growth and regression[J].Microcirculation,1997,4(4): 395-402.
[14]R.Lopes,N.Betrounil.Fractal and multifractal analysis: A review[J].Medical Image Analysis,2009,13(4):634-649.
[15]Takafumi Sekka,Svetlana A Volchikhina,Akira Tanaka,et al.Visualization,quantification and therapeutic evaluation of angiogenic vessels in cancer by synchrotron microangiography[J].J.Synchrotron Rad,2000,7(6): 361-367.
[16]Donald M Mcdonald,Peter L Choyke.Imaging of angiogenesis:from microscope to clinic[J].Nature Medicine,2003,9(6): 713-725.
[17]Daryl O.Schwenke,James T.Pearson,Keiji Umetani,et al.Imaging of the pulmonary circulation in the closed-chest rat using synchrotron radiation microangiography[J].J Appl Physiol,2007,102:787-793.
[18]Hiroto Iwasaki,Kazuhito Fukushima,Atsuhiko Kawamoto,et al.Synchrotron radiation coronary microangiography for morphometric and physiological evaluation of myocardial neovascularization induced by endothelial progenitor cell transplantation[J].Arterioscler Thromb Vasc Biol,2007,27(6):1326-1333.
[19]Takenori Yamashita.Evaluation of the microangioarchitecture of tumors by use of monochromatic X-Rays[J].Investigative Radiology,2001,36(12): 713-720.
[20]Umetani K.et al.Small-field angiographic imaging of tumor blood vessels in rabbit auricle using x-ray saticon camera and synchrotron radiation[A].Engineering in Medicine and Biology Society,2003.Proceedings of the 25th Annual International Conference of the IEEE[C].2003: 978-981.
[21]Weidner N.Intratumor microvessel density as a prognostic factor in cancer[J].American Journal of Pathology,1995,147(1): 9-19.
[22]SB Fox,GDH Turner,RD Leek,et al.The prognostic value of quantitative angiogenesis in breast cancer and role of adhesion molecule expression in tumor endothelium[J].Breast Cancer Research and Treatment,1995,36(2): 219-226.
[23]Lynn Hlatky,Philip Hahnfeldt,Judah Folkman.Clinical application of antiangiogenic therapy: microvessel density,What It does and doesn’t tell us[J].Journal of the National Cancer Institute,2002,94(12): 883-893.
[24]Peter Carmeliet,Rakesh K.Jain.Angiogenesis in cancer and other diseases[J].Nature,2000,407(6801): 249-257.
[25]James W.Baish,Rakesh K.Jain.Fractals and Cancer[J].Cancer Research,2000,60:3683-3688.
[26]Dietmar W.Siemann,Emma Mercer,Sharon Lepler,et al.Vascular targeting agents enhance chemotherapeutic agent activities in solid tumor therapy[J].International Journal of Cancer,2002,99(1): 1-6.
[27]Gabriel Helmlinger,Axel Sckell,Marc Dellian,et al.Acid production in glycolysis-impaired tumors provides new insight into tumor metabolism[J].Clin Cancer Res,2002,8:1284-1291.
[28]Martin A.Mainster.The fractal properties of retinal vessels:embryological and clinical implications[J].Eye,1990,4:235-241.
[29]Arpenik Avakian,Robert E.Kalina,E.Helene Sage et al.Fractal analysis of region-based vascular change in the normal and nonproliferative diabetic retina[J].Current Eye Research,2002,24(4):274-280.
[30]L.Risser,Franck Plouraboue,Alexandre Steyer,Peter Cloetens,From homogeneous to fractal normal and tumorous microvascular networks in the brain[J].Journal of Cerebral Blood Flow &Metabolism,2007,27: 293-303.
[31]AF.Frangi,WJ.Niessen,KL.Vincken,et al.Multiscale vessel enhancement filtering[J].Lecture Notes in Computer Science,1998,1496: 130-137.
