单卵双胞胎银屑病患者外周血T细胞存在差异表达基因
2012-12-04刘淑梅李俊琴张开明董峰
刘淑梅 ,李俊琴 ,张开明 ,董峰
(1.山西医科大学第二医院,太原030001;2.太原市中心医院,太原030009;3.山西省长治市第二人民医院,长治046000)
研究显示,尽管银屑病是以表皮过度增殖为特征的慢性增殖性疾病,而T细胞的浸润才是促发表皮过度增殖的始动因素,T细胞是促发银屑病患者细胞及分子网络链式反应并最终导致皮损形成的关键[1-2]。基于T细胞对银屑病发生及发展过程中的重要作用,对于银屑病患者中的T细胞在基因表达层面上的研究就显得尤为必要和关键。但是目前对T细胞的研究大多集中在其细胞活性和分泌的细胞因子,对T细胞差异表达基因的研究尚未见详细的报道。基于高通量RNA测序技术的检测方法可以同时对百万个反转录的DNA分子进行测序[3]。与基因芯片技术提供相对表达量不同,基于测序的检测方法可以提供基因绝对表达值,并且可以避免基因芯片的一些固有缺陷[4-5]。因此我们采用Illumina Genome Analyzer技术对单卵双胞胎银屑病患者外周血T细胞差异表达基因进行分析,对筛选出的差异表达基因进行功能显著性富集分析(GO分析)。
1 材料与方法
1.1 标本 同患银屑病的男性单卵双胞胎(P1、P2)34岁,一个患病一个不患病的女性单卵双胞胎(P3、N1)14 岁,程度指数(PASI)评分分别为:P1 13.6、P2 14.1、P3 10.8,均无自身免疫及免疫缺陷性疾病,银屑病患者为寻常性进行期,且3个月内未使用免疫抑制剂及糖皮质激素。并收集男性对照组正常人(N2)41岁和男性特应性皮炎患者(atopic dermatitis,AD)40岁各1例,所有样本取材前均签署知情同意书。
1.2 方法
1.2.1 外周血T细胞培养扩增 抽取以上所有标本外周血10 mL,密度梯度离心法分离外周血单个核细胞(peripheral blood mononuclear cell,PBMC),重悬于RPMI-1640培养基(含5 μg/mL CD3抗体及1 mmol/L L-谷氨酸等),接种于T75细胞培养瓶。于培养第 4、5、7、9、10、12、15 天分别进行补液,培养第17d时收集细胞。抽取2×106~3×106细胞进行流式细胞检测,鉴定T细胞纯度。
1.2.2 RNA提取 Trizol法提取细胞总RNA后,DNA酶进行处理,然后用Agilent 2100 Bio分析仪对RNA纯度进行分析。利用Oligo(dT)磁珠吸附纯化 mRNA[6],并以 Oligo(dT)引导反转录合成双链cDNA。
1.2.3 制备Taq并测序 取cDNA,使用NlaIII、MmeI酶处理和磁珠沉淀纯化,从而获得两端连有不同接头序列的21 bp标签(具体步骤及原理见该网址:www.genomics.cn)。然后采用边合成边测序法测序,获得原始测序数据。去除3′adaptor序列、空载reads、低质量 Tag[Tag中含有未知碱基(N)]、长度过小过大的Tag(取长度为21 nt的Tag)、拷贝数为1的Tag,最终获得Clean Tag。
1.2.4 基因表达注释 首先,根据参考基因数据库(ftp://ftp.ncbi.nih.gov/refseq/H_sapiens/mRNA_Prot/human.rna.fna.gz),利用软件检索mRNA上所有的CATG位点,生成CATG+17 nt碱基的参考标签数据库。然后将全部Clean Tag与参考标签数据库比对,对其中唯一比对到一个基因的标签进行基因注释,统计每个基因对应的原始Clean Tag数,然后对原始Clean Tag数做标准化处理,获得标准化的基因表达量。标准化方法为:每个基因包含的原始Clean Tag数/该样本中总Clean Tags数×1 000 000。
1.2.5 差异表达基因的筛选及分析 参照数字化基因表达谱差异基因检测方法[5,10],筛选两样本间的差异表达基因。差异表达基因定义为FDR≤0.001且倍数差异在2倍及以上的基因。
1.2.6 Gene Ontology功能显著性富集分析 首先把所有差异表达基因向Gene Ontology数据库(http://www.geneontology.org/)的各term映射,计算每个term的基因数目,然后应用超几何检验,找出与整个基因组背景相比,在差异表达基因中显著富集的GO条目。
2 结果
2.1 T细胞经培养扩增后纯度鉴定 T细胞培养扩增以后,抽取2×106~3×106细胞与异硫氰酸荧光素(fluorescein isothiocyanate,FITC)标记的鼠抗人CD3+单抗结合,流式细胞检测,鉴定T细胞纯度达96.47%。
2.2 Tag质量评估及比对情况 单卵双胞胎银屑病、正常对照等各例外周血扩增T细胞逆转录形成cDNA,用 NlaIII处理,并在 5′末端和 3′末端连接两个Illumina接头,形成21 bp的Tag(见材料与方法)。在各例样本中,分别获得大约350~370万个Tag,共9~14万种。经过去除杂质处理后,筛选出了340~360万个Clean Tag(>93%),这些在数量上占多数的Tag,在种类上则未呈现出明显优势,约占Tag总种类的30%~50%,其中拷贝数>100的Tag种类约占Clean Tag的3.31%~5.18%。随后将获得的Clean Tag比对到人类参考基因数据库,其中约47.65%~51.71%Clean Tag唯一比对到一个基因(包括正义转录和反义转录),约18.52%~24.21%Tag比对到一个基因位置,见表1。
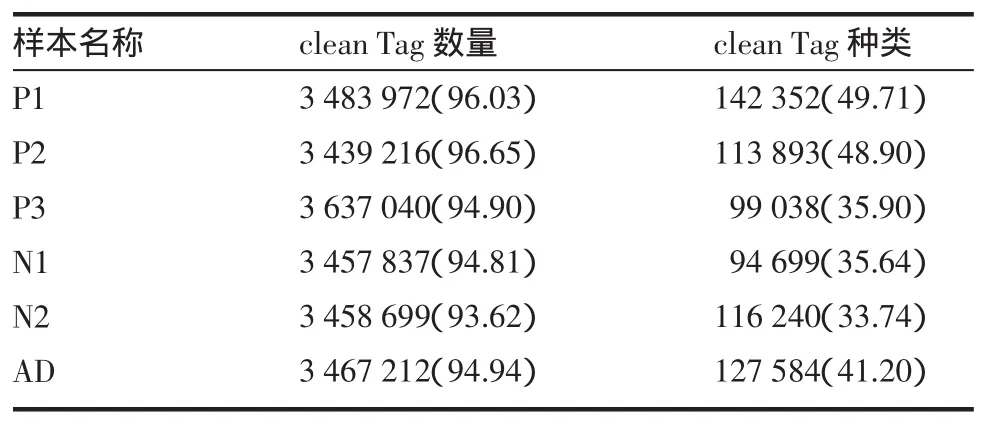
表1 Tag质量评估及比对情况 (%)
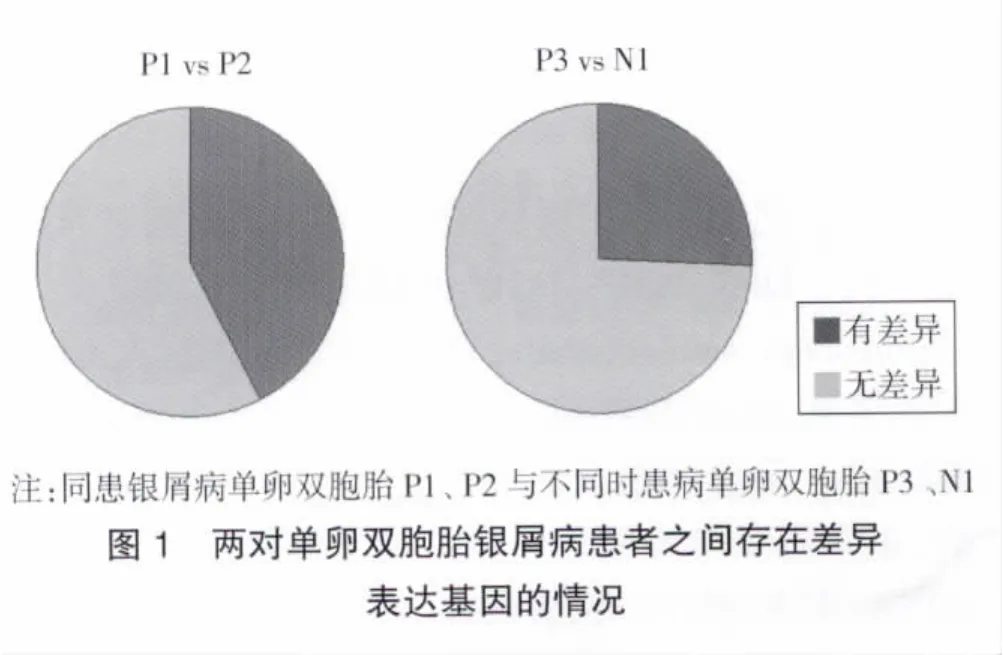
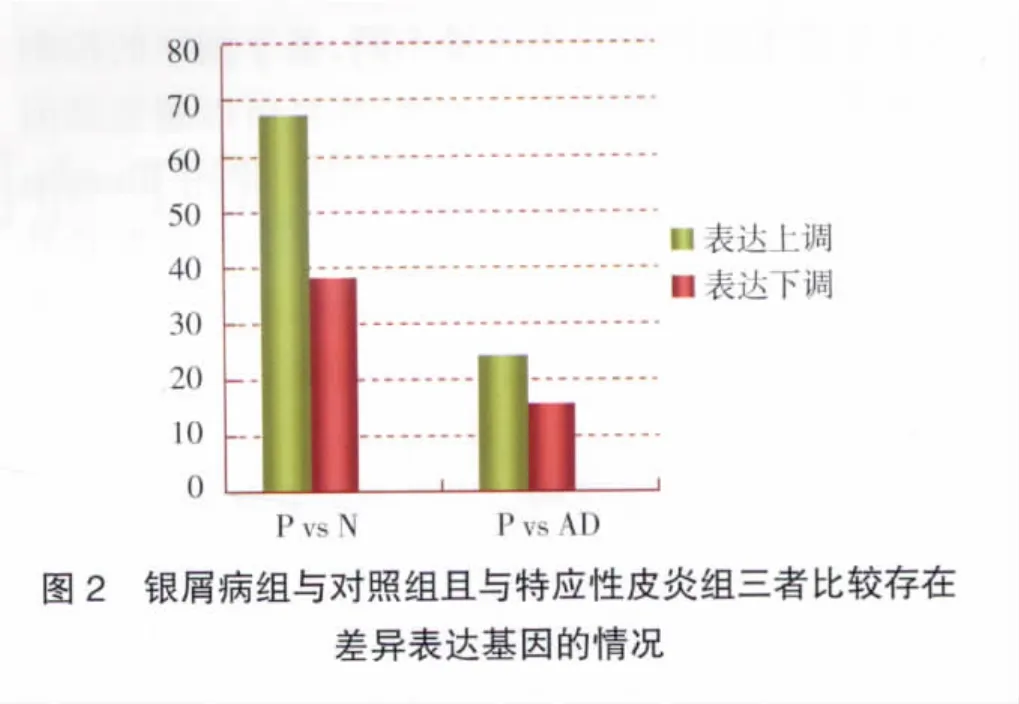
2.3 差异表达基因比较分析 对基因表达量进行假设检验,并筛选FDR≤0.001且倍数差异在2倍及以上的基因。经过分析,共注释到9 449个基因,为寻找银屑病关键性的差异表达基因,先在两对单卵双胞胎银屑病患者之间筛选差异基因,P1与P2相比较在表达上无差异的基因有5 438个,P3与N1相比较在表达上存在差异的基因有2 432个,见图1;为了排除炎症性反应对基因表达的影响,再筛选银屑病组与对照组相比较在表达上存在差异的基因有139个,其中105个基因在P1与P2相比较中表达无差异,表达上调的基因有67个,表达下调的基因有38个;最后银屑病组与对照组且与特应性皮炎组三者同时比较在表达上存在差异的基因有40个,表达上调的基因有24个,表达下调的基因有16个,见图2。
2.4 差异表达基因注释 见表2。
3 讨论
银屑病是一种与自身免疫密切相关的慢性炎症性皮肤病,组织病理学特征表现为角质形成细胞过度增殖及以T细胞为主的炎细胞浸润。皮损处表皮过度增殖与自身反应性T细胞所发挥的特殊免疫效应密切相关,表明T细胞介导的免疫异常在银屑病发病和维持中具有重要的作用。文中采用RNA测序技术对银屑病患者外周血T细胞差异表达基因进行分析,进一步了解银屑病的发病机制。
遗传流行病学分析表明,银屑病是一种受环境因素影响的多因子遗传疾病。国内外大量学者对银屑病易感基因进行了研究,先后发现了LCE、ZNF816A等近20种易感基因。但是单卵双胞胎在银屑病患病上的不一致性,提示基因水平的异常并不是银屑病发病的唯一因素,表观异常可能在银屑病发病中具有更为重要的作用。鉴于以上因素,本实验对患病一致和不一致的两对单卵双胞胎mRNA表达进行了研究,旨在排除易感基因及环境因素影响后从mRNA水平发现与银屑病发病相关的基因。

表2 差异表达基因注释表
趋化因子通过其相应受体对多种细胞如淋巴细胞、树突状细胞等的趋化作用,在多种疾病的免疫反应和炎症损伤中发挥着重要作用。研究显示银屑病患者异常表达趋化因子受体7(CCR7),且主要是由CD4+T细胞表达,表明CCR7是决定银屑病T细胞趋化作用的主要分子之一[7]。且有研究显示长期存在于体内的CCR7记忆性T细胞具有直接免疫活性,和银屑病炎症维持可能有密切关系[8-9]。银屑病患者高表达的IL-18可以上调CCR7的表达,通过激活CCR7上游启动区域的活性增强CCR7基因的表达。本研究结果显示银屑病患者CCR7表达水平均高于对照组,此结果与既往文献报道基本一致,进一步支持银屑病是Th1型T细胞介导的慢性炎症性疾病,趋化因子及其受体可能是治疗T细胞介导的炎症性疾病很有希望的靶点,因为封闭这些受体可以抑制效应细胞到大炎症部位,从而达到治疗目的。因此,CCR7参与了银屑病发病与维持的复杂细胞因子网络,且具有举足轻重的作用。
银屑病皮损出现一系列细胞生长紊乱的细胞生物学现象,不仅与T细胞分泌细胞因子有关,而且与表皮细胞的凋亡和终末分化过程的异常密切相关[10]。程序化细胞死亡分子5又称促死亡因子5(PDCD5),是一种凋亡促进剂,有效促进细胞凋亡和抑制细胞生长。有研究显示银屑病患者局部皮损表皮过度增殖与PDCD5表达下调有关,与表皮细胞的凋亡及终末分化过程的调节异常密切相关,即其凋亡促进作用减弱,其结果是表皮细胞的过度增殖,IFN-γ上调其表达,EPO促红细胞生成素使其表达下调[11]。但本研究显示PDCD6表达上调,与既往文献报道相反,确切机制有待进一步研究。
细胞周期失控是细胞增殖过度及癌变的重要原因,参与细胞周期调控的主要因子有细胞周期蛋白、细胞周期蛋白依赖性激酶和细胞周期蛋白依赖性激酶抑制蛋白(cyclin-dependent kinase,CDK)。P27kip1是一种广谱细胞周期蛋白依赖性激酶抑制剂,通过抑制细胞周期蛋白及其激酶活性对细胞周期进行负调节,从而抑制细胞的增殖,且与细胞凋亡存在相关性,可促进细胞凋亡[12-13]。细胞周期蛋白D1(cyclin D1)是调节细胞进入细胞周期增殖期的主要因子,其过度表达可导致细胞周期调控异常。有研究显示,cyclin D1在寻常性银屑病皮损中的表达明显增高[14-16],这一结果支持cyclin D1参与了银屑病的角质形成细胞过度增殖的过程。随着银屑病皮损中p27kip1表达的下降,cyclin D1的表达却显著增高,两者呈负相关,提示cyclin D1和p27kip1在银屑病的发生、发展中起着相互调节和抑制的作用。可能是当p27kip1表达下降时,与cyclin D1-CDK结合减少,对CDK活性的抑制减弱,从而使Rb磷酸化,与Rb结合的转录因子E2F游离,发挥其启动转录的活性,促使角质形成细胞增殖。本研究发现CDK2B表达下调,cyclin A2表达上调,这两者与上述cyclin D1和p27kip1的表达情况有相同之处:表达呈负相关。
[1]张开明,李新华,刘玉峰.体外研究银屑病患者T细胞对表皮通过时间的影响[J].中国皮肤性病学杂志,2004,18(5):276-278.
[2]Li X,Fan X,Zhang K,et al.Influence of psoriatic peripheral blood CD4+T and CD8+T lymphocytes on C-myc,Bcl-xL and Ki67 gene expression in keratinocytes[J].Eur J Dermatol,2007,17:392-396.
[3]Wang Z,Gerstein M,Snyder M.RNA-Seq:a revolutionary tool for transcriptomics[J].Nat RevGenet,2009,10:57-63.
[4]IrizarryRA,WarrenD,SpencerF,etal.Multiple-laboratorycomparison ofmicroarrayplatforms[J].Nat Methods,2005,2:345-350.
[5]Pedotti P T,’t Hoen PA,Vreugdenhil E,et al.Can subtle changes in gene expression be consistently detected with different microarray platforms?[J].BMCGenomics,2008,9:124.
[6]倪娜,李晚忱.上样量和洗脱液温度影响磁珠法纯化mRNA效果[J].分子植物育种,2005,3(2):33-35.
[7]樊昕,王刚,刘玉峰.寻常银屑病患者趋化因子受体7表达及其意义探讨[J].中华皮肤性病学杂志,2006,20(12):724-741.
[8]Pietrzak A,Lecewicz-Torun B,Chodorowska G,et al.Interleukin-18 levels in the plasma of psoriatic patients correlate with the extent of skin lesions and the PASI score[J].Acta Derm Venereol,2003,83:262-265.
[9]Companjen A,van der Wel L,van der Fits L,et al.Elevated interleukin-18 protein expression in early active and proressive plaque-typepsoriaticlesions[J].EurCytokineNetw,2004,15:210-216.
[10]T akahashi H,Manabe A,Ishida-Yamamoto A,et al.Aberrant expression of apoptosis-related molecules in psoriatic epidermis[J].J Dermatol Sci,2002,28:187-197.
[11]何焱玲,齐焕英,朱铁君,等.银屑病患者皮损表皮细胞促凋亡分子 PDCD5 表达的研究[J].中华皮肤科杂志,2004,37(4):514-516.
[12]Polyak K,KatoJY,Solomon MJ,et al.p27Kip1,a cyclin-cd inhibitor,links transforming growth factor-beta and contact inhibition to cell cyclearrest[J].GenesDev,1994,8:9-22.
[13]MasciulloV,SgambatoA,PacilioC,et al.Frequent loss of expression of the cyclin-dependent kinase inhibitor p27 in epithelial ovarian cancer[J].Cancer Res,1999,59:3790-3794.
[14]李政霄,彭振辉,王珂.上皮钙粘着素、B-连环蛋白、细胞周期蛋白D1在进行期寻常型银屑病皮损的表达[J].南方医科大学学报,2008,28(4):545-547.
[15]秦俊霞,张方正,史维平.p27kip1和cyclin D1在寻常型银屑病中的表达[J].中国现代医生,2009,47(14):14.
[16]秦艳茹,李江文,丁一,等.银屑病患者皮损中诱生型一氧化氮合酶mRNA,热休克蛋白70和细胞周期蛋白D1的表达[J].中华皮肤科杂志,2001,34(2):129-130.
