克鲁维酵母菊粉酶的酶学特性研究
2012-12-03孔令坚石勇陈雄
孔令坚,石勇,陈雄
(湖北工业大学生物工程学院,发酵工程省部共建教育部重点实验室,湖北 武汉 430068)
菊粉是由多个果糖分子通过β-2,1-果糖糖苷键连接而成的多聚果糖,末段有一个葡萄糖残基以α-1,2糖苷键与之相连,呈直链结构。菊粉广泛存在于一些菊科植物中,如菊芋、菊苣、大丽花等。其中菊芋是一个廉价的糖源,在我国大部分地区都有种植,亩产可达3000 kg~5000 kg,通常被作为食用或饲用原料,未获取其真正的价值,故急待开发利用[1-3]。
菊粉酶(inulinase,EC3.2.1.7)是一种主要来源于微生物的多糖水解酶,可分为内切型、外切型两种,其中内切型菊粉酶可水解菊粉β-2,1-果糖糖苷键生产高纯度的低聚果糖(fructooligosaccharides,FOS),外切型菊粉酶可水解菊粉生产超高果糖浆(Ultra High Fructose Glucose Syrups,UHFGS)[4-5]。
本实验室(湖北工业大学生物工程学院,发酵工程省部共建教育部重点实验室)分离了一株克鲁维酵母S120[6],可产菊粉酶,本文探讨了该克鲁维酵母菊粉酶的酶学特性。
1 材料和方法
1.1 菌株
克鲁维酵母(Kluyveromyces)S120:由本实验室(湖北工业大学生物工程学院,发酵工程省部共建教育部重点实验室)筛选得到。
1.2 培养基
1.2.1 斜面培养基
葡萄糖20.0 g,酵母膏10.0 g,蛋白胨10.0 g,琼脂20.0 g,蒸馏水定容到1000 mL,pH自然。
1.2.2 种子培养基
酵母膏10.0 g,蛋白胨20.0 g,菊芋粉10.0 g,蒸馏水定容到1000 mL,pH 6.0。
1.2.3 固体发酵培养基
在300 mL三角瓶中加入18 g麸皮,2 g菊芋粉,另加入30 mL营养盐液(0.4%NH4SO4,3%KH2PO4,0.5%MgSO4·7H2O,0.0003%MnSO4·H2O,0.0008%FeSO4·6H2O,0.00025%ZnSO4·7H2O,0.00035%CaCl2),初始 pH5.7。
1.3 方法
1.3.1 接种和培养条件
挑取斜面活化菌种Kluyveromyces S120接入装有20 mL新鲜种子培养液的250 mL三角瓶中,30℃下150 r/min培养24 h,按4%接种量接种种子培养液,混合均匀,34℃下培养72 h,间时拍打,使其均匀生长。
1.3.2 酶液的制备与纯化
发酵结束后,在固体培养物加入1∶10(以干重计)的蒸馏水,于室温下(25±2)℃搅拌1 h,过滤,重复提取两次,合并滤液,滤液作为粗酶液。将粗酶液用50%~60%硫酸铵分级盐析、阳离子树脂交换纯化得到菊粉酶产品。
1.3.3 菊粉酶的测定
向试管中吸取一定稀释度的粗酶液1.0 mL,加0.1 mol/L醋酸盐缓冲液(pH 5.0)配制的2%菊粉液4 mL,混匀,于60℃保温30 min后置于沸水中10 min使酶失活,然后冷却到室温,产生的还原糖用3,5-二硝基水杨酸法(DNS法)测定。每个试验平行3次,试验结果取3次的平均值。菊粉酶(I)活力单位规定为:在上述条件下,每分钟产生1 μmol果糖所需的酶量为一个菊粉酶单位(U)。
1.3.4 蔗糖酶的测定
吸取一定稀释度的粗酶液1.0 mL,加0.1 mol/L醋酸盐缓冲液(pH 5.0)配制的2%蔗糖溶液4 mL,混合均匀,37℃反应30 min。用DNS法测定反应液中还原糖的量。以煮沸酶液作对照,每个试验平行3次,试验结果取3次的平均值。蔗糖酶(S)活力单位规定为:在上述条件下,每分钟水解1 μmol的蔗糖量。
1.3.5 菊粉酶酶学特性
1.3.5.1 菊粉酶的最适pH及酸碱稳定性
分别以pH 4.5~9.0的缓冲液配制底物和稀释酶液,测定酶活力,以酶活最高者为100%。将酶分别在pH 4.0~9.0的缓冲液中30℃放置1 h后,测定其残余酶活力,以未保温酶液的酶活力为100%。
1.3.5.2 菊粉酶的最适温度及热稳定性
在不同温度下测定酶活力,以酶活最高者为100%。在pH5.5条件下,将酶在30℃~60℃范围内保温1h后,测定其残余酶活力,以未保温酶液的酶活力为100%。
1.3.5.3 动力学常数测定
酶与底物在pH 5.5、50℃反应5 min,测定反应产物中还原糖的增加量,以单位时间内产物中还原糖的增加量作为酶反应的初速度,用Lineweaver-Burk双倒数作图。
1.3.5.4 金属离子对酶活力的影响
将酶液对重蒸馏水透析过夜,添加不同金属离子,测定其酶活力。以不加金属离子的酶活力为100%。
2 结果与讨论
2.1 内、外切型菊粉酶的确定
[7],对于具有内切型、外切型菊粉酶活性的粗酶液,通常测其对2%菊粉溶液的活性(I)和2%蔗糖溶液的活性(S),计算出I/S值,一般认为当I/S大于10时,表现为内切酶活性。I/S小于10时,表现为外切酶活性。本试验首先确定Kluyveromyces S120的I/S值为13.5,I/S值大于10,为内切菊粉酶菌株。内切菊粉酶可水解菊粉产生低聚果糖。
2.2 酶学特性研究
2.2.1 pH对酶活力的影响
在pH 4.5~9.0条件下,通过多次平行试验,测定相对酶活力,所得结果见图1,将酶分别在pH 4.0~9.0的缓冲液中30℃放置1 h后,通过多次平行试验,测定其残余酶活力,结果见图2。
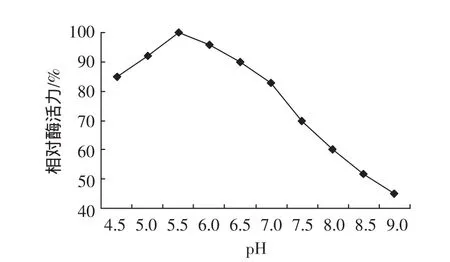
图1 pH对酶活力的影响Fig.1 Effect of pH on enzyme activity

图2 pH对酶稳定性的影响Fig.2 Effect of pH on enzyme stability
从图1中可知酶的最适pH5.5。低于或高于pH5.5,酶活都有所下降。在pH5.0~pH6.0之间,相对酶活力达90%以上;pH大于7,相对酶活力急剧下降,pH9.0后相对酶活力很低。从图2中可知该酶在pH 4.5~7.0范围内稳定,残留酶活达90%以上。pH影响酶活的原因有:过碱会影响酶蛋白的结构,甚至使酶变性失活;pH也可能影响酶分子中一些基团的解离,从而影响酶的活性。
2.2.2 温度对酶活力的影响
在pH 5.5条件下,30℃~60℃范围内通过多次平行试验,测定相对酶活力,结果见图3。将酶分别在30℃~60℃放置1 h后,通过多次平行试验,测定其残余酶活力,结果见图4。
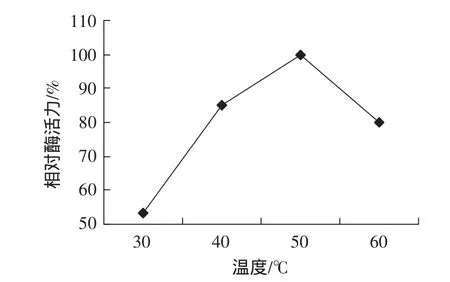
图3 温度对酶活力的影响Fig.3 Effect of temperature on enzyme activity

图4 温度对酶稳定性的影响Fig.4 Effect of temperature on enzyme stability
如图3所示,在温度为50℃时,酶活力最高。如图4所示,在50℃~60℃间能维持80%以上的酶活力。温度对酶促反应的影响有两方面:一方面是当温度升高时反应速度会加快;另一方面是随着温度的升高,酶逐渐变性。酶的最适温度是这两种过程的平衡效果,在低于最适温度时,前一种效应为主,因而酶的活性增加;在高于最适温度时,后一种效应为主,因而酶的活性迅速降低。
2.2.3 金属离子对酶活力影响
将酶液对重蒸馏水透析过夜,通过添加不同金属离子,测定其酶活力。不同金属离子对产酶的影响见图5。
由图5可知,锰离子、镁离子、钙离子对菊粉酶的激活作用最显著,而锌离子,铜离子,亚铁离子有抑制作用。
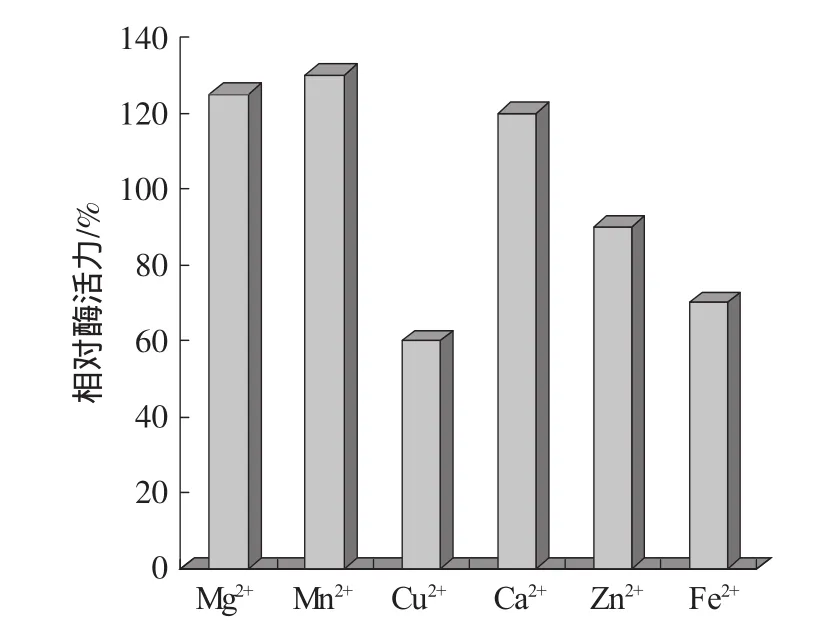
图5 金属离子对酶活力影响Fig.5 Effect of metal ion on enzyme activity
2.2.4 米氏常数与最大反应速度
菊粉酶经过初步纯化后,在5 min时间内,酶量一定及酶促反应最适条件下,改变底物浓度(s),测产物浓度(p),初速度设定为 ΔP/t。按 Lineweaver-Burk作图法以1/V对1/S作图,如图 6,得到 1/V=0.6763(1/S)+0.0636,根据直线在横轴上的截距(-1/Km)求出米氏常数Km为10.63 mg/mL,最大反应速度为15.72 mg/(mL·s)。

图6 底物浓度与反应速度的关系Fig.6 Relation of substrate concentration and reaction velocity
3 结论
克鲁维酵母S120菊粉酶为内切菊粉酶。其最适pH5.5,最适温度50℃,锰离子、镁离子、钙离子对菊粉酶的激活作用最显著,而锌离子,铜离子,亚铁离子有抑制作用。在试验条件下,米氏常数Km为10.63 mg/mL,最大反应速度为15.72 mg/(mL·s)。
参考文献:
[1]张连富,李红.内切菊粉酶法生产低聚果糖研究进展[J].中国食品添加剂,2000(1):20-25
[2]Kulminskaya A A,Arand M,Eneyskaya E V.Biochemical characterization of aspergillus awamori exoinulinase:substrate binding characteristics and regioselectivity of hydrolysis[J].Biochimica and biophysica acta,2003,1650(1):22-29
[3]Vandamme E F,Derycke D G.Microbial inulinases:fermentation process,properties and applications[J].Adv Appl Microbiol,1993,29:139-176
[4]Gennaro S D,Birch G G,Parke S A.Studies on the physiochemical properties of inulin and inulin oligomers[J].Food chemistry,2000,68:179-183
[5]Manzonl M,Cavazzoni V.Hydrolysis of Topinambur(Jerusalem artichoke)fructans by extracellular inulinase of Kluyveromyes marxianus Var.bulgaricus[J].J Chem Technol Biotechnol,1992,54:311-315
[6]陈雄.内切型菊粉酶高活力菌株的筛选[J].湖北农业科学,2003(3):93-94
[7]Arhari R.Purification and characterization of endo-and exo-inulinase[J].Biotechnol Biochem,1999,11:105-107
