β-葡萄糖苷酶高产菌株筛选、诱变及其发酵的研究
2012-12-03潘艳张益波郭志敏王诗雨邢慧萌林风滕利荣侯阿澧
潘艳,张益波,郭志敏,王诗雨,邢慧萌,林风,滕利荣,侯阿澧
(吉林大学生命科学学院,吉林 长春 130012)
β-葡萄糖苷酶(EC 3.2.1.21;β-D-Glucosidase)也叫纤维二糖酶,在不同生物中由多种同源酶组成,作用是从非还原性末端催化水解β-葡萄糖苷键释放β-D-葡萄糖。β-葡萄糖苷酶在不同的生物体内和生物技术应用中都有重要的作用,这包括对生物质的降解[1];利用纤维秸秆类生产乙醇[2];作为一种重要风味酶,它能作用于茶叶、葡萄酒以及果汁中的风味前体物质,释放出风味成分,起到增香作用[3];也是合成重要的糖配体[4]等。在纤维素酶的糖化过程中,纤维二糖对内切纤维素酶和外切纤维素酶有很强的抑制作用,添加过量β-葡萄糖苷酶可以减缓这种竞争性抑制作用。
本文从玉米秸秆天然腐烂的腐土中筛选得到了一株能生产高效胞外β-葡萄糖苷酶的菌株。对此菌株进行紫外、化学、以及化学和紫外的复合诱变[5],得到的UV-4-DES6具有生长速度快,利用工农业废料产酶高的特性,可能是解决β-葡萄糖苷酶工业化发酵生产的优良菌株。
1 材料和方法
1.1 材料
1.1.1 试剂
所有用到的化学药品均购买于上海生工生物工程公司,秸秆的腐土采集于常年堆积的秸秆堆下方。
1.1.2 工农业废料
工农业废渣即麦麸(WB)、气爆玉米秸秆(TCS)、未处理的玉米秸秆(UTCS)、酒糟(DDG)、玉米浆(CSL)、豆粉(SM)或豆饼粉(BCP)都在当地获得,将这些原料烘干并进一步粉碎,过0.355 mm(45目)筛备用。
1.1.3 仪器设备
SKP-01电热恒温培养箱、SKPC-01电热恒温鼓风干燥箱:湖北省黄石市医疗器械厂;VS-1300-U超净工作台:苏净集团安泰公司;752紫外可见分光光度计:上海光谱仪器有限公司;MDF-492超低温电冰箱:日本三洋公司;可调式微量取液器:德国Eppendorf公司等。
1.1.4 培养基
纤维二糖诱导培养基:每升中含有酵母2.5 g,纤维二糖 2.5 g,蛋白胨 2.5 g,(NH4)2SO4,1 g;KH2PO4,0.5 g和MgSO40.2 g。
筛选培养基:在诱导培养基中加入七叶苷水合物1 g;琼脂粉20 g;灭菌后加入滤菌后的柠檬酸铁铵溶液至三价铁终浓度为0.3%[6]。
PDA培养基:用于菌种培养和活化等,加200g土豆的煮出滤汁,葡萄糖20g,加20g琼脂,补水至1000mL。
产酶培养基:秸秆粉20 g/L,蛋白胨5 g/L,Mandels营养盐[7][常量元素液(10×),含有(NH4)2SO43.5 g/L,KH2PO42 g/L,(H2N)2CO 0.3g/L,MgSO4·7H2O 0.3 g/L,CaCl20.3 g/L;微量元素溶液(1000×)含有 FeSO4·7H2O 5 g/L,MnSO4·H2O 1.6 g/L,ZnSO4·7H2O 1.4 g/L,CoCl22 g/L]。121℃下高压蒸汽灭菌30 min备用。
1.2 实验方法
1.2.1 菌株筛选
筛选方案[8]如下:准确称取腐土样本0.1 g加入已消毒的玻璃珠,用100 mL无菌水溶解,摇床振摇制备样品悬液,然后加入到纤维二糖诱导培养基,30℃、150 r/min条件下摇床培养5 d。整体离心并做梯度稀释,取102倍~107倍体积稀释液涂布到筛选培养基平板,观察并挑选出几个周围带有较大黑圈且黑圈与菌落直径比值较大的菌落,每株菌单独接种于纤维二糖诱导培养基,30℃摇床人工培养3d后12000r/min、4℃离心10 min,取上清测定β-葡萄糖苷酶活性,选取酶活力高的菌株保存。
1.2.2 诱变过程
筛选得到的菌株→制备孢子悬液→UV诱变→涂布筛选平板初筛→保存菌株→DES诱变→涂布筛选平板初筛→产酶复筛→获得高产菌株→PDA斜面保存。
1.2.3 菌种诱变
1.2.3.1 制备孢子悬液
取培养3 d菌的PDA斜面4支~5支,用无菌生理盐水将孢子洗下,并装入盛有玻璃珠的小三角烧瓶中,充分振摇30 min;将上述菌液离心(3000 r/min,离心15 min),弃去上清液,将菌体用无菌生理盐水洗涤2次~3次,最后制成孢子悬液;用显微镜直接计数法计数,调整细胞浓度为108个/mL。
1.2.3.2 紫外诱变[9]
将紫外线灯开关打开预热约20 min,紫外等照射功率为15 W,距离为30 cm。将盛有菌悬液的套平皿置于磁力搅拌器上,紫外线灯下分别搅拌照射30、60、120、180、240、300、360、420、480 和 540 s。取 100 μL 稀释 10-4、10-5、10-6、10-7的菌液用涂布棒涂布均匀,同时涂布等量稀释的原孢子悬液做对照,置30℃培养24 h,进行菌落计数,计算致死率:

1.2.3.3 硫酸二乙酯诱变
使用1.0%DES,于26℃,150 r/min摇床中分别振荡 20、40、60、80、100、120 和 160 min,进行诱变。加入500 μL 25%硫代硫酸钠终止反应,12000 r/min离心10 min,去上清,取1 mL PBS缓冲液洗涤1次离心,加1 mL磷酸缓冲液重悬沉淀后每管取出100 μL稀释10倍。取稀释液100 μL涂平板。30℃倒置培养24 h,数菌落数,涂筛选平板筛选。
1.2.4 菌株筛选
将诱变得到的菌株进行初筛和复筛,初筛的过程采用筛选培养基进行,在30℃倒置培养24 h后选择透明圈和菌落直径比较大的保存;复筛的过程采用纤维二糖诱导培养基进行培养,在30℃,120 r/min培养3 d后,10000 g离心10 min,选择上清测定β-葡萄糖苷酶活力。
1.2.5 测定酶活力[10]
培养结束后取样品悬液12000×g离心5 min,留取上清测定酶活力。
β-葡萄糖苷酶活性测定方法:取上清液适当稀释的酶液0.5 mL,加入2 mL 0.5%的水杨素(乙酸钠缓冲液,pH 0.5,100 mmol/L)37℃反应 30 min,加入 2.5 mL DNS后沸水浴5 min,混匀,静止10 min,540 nm测定吸光度。
一个酶活性单位(U)定义为实验条件下每分钟从底物中释放1 μmol还原糖所消耗的酶的量。
2 结果与讨论
2.1 分离和鉴定
从腐败土样中挑选出几个在筛选培养基上长出较大黑圈的单菌落。经过PDA的划线培养纯化后,得到10株在筛选平板上能够产生较大透明圈比值的菌株分别命名为(zyb 1、zyb 2、zyb 3、zyb 4、zyb 5、zyb 6、zyb 7、zyb 8、zyb 9 和 zyb 10),将这 10 株菌分别接种在纤维二糖诱导培养基中培养,均表现出良好的生产胞外β-葡萄糖苷酶性能。在诱导培养基上生长的菌株离心测定上清液中的β-葡萄糖苷酶活力分别为:0.315、0.513、0.419、0.673、0.821、0.801、0.327、0.568、0.596、0.415 U/mL。选取β-葡萄糖苷酶活最高的菌株及zyb 5进行诱变选育。
2.2 诱变结果
2.2.1 紫外诱变
紫外诱变是一种常用的物理诱变手段。微生物在经过紫外线照射后,会受到不同程度的损伤,导致DNA或者是染色体发生畸形,从而导致生物性状的改变。在紫外诱变过程中,要了解菌株对紫外线的敏感性,需要进行诱变致死曲线的测定,根据致死曲线来确定最佳的紫外诱变时间。图1为紫外诱变过程中随着照射紫外时间延长得到的致死率曲线。
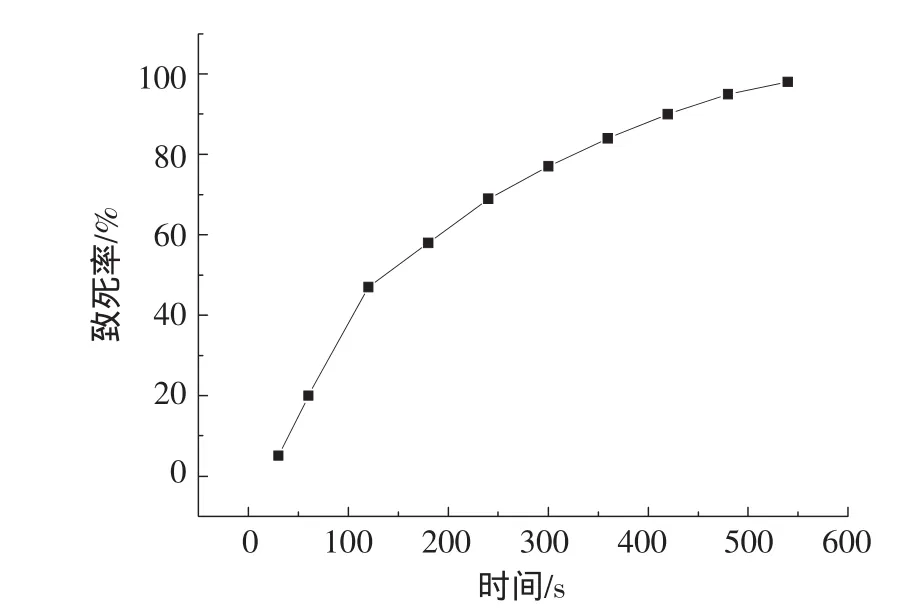
图1 紫外诱变致死率曲线Fig.1 Fatality rate after UV mutataion
根据文献报道曲线中达到最佳诱变效果的致死率应该在70%~80%[11-12],在此过程中选择的紫外诱变时间为300 s,此时致死率达到了77%,后面的实验选择紫外诱变的时间为300 s。
按照紫外诱变的方案,对得到的zyb 5菌株进行紫外诱变选育,经过初筛和复筛得到5株活力较高的菌株,分别命名为 UV-1,UV-2,UV-3,UV-4和 UV-5。在纤维二糖诱导产酶培养基中,它们发酵上清产酶活力分别为:1.21、1.05、1.18、1.38 和 1.25 U/mL。根据酶活力作为指标的筛选结果,DES诱变的出发菌株选择UV-4菌株。
2.2.2 硫酸二乙酯诱变
硫酸二乙酯是常用的化学诱变剂,主要的原理是导致碱基对的转换、缺失和易位等。本实验在紫外诱变高产菌株的基础上,对UV-4菌株的孢子悬液按照不同的处理时间进行处理。得到UV-4菌株在硫酸二乙酯诱变剂存在随着时间变化的致死率曲线见图2。
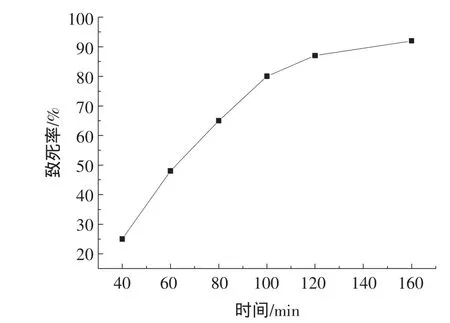
图2 硫酸二乙酯诱变致死率曲线Fig.2 Fatality rate after DES mutataion
从图2中可以看出,当使用DES处理时间达到100 min后,UV-4菌株的致死率达到了89%,时间延长后致死率太大,得到的菌株很难在进行初筛和复筛。考虑到突变较多又容易筛选,所以选择DES的诱变时间为100 min。按照DES诱变的方案,对得到的UV-4菌株进行诱变选育,经过初筛和复筛得到10株活力较高的菌株,分别命名为UV-4-DES1,UV-4-DES2,UV-4-DES3,UV-4-DES4,UV-4-DES5 和 UV-4-DES6。在纤维二糖诱导产酶培养基中,它们发酵上清产酶活力分别为:2.15、2.01、2.21、2.32、2.04、2.35U/mL。根据酶活力作为指标的筛选结果,DES诱变的出发菌株选择UV-4-DES6菌株。
2.3 UV-4-DES6菌株的发酵生产
纤维素酶尤其是β-葡萄糖苷酶的成本非常昂贵,为了降低生产成本。本研究在筛选诱变高产菌株的基础上,使用工农业废料包括麦麸(WB)、气爆玉米秸秆(TCS)、未处理的玉米秸秆(UTCS)、酒糟(DDG)、玉米浆(CSL)、豆粉(SM)或豆饼粉(BCP)替代诱导培养基中的纤维二糖,以发酵培养基为基准加入量,将工农业废料作为UV-4-DES6菌株发酵的碳源和氮源,30℃,120 r/min发酵3 d后,离心取上清测定酶活力。其中麦麸(WB)、处理过的玉米秸秆(TCS)、未处理的玉米秸秆(UTCS)和小麦秸秆(WS)被用作碳源,玉米浆(CSL),酒糟(DDG),豆粉(SM)和豆饼粉(BCP)被用作氮源,对诱变菌株的β-葡萄糖苷酶的生产进行培养基活性的选择。表1记录了所得结果,可以看出,在使用工农业废料作为生产β-葡萄糖苷酶的培养基而言,大部分具有比纤维二糖作为底物时更高的产酶能力。这也说明了诱变的UV-4-DES6菌株同样具有其它种纤维素酶生产的能力,可以完全降解这些工农业废料。就提高β-葡萄糖苷酶活性来说,处理过的玉米秸秆(TCS)是最好的碳源。这可归因于其前处理过程及组成成分。经气爆前处理后0.6%的葡萄糖(TCS)及疏松的结构组成更适合于β-葡萄糖苷酶的产生。来自不同工农业废料的氮源对β-葡萄糖苷酶产生的影响极为显著。加入豆粉后所得β-葡萄糖苷酶活性为2.738 U/mL,比纤维二糖作为碳源时酶活力增加了0.386 U/mL。可能是因为豆粉(SM)富含微量元素和维生素等物质。用工农业废料作为碳源和氮源生产β-葡萄糖苷酶不但可以降低产酶的成本,也减少环境污染。

表1 碳源和氮源对UV-4-DES6菌株所产β-葡萄糖苷酶活性的影响Table 1 Effect of carbon and nitrogen sources on BGL activity of UV-4-DES6
3 结论
本研究从常年堆积玉米秸秆的腐土中分离得到一株能生产β-葡萄糖苷酶的菌株zyb 5,此菌株具有较强的生长繁殖能力和产酶能力。对zyb 5进行紫外和化学诱变,得到菌株UV-4-DES6。在30℃,150r/min摇床发酵4 d后,产酶活力由出发菌株的0.821 U/mL上升到2.352 U/mL,提高了2.8倍。在此基础上采用工农业废料作为生产β-葡萄糖苷酶的培养基,经过优化β-葡萄糖苷酶活力升高了0.386U/mL,达到了2.738U/mL。与文献中已报道的其它菌类Monascus purpureus(2.04U/mL)[13],Penicillium echinulatum(0.31U/mL)[14],and Trichoderm-areesei(0.26 U/mL)[15]相比,本菌株的β-葡萄糖苷酶的酶活较高,而且产酶效率高,产酶较快。这种来源于腐土后经过诱变的UV-4-DES6菌株具有很强的工业化应用价值。
[1]刘泽寰,唐根云,全艳彩,等.绿色木霉BGLⅠ基因在酿酒酵母中的克隆表达及其纤维素乙醇发酵[J].兰州大学学报:自然科学版,2009(3):140-148
[2]江昌俊,李叶云.茶树鲜叶中β-葡萄糖苷酶的提取条件研究[J].南京农业大学学报,2000,23(2):93-96
[3]朱凤妹.原生质体融合曲霉菌株β-葡萄糖苷酶的酶学性质及对葡萄酒增香调控作用的研究[D].沈阳农业大学博士学位论文,2008
[4]王革平.多渠道提高粗饲料的利用率[J].畜牧与饲料科学,2006,27(5):23-30
[5]高祥照,马文奇,马常宝,等.中国作物秸秆资源利用现状分析[J].华中农业大学学报,2002,21(3):242-247
[6]R M,Wood P J.Use of Congored-polysaccharide interactions inenu-meration and characterization of cellulolytic bacteriafromthe-bovinerumen[J].Appl Environ Microbiol,1982,43:777-780
[7]Mandels M,WeberJ.The production of cellulases.Reese ETCellulases and their sapplication[J].American Society for Microbiology,1996,95:391-413
[8]顾卫民,郭海风,沈爱光.β-葡萄耱苷酶产生茼、发酵条件的优化、粗分离及其特性研究[J].江苏食品与发酵,2001(4):12-16
[9]张新峰,张华山,王伟平,等.原生质体紫外诱变选育木聚糖酶高产菌株[J].中国酿造,2010(9):73-76
[10]李平,宛晓春,丁霄霖,等.黑曲霉β-葡萄糖苷酶的活力测定和酶学性质[J].安徽农业大学学报,1998,25(3):304-309
[11]王春丽,武改红,陈畅,等.黑曲霉原生质体诱变选育β-葡萄糖苷酶高产菌株[J].生物工程学报,2009,25(12):1921-1926
[12]周海鸥,汪传高,张益波,等.统计学分析方法应用于桑黄菌发酵培养基的优化[J].食品研究与开发,2009,30(5):44-48
[13]Daniel J Daroit,Silvana T Silveira,Plinho F Hertz,et al.Production of extracellular β-glucosidase by Monascus purpureus on different growth substrates[J].Process Biochemistry,2007,42:904-908
[14]Leonardo Faria Martins,Daniel Kolling,Marli Camassola,et al.Comparison of Penicillium echinulatum and Trichoderma reesei cel-lulases in relation to their activity against various cellulosic substrates[J].Bioresource technology,2008,99:1417-1424
[15]邬敏辰,李江华.里氏木霉固体发酵生产纤维素酶的研究[J].江苏食品与发酵,1998(2):2-6
