结晶紫-ZnS-BSA光度法测定蛋白质的含量
2012-12-03胡卫平焦嫚董学芝王鑫
胡卫平,焦嫚,董学芝,王鑫
(河南大学化学化工学院环境与分析科学研究所,河南 开封 475004)
蛋白质是人类生命活动中最重要的物质基础,基本组成单位是氨基酸,组成蛋白质的氨基酸有20余种,体内只能合成一部分,其余则由食物蛋白质供给,准确测定蛋白质的含量是评价一种食品质量的重要手段[1]。目前蛋白质含量的测定方法很多,蛋白质的测定方法主要有紫外吸收法[2]、共振瑞利散射法[3]、电感耦合等离子体法[4]、流动注射法[5]等。
紫外分光光度法由于操作简单、仪器使用方便、测定速度快等优点应用广泛,目前分光光度法测定蛋白质的研究主要是利用小分子有机染料与蛋白质相结合的光谱探针方面。结晶紫是一种碱性三苯甲烷类染料,已有文献报道,以结晶紫为显色剂,与牛血清白蛋白(BSA)作用生成紫红色配合物,并且吸光度较结晶紫明显增大,从而测定蛋白质的含量[6]。
但是利用结晶紫与ZnS相结合并用分光光度法测定蛋白质的含量鲜见报道。基于ZnS与结晶紫作用可使结晶紫的吸光度降低,加入不同量的蛋白质,体系的吸光度逐渐增大,并且与BSA浓度在一定范围内有良好的线性关系。据此,建立了结晶紫-ZnS-BSA分光光度法测定蛋白质含量的新方法。
1 材料与方法
1.1 试剂与仪器
牛血清白蛋白(BSA):国药集团化学试剂有限公司;B-R缓冲溶液(取浓度均为0.04 mol/L的硼酸、磷酸、醋酸混合溶液,用0.02 mol/L的NaOH调至所需pH);NaH2PO4(0.0175 mol/L)-Na2HPO4(0.0175 mol/L)缓冲溶液(pH=7.00);巯基乙酸(0.1 mol/L),Zn(Ac)2·2H2O(0.1 mol/L),Na2S(0.1 mol/L),结晶紫(10-4mol/L),浓氨水。所用试剂均为分析纯,实验用水为二次蒸馏水。
Labtech-1000紫外-可见分光光度计:北京莱伯泰科仪器有限公司;pHS-3CT型酸度计:上海大普仪器有限公司;CL-4型恒温加热磁力搅拌器:郑州长城科工贸有限公司。
1.2 ZnS量子点的制备
在80mL的烧杯中,依次加入蒸馏水50mL、Zn(Ac)2·2H2O 5 mL、巯基乙酸5 mL,加热到70℃,用浓氨水溶液调节pH到8.35。在磁力搅拌器作用下,缓慢加入Na2S 4 mL,搅拌2 h,得到一定粒径大小的ZnS纳米微粒。
1.3 方法
在10 mL容量瓶中,依次加入0.5 mL结晶紫溶液、3.5 mL NaH2PO4-Na2HPO4缓冲溶液、2 mL ZnS 溶液、含适量BSA的溶液,蒸馏水稀释至刻度,摇匀。于30℃温度下反应 15 min,在最大吸收波长(λmax)590 nm处进行测定。
2 结果与讨论
2.1 体系的吸收光谱
体系的吸收光谱示于图1。
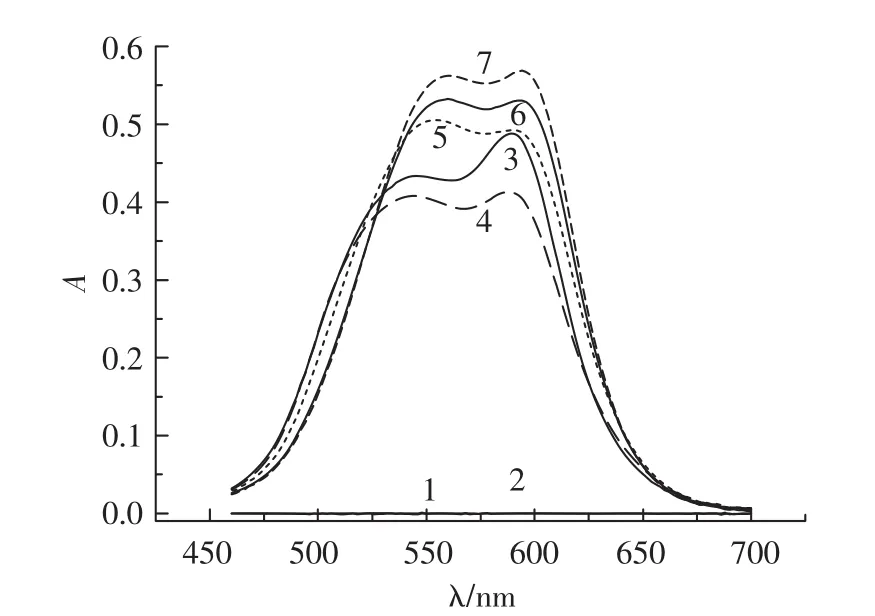
图1 紫外吸收光谱Fig.1 UV absorption spectrum
可以看出BSA与ZnS在可见光区无吸收,结晶紫在590 nm处有最大吸收,加入ZnS溶液反应后使结晶紫吸光度降低,随着不同量BSA溶液的加入,体系的吸光度逐渐增大。
2.2 酸度对体系吸光度的影响
配制一系列不同pH的B-R缓冲溶液,按照试验方法,测定不同酸度下的吸光度A,以A对不同酸度(pH)作图(见图2)。

图2 酸度的影响Fig.2 Effect of Acidity
试验表明,随着pH的增大,A逐渐降低,但当体系的酸度(pH)在6.0~8.0范围内,体系A趋于稳定,试验选择pH为7.0的缓冲溶液。
试验对 Na2HPO4·12H2O-NaH2PO4、Na2HPO4-柠檬酸、柠檬酸-柠檬酸钠、NaH2PO4-NaOH及B-R缓冲溶液进行选择,表明pH为7.0的Na2HPO4·12H2O-NaH2PO4缓冲溶液使体系的吸光度增加显著。
进一步对缓冲溶液的用量进行选择,见图3。
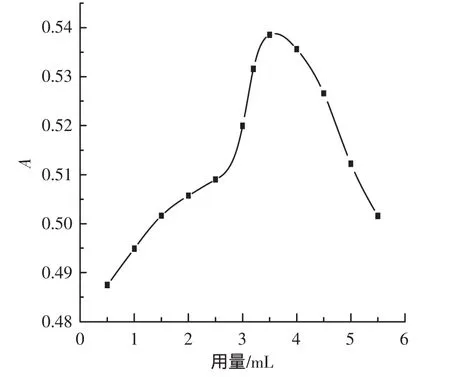
图3 缓冲溶液用量的影响Fig.3 Effect of the volume of buffer
试验表明,随着缓冲溶液用量的增加,A逐渐增大,在3.5 mL时体系吸光度达到最大。试验选择pH7.0的 Na2HPO4·12H2O-NaH2PO4缓冲溶液 3.5 mL。
2.3 结晶紫的用量对体系吸光度的影响
按照试验方法,固定其他条件不变,取不同体积的结晶紫溶液(10-4mol/L),并测定体系的吸光度,见图4。

图4 结晶紫溶液用量的影响Fig.4 Effect of the volume of methyl violet
试验表明,随着结晶紫用量的增加,吸光度逐渐增大,在0.5 mL后吸光度增加缓慢,因此选择10-4mol/L的结晶紫溶液0.5 mL。
2.4 ZnS的用量对体系吸光度的影响
固定其他条件不变,改变ZnS的用量,测定体系的吸光度,以吸光度A对ZnS的用量作图,见图5。
试验表明,随着ZnS用量的增多,体系的吸光度逐渐降低,当用量达到2.0 mL~3.0 mL时,体系吸光度趋于稳定。选择ZnS溶液用量为2.0 mL。

图5 ZnS用量的影响Fig.5 Effect of the volume of ZnS
2.5 反应温度和时间的影响
用温度控制仪调节水温,在20℃~70℃温度范围内分别测定温度对体系吸光度的影响,结果表明,20℃~40℃体系较为稳定,随着温度的升高,体系的吸光度逐渐升高,试验选择温度为30℃。
在30℃的温度下,测定反应时间对体系的影响,见图6。

图6 时间的影响Fig.6 Effect of the reaction time
试验表明,随反应时间的增加,体系的吸光度逐渐升高,而反应20 min后,吸光度增加缓慢,因此选定反应时间为20 min。
2.6 标准曲线
按照试验方法,加入不同量的BSA,测定体系的吸光度,以吸光度A对BSA浓度C作图,见7所示。
试验表明,A与BSA浓度在0.0100mg/mL~4.400mg/mL范围内呈良好的线性关系,回归方程为A=2.0406+0.46050 C(mg/mL),相关系数R=0.9962,检出限为0.009152 mg/mL。
2.7 共存离子的干扰
考察了常见的金属离子及多种氨基酸对含有5μg/mL BSA体系的影响,结果表明,在±5%误差允许范围内,100倍的柠檬酸三钠、淀粉、甘氨酸、蔗糖、葡萄糖、尿素、安赛蜜、三聚氰胺,50倍的L-谷氨酸,DL-苹果酸、NaCl、NH4Cl、KCl,25 倍的 FeCl3、FeSO4、AlCl3,同倍的 BaCl2、Mg(NO3)2、Pb(NO3)2对试验均没有影响。

图7 标准曲线Fig.7 The calibration curve
2.8 样品测定及与标准方法对照
取肉松 6.5160 g、牛奶 1.9949 g、鸡精 5.0050 g,分别稀释定容至100 mL,振荡5 h,使样品中蛋白质充分溶解。再取少量乙醚萃取3次除去样品中的脂肪,弃去溶有脂肪的乙醚层,过滤,滤液即为待测液。按照试验方法,测定样品中BSA的含量,且与考马斯亮蓝法做对照,结果见表1。
2.9 加标回收试验
吸取一定量的样品测试液,分别加入一定量的BSA标准溶液,按照实验方法做加标回收试验,结果见表2,可以看出样品平均回收率较好,说明该方法较准确。
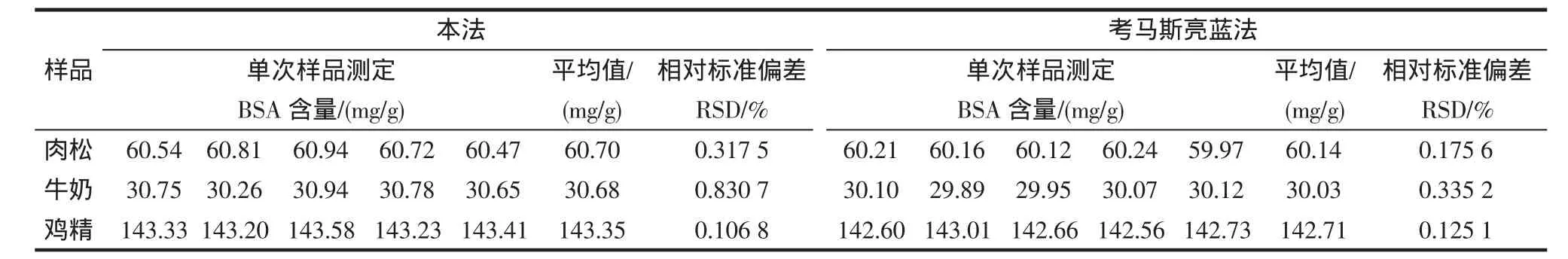
表1 样品中BSA的测定结果Table1 Determination results of BSA samples

表2 加标回收试验Table 2 Recovery test
3 结论
利用ZnS与结晶紫作用,生成复合物,该复合物与蛋白质作用,使体系吸光度显著增大,采用分光光度法法测定样品中蛋白质的含量。该方法准确、简单、快速、线性范围宽,通过测定样品并与标准方法做对照,结果满意,可用于食品中蛋白质含量的测定。
[1]张红英,王丽,郭爱静.应用Primacs SN总氮/蛋白质分析仪测定食品中的蛋白质[J].理化检验-化学分册,2007,43(12):976-978
[2]杨睿,刘绍璞.某些分子光谱法测定蛋白质的进展[J].分析化学,2001,29(2):232-241
[3]Long X F,Liu S P,Kong L,et al.A study on the interaction of proteins with some heteropoly compounds and their analytical application by resonance Rayleigh scattering method[J].Talanta,2004,3(63):279-286
[4]Lamer-Déchamps S L,Poucheret P,Pérez J L.Validation of an inductively coupled plasma-mass spectrometry method to quantify tungsten in human plasma.Determination of percentage binding to plasma proteins[J].Clinica chimica acta,2003,327(23):39-46
[5]Ying Li,Lijun Dong,Weiping Wang.Flow injection analysis-Rayleigh light scattering detection for online determination of protein in human serum sample[J].Analytical biochemistry,2006,354(4):64-69
[6]杜鹃.结晶紫分光光度法测定蛋白质的含量[J].化学分析计量,2006,15(4):46-47
