甘草多糖提取纯化工艺研究
2012-12-03王振强申森樊欣
王振强,申森,樊欣
(1.黄河水利职业技术学院,河南 开封 475003;2.开封第一人民医院,河南 开封 475001)
甘草(Glycyrrhiza)属多年生草本植物,主要产于新疆、内蒙、山西、甘肃、陕西等地,常用中草药,有中草药之王的美誉,是我国传统的“药食兼用”中药材料。近年随着人们对甘草多糖认识的提高,人们发现多糖参与了细胞的多种生命现象的调节,如免疫细胞间信息的传递和感受,具有多种保健功能,在医药、食品、工业等方面得到广泛应用。因此,开展甘草多糖提取工艺研究具有重要的意义。
1 材料与方法
1.1 材料
甘草:市售;甲醇、无水乙醇、苯酚(以上均为分析纯):天津北方天医化学试剂厂;硫酸(分析纯):文达稀贵试剂化工厂;甲醇(色谱纯)天津大学科威公司。
1.2 仪器与设备
YP型电子天平:上海天平仪器厂;LSY电热恒温水浴锅:北京医疗设备厂;DG404真空电热干燥箱:天津市天宇实验仪器有限公司;LG16-W离心机:北京医用离心机厂;QL-901微型漩涡混合器:其林贝尔仪器制造公司。
1.3 方法
1.3.1 甘草多糖测定方法
采用苯酚-硫酸比色法测定甘草多糖。
1.3.2 测定原理
多糖被浓硫酸在适当高温下水解,产生单糖,并迅速脱水成糠醛衍生物,在强酸条件下与苯酚起显色反应,生成橙黄色物质,在波长490 nm处其吸光度A值与糖浓度C呈线性关系,从而可用比色法测定其含量。
1.3.3 标准溶液的配制
称取干燥的葡萄糖20.00 mg,置500 mL容量瓶中,加水溶解并稀释至刻度线,摇匀,配得葡萄糖标准溶液。
1.3.4 苯酚溶液的配制
称取80.0 g苯酚加20.0 g水使之溶解,配制80%苯酚溶液,置于冰箱中避光保存。然后取80%苯酚37.5 mL定容到500 mL,配制成6%的苯酚溶液避光保存备用。
1.3.5 单因素对甘草多糖提取的影响
1.3.5.1 料液比影响
称取5份甘草粉末各1.0 g,置于250 mL圆底烧瓶中,分别加入 15、20、25、30、35 倍水,100 ℃水浴下,回流提取 1 h,离心分离(5000 r/min,15min),浸提液至100 mL容量瓶蒸馏水定容,取2 mL于10 mL试管中用硫酸-苯酚法测定其吸光度值。
1.3.5.2 提取温度影响
称取5份甘草粉末各1.0 g,置于250 mL圆底烧瓶中,各加入 15 倍水,分别在 40、50、60、70、80、90、100 ℃水浴下,回流提取 1 h,离心分离(5000 r/min,15 min),浸提液至100 mL容量瓶蒸馏水定容,取2 mL于10 mL试管中用硫酸-苯酚法测其吸光度值。
1.3.5.3 提取时间影响
称取5份甘草粉末各1.0 g,置于250 mL圆底烧瓶中,各加入15倍水,70℃水浴下,分别回流提取0.5、1、1.5、2、2.5、3 h,离心分离(5000 r/min,15 min),浸提液至100 mL容量瓶蒸馏水定容,取2 mL于10 mL试管中用硫酸-苯酚法测其吸光度值。
1.3.5.4 提取次数影响
称取5份甘草粉末各1.0 g,置于250 mL圆底烧瓶中,各加入15倍水,70℃水浴下,分别回流提取1、2、3、4、5、6、7、8 次,每次提取 0.5 h,离心分离(5000 r/min,15 min),浸提液至100 mL容量瓶蒸馏水定容,取2 mL于10 mL试管中用硫酸-苯酚法测其吸光度值。
1.3.6 提取工艺正交试验因素水平选择
根据单因素试验结果,设计正交试验,确定最佳提取工艺条件见表1。
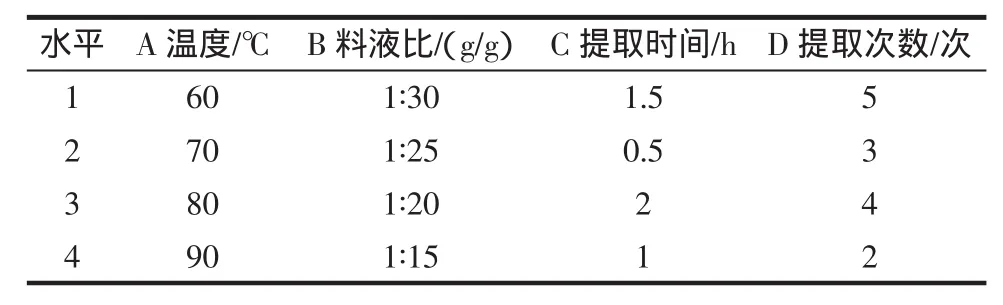
表1 提取工艺正交试验因素水平表Table 1 Orthogonal experiment factor level glass
1.3.7 醇沉条件正交试验因素水平选择
取粉碎甘草约25 g,按照最优提取条件进行提取,并设计正交试验见表2。
1.3.8 多糖提取率测定
按照最佳提取工艺进行提取,然后再用醇沉最佳条件进行纯化,得出甘草多糖的提取率。

表2 醇沉条件正交试验因素水平表Table 2 Orthogonal experiment factor level glass
2 结果与分析
2.1 单因素对甘草多糖提取的影响
2.1.1 料液比影响
取粉碎样品,提取条件为100℃、1 h、提取次数1 次,料液比分别为 1∶15、1∶20、1∶25、1∶30、1∶35 g/g。料液比对甘草多糖提取效果的影响如图1所示。
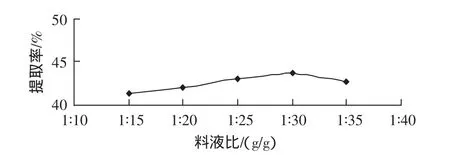
图1 料液比影响Fig.1 Liquid ratio influence
由图1可以看出,甘草多糖提取量随料液比的增大而增加。当料液比大于1∶30 g/g时,甘草多糖提取量缓慢降低。
2.1.2 温度影响
取粉碎样品,提取条件为料液比1∶15 g/g、提取时间 1 h、提取次数 1 次,温度分别为 40、50、60、70、80、90、100℃。提取温度对甘草多糖提取效果的影响如图2所示。
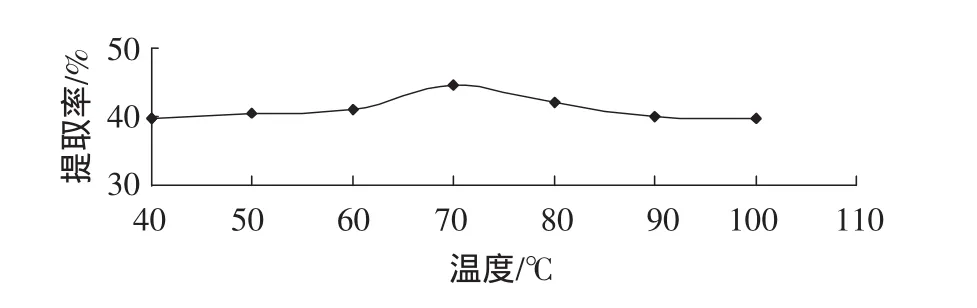
图2 提取温度影响Fig 2 Extraction temperature influence
由图2可以看出,提取温度由40℃增加到70℃时,甘草多糖提取量随温度的提高而上升,当温度超过70℃以后,继续提高温度,甘草多糖的提取量缓慢下降。
2.1.3 提取时间影响
取粉碎样品,提取条件为料液比1∶15g/g、温度70℃、提取次数为 1 次,提取时间分别为 0.5、1.0、1.5、2.0、2.5h。提取时间对甘草多糖提取效果的影响如图3所示。
由图3可以看出,在提取时间1 h时提取率较高,随着时间的延长,提取率下降。
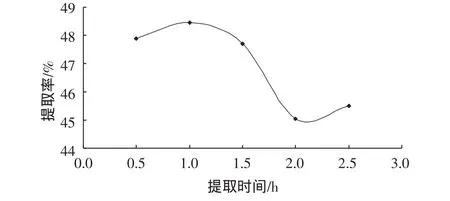
图3 提取时间影响Fig 3 Extraction time influence
2.1.4 提取次数影响
取粉碎样品,提取条件为料液比1∶15g/g、温度70℃,提取时间为 0.5 h、提取次数分别为 1、2、3、4、5、6、7、8次。提取次数对甘草多糖提取效果的影响如图4所示。
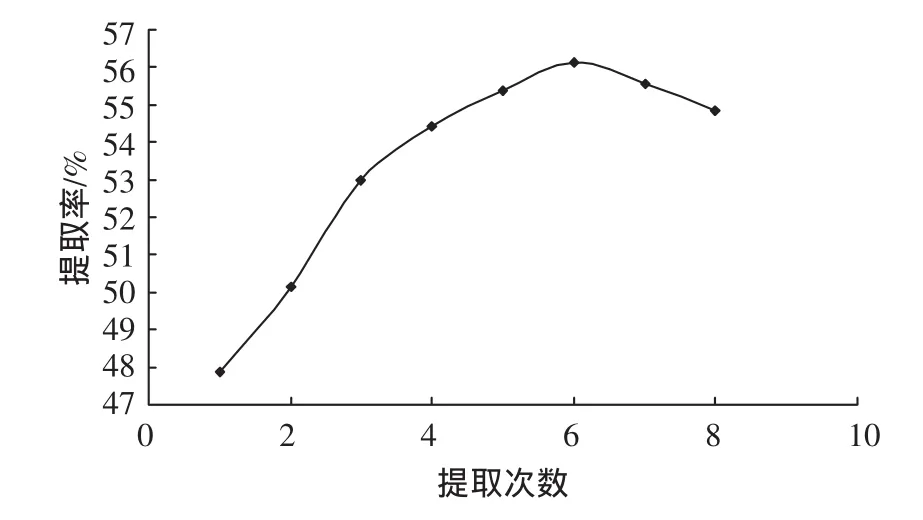
图4 提取次数影响Fig 4 Extraction times influence
由图4可以看出,随着提取次数的增加,提取率不断提高,当增加到6次后,提取率缓慢下降。
2.2 甘草多糖提取条件的正交优化试验结果
甘草多糖提取条件正交优化试验结果见表3,方差分析结果见表4。
由表3可知,单因素对提取效果的影响顺序为:A>B>C>D,由表4可知,A因素具有显著性(P<0.05)影响,B、C具有较显著性(P<0.1)影响,由于D没有显著性影响,选取较为节约的条件,提取次数2次,结合甘草多糖提取正交试验分析结果,甘草多糖提取最佳工艺条件为 A4B1C2D4,即温度 90 ℃,料液比 1∶30 g/g,时间0.5 h,提取次数2次。按最佳条件进行验证,甘草多糖提取率为59.80%。
2.3 醇沉条件正交试验结果
醇沉条件正交优化试验结果见表5,方差分析结果见表6。
由表5可知,单因素对醇沉条件的影响顺序为:A>B>C,由表6可知,A因素具有显著性(P<0.05)影响,B、C具有较显著性(P<0.1)影响,结合醇沉条件正交试验分析结果,最佳醇沉条件为A1B1C3,即乙醇浓度80%,絮凝时间12 h,室温下醇沉。

表3 甘草多糖提取条件正交试验设计Table 3 Orthogonal experiment design of Glycyrrhiza polysaccharide extraction condition
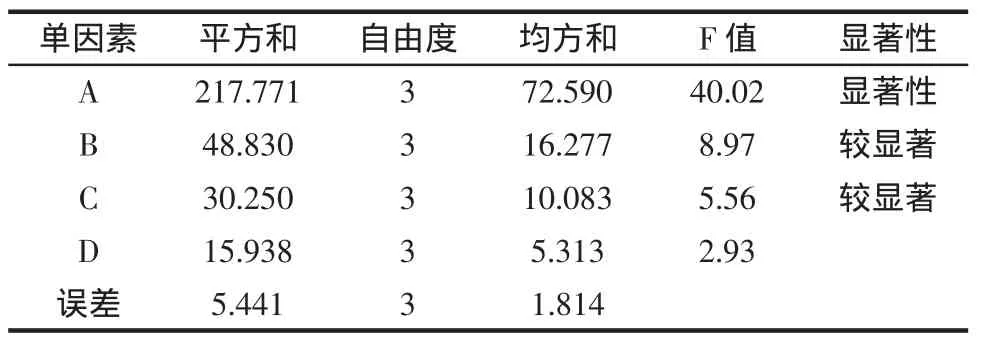
表4 正交试验方差分析结果Table 4 Orthogonal experiment variance analysis result
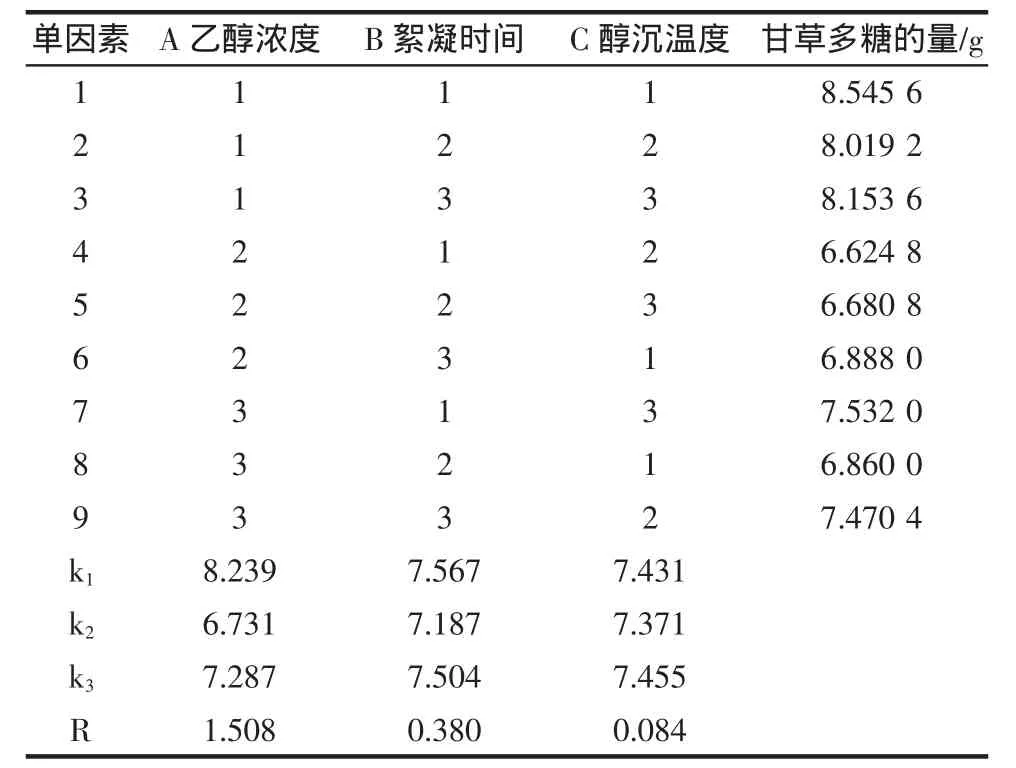
表5 醇沉条件正交试验设计Table 5 Orthogonal experiment design of alcohol precipitation

表6 正交试验方差分析结果Table 6 Orthogonal experiment variance analysis result
3 结论
1)根据甘草多糖提取正交试验及方差分析结果,单因素对提取效果的影响顺序为:温度>料液比>提取时间>提取次数,其中温度具有显著性,料液比和提取时间较显著,提取次数不显著;甘草多糖提取最佳工艺条件为 A4B1C2D4,即温度 90 ℃,料液比 1∶30 g/g,时间0.5 h,提取次数2次。按最佳条件进行验证,甘草多糖提取率为59.80%。
2)根据醇沉条件正交试验及方差分析结果,单因素对醇沉条件的影响顺序为:乙醇浓度>絮凝时间>醇沉温度,其中乙醇浓度具有显著性,絮凝时间和醇沉温度较显著,最佳醇沉条件为A1B1C3,即乙醇浓度80%,絮凝时间12 h,室温下醇沉。
[1]张继,姚健,丁兰,等.甘草的利用研究进展[J].草原与草坪,2000(2):12-17
[2]石雪萍.植物多糖研究进展[J].粮食与油脂,2005(8):8-10
[3]孙玉敬,叶柄鸿.多糖研究热点[J].粮食与油脂,2005(8):3-8
[4]孙萍,李艳,顾承志,等.甘草多糖的微波提取及含量测定[J].基层中药杂志,2001,15(6):22-23
[5]王航宇,刘金荣,江发寿,等.新疆甘草多糖的超声提取及含量测定[J].基层中药杂志,2002,16(1):7-8
