“肌壁大部切除-子宫重建术”治疗中、重度子宫腺肌病的术式与安全性探讨
2012-12-03肖雁冰李青汉方德容梁志刚王东红
肖雁冰,赵 菁,李青汉,方德容,梁志刚,王东红,刘 毅
(遵义医学院附属医院妇科,贵州遵义 563099)
子宫腺肌病是妇科多发病,发病率约占女性人群的10%,且呈逐年增加之趋势。由于该病痛经和月经异常现象通常较为明显,严重影响患者的生殖健康和生活质量。尽管目前针对该病保守治疗的方法众多,但都存在治疗不彻底、易复发等问题,尤其对病变严重者,故子宫切除仍是目前临床治疗该病的主要手段[1]。
子宫腺肌病是一种“良性”和激素依赖性疾病,随着对子宫功能认识的逐步提高和妇女健康意识的增强,保留子宫已成为广大腺肌病患者的治疗意愿。此外,新的预防腺肌病复发乃至有一定治疗效果的方法的出现(如“曼月乐”[左旋炔诺孕酮宫内缓释节育系统,LNG-IUS,IUS]),使腺肌病、尤其是病变严重者保留子宫成为可能。本研究首创“肌壁大部切除-子宫重建术(major uterine wall resection and reconstruction of the uterus,MURU)”并于术中宫内放置IUS治疗中、重度子宫腺肌病,现将手术相关情况报道如下。
1 资料与方法
1.1 病人来源与入选标准
1.1.1 病人来源与腺肌病分度 2012年3月至2012年6月就诊于我院妇科、根据病人痛经病史、妇科检查、阴道彩超及CA125诊断为“子宫腺肌病”的病人,按彩超子宫(单侧)肌壁厚度(前壁、后壁或宫底)或腺肌瘤最大直径将病人病分为轻、中、重三度。轻度:肌壁厚度或腺肌瘤最大直径<35 mm;中度:肌壁厚度或腺肌瘤最大直径为35~49 mm;重度:肌壁厚度或腺肌瘤最大直径≥50 mm。
1.1.2 入选标准 本研究入选对象为重度腺肌病患者,即肌壁或腺肌瘤最大直径≥50 mm。此外,如中度患者经高强度聚焦超声(High intensity focused ultrasound,HIFU)定位失败(不适于 HIFU治疗)或病人不愿行HIFU治疗亦纳入本研究。按上述要求,共计32例病人入选,其中,重度患者25例、中度7例。
1.1.3 测量器 天平(采用上海楚柏实验室设备有限公式生产的电子分析天平,型号:CAV3102C,精确度:0.01 g);玻璃量杯(广东揭阳市成康医疗器械有限公司生产,规格型号:500 mL,允许误差:0.05 mL)。
1.2 方法
1.2.1 MURU手术过程 麻醉后常规开腹(以下腹横切口为宜,5~7 cm),巾钳夹持宫体肌壁并将其提出于腹壁外(如有粘连则先分离之),止血带于子宫峡部稍下环扎,沿子宫中线或旁开中线纵形切开子宫肌壁达宫腔底部,于浆肌层下约0.5 cm向两侧及宫颈方向分离浆肌层与肌壁达子宫峡部水平(外切口);于内膜外约0.5 cm切开肌壁、向下逐渐切开达峡部与外切口汇合、切除肌壁。修剪多余浆肌层及粘膜层(预留宫腔之长度以放置一枚IUS为宜,即纵径3~4 cm)。剪去IUS多余尾丝(留取约4 cm)并于末端打结,将IUS置于宫腔内,2/0可吸收线褥式内翻缝合关闭粘膜层以重建宫腔;再用2/0可吸收线将两侧修剪之浆肌层向中线靠拢、间断缝合关闭死腔,使剩余之浆肌层和粘膜层重新形成新的子宫壁。皮肤以3/0可吸收线连续褥式外翻缝线。记录手术时间、出血量;切除子宫肌壁组织,术毕称重、测量体积;送病理组织学检查。
1.2.2 重建子宫要求 重建子宫腔以能容下一枚IUS为宜;重建子宫肌壁(单侧)厚度(前、后壁及宫底)≤20 mm。重建后子宫体积应等于或小于正常育龄子宫[2]。
1.2.3 子宫体积(术前)计算 参照公式V=π/6×a×b×c计算子宫体积[3](V 为体积;a、b、c为超声所测子宫长径、横径、厚度)。
1.2.4 切除子宫肌壁组织称重及体积测量 将切除肌壁组织全部放于天平上称重后,再放入盛满水的容器中,测量溢出水的体积即为切除肌壁组织的体积。
1.3 统计学方法 数据以均数±标准差(x±s)表示,采用SPSS13.0统计软件包,t检验,P<0.05为差异有显著性。
2 结果
2.1 MURU的安全性 32例病人手术均获功成,平均手术时间85.56±25.34 min;术中平均出血61.27±25.47 mL,无 1 例病人术中或术后输血。术后1例病人发生切口轻微脂肪液化,经虎杖膏(消炎散)切口两侧外敷后7 d出院,平均住院时间4.60±0.57 d。所有病人无其它术中或术后并发症发生;术后病理学检查所有病人均证实为“子宫腺肌病”。
2.2 MURU的效果 32例病人术前子宫平均体积268.52 ±98.75 cm3,切除子宫肌壁的平均重量315.45 ±72.36 g、平均体积 282.43 ±151.67 cm3。结合本研究对重建子宫大小的要求和已育女性正常子宫体积、重量(体积:8 cm×5 cm×3 cm×π/6=62.80 cm3;重约 60 g)[2],术后病人子宫平均体积缩小约4.28 倍(268.52 ÷62.80)。切除肌壁的重量为正常子宫重量的5.28倍(315.45÷60)。MURU过程及效果(见图1)。
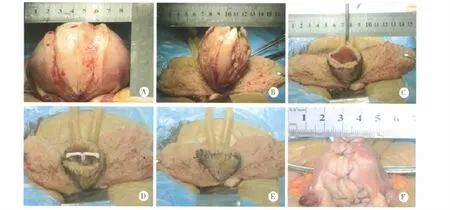
图1 MURU手术过程及效果图(A~F)
3 讨论
3.1 MURU的安全性和手术效果 MURU联合IUS是一种全新的手术治疗子宫腺肌病的设想和偿试,由于没有资料可供借鉴和参考,MURU手术的安全性是必须首先要考虑的问题。本研究结果显示,32例病人手术均获功成,平均手术时间约85 min;平均出血量约61 mL;平均住院时间约4.6 d。除1例病人术后发生轻微脂肪液化外,无其它术中或术后并发症,以上结果表明,MURU手术方式是安全的。
32例病人术前子宫平均体积为268.52±98.75 cm3,切除肌壁的平均重量为 315.45 ±72.36 g、平均体积为282.43±151.67 cm3。结合本研究对重建子宫大小的要求和女性正常子宫体积、重量,术后病人子宫平均体积缩小约4.28倍;切除肌壁的重量为正常子宫重量的5.28倍。以上数据均表明,MURU手术切除的范围是非常广泛的。
3.2 MURU术式探讨与体会 子宫腺肌病的治疗方法繁多,但由于各种原因[4-6],手术切除子宫仍是目前腺肌病、尤其是中、重度腺肌病患者的主要治疗手段,子宫切除虽可彻底治疗腺肌病,但也存在相应的风险与问题[7,8]。更为重要的是,随着对子宫功能认识的逐步提高和妇女健康意识的增强,保留子宫已成为广大腺肌病患者的治疗意愿。就目前所知,子宫至少有五个方面的功能[2,9]。大量研究表明[10,11],子宫切除可能导致盆底功能障碍、卵巢功能过早衰退以及情感和家庭方面的问题。另外,腺肌病是一种“良性”和激素依赖的疾病,因此,只要技术可行,就可以保留子宫。
保留子宫治疗腺肌病的手术方式除了传统的病灶切除术(主要适于局灶型),Nishida[13]等还描述了一种“子宫肌壁部分切除”治疗弥漫型腺肌病的术式,这个过程涉及从子宫中线纵向剖开,从前壁或后壁中心处切除病灶,然后从左右两边对子宫进行缝合。但Nishida的方法仍只限于对肌壁部分病灶的切除,实际上是传统病灶切除术在弥漫型腺肌病中的应用。本研究所用术式切除了子宫峡部以上、浆肌层以内约0.5 cm和粘膜层以外约0.5 cm的所有子宫肌层组织(前壁、后壁和宫底部);此外,增大的宫腔被缩至3~4 cm。基于这些要求或参数,最后重建成形的子宫体积需等于或小于正常子宫。因此,MURU与Nishida描述的局部病灶切除有着本质的区别。
MURU是手术治疗中、重度子宫腺肌病的一种积极探索和偿试,对于本术式,我们的经验是:①浆肌层和粘膜层留取组织厚度以不超过1.0 cm为宜。②宫腔缩小至刚好能放置一枚IUS为宜。③向中线缝合浆肌层与粘膜下层时,尽可能修剪多余之浆肌层组织以缩小重建后的子宫体积,此意味着可能残存的病灶组织更少;同时,缝合过程中应注意“钩底”、彻底关闭两层间死腔,防止出血。④术中尽可能使用电刀,它不但可以节省体力(腺肌病组织质地通常较硬),而且,能在一定程度上破坏可能残留的病灶组织。⑤缝合成形中注意对称性,尽可能使重建后的子宫外形接近正常子宫形态。
综上所述,MURU用于治疗中、重度子宫腺肌病是安全的,手术切除的组织量和子宫重建的效果也是非常明显的。后续我们将对MURU联合IUS治疗中、重度子宫腺肌病的近、远期疗效进行跟踪报道。
[1]Yang J-H,Ho H -N,Yang Y -S.Current diagnostic and treatment strategies for adenomyosis.Expert Rev[J].Obstet Gynecol,2006,1:111.
[2]郞景和.子宫内膜异位症的基础与临床研究[M].中国协和医科大学出版社,2003.
[3]G ter Haar,I Rivens,L Chen,et al.High Intensity Focused Ultrasound for the treatment of rat tumors[J].Phys Med Biol,1991,36:1405 -1501.
[4]Siskin G P,Tublin ME,Stainken B F,et al.Uterine artery embolization for the treatment of adenomyosis:clinical response and evaluation with MR imaging[J].Am J Roentgenol,2001,77:297.
[5]Pagedas A C,Boe I H,Perkins H E.Review of 24 cases of uterine ablation failure[J].J Am Assoc Gynecol Laparosc,1995,2:239.
[6]Bohlman M E,Ensor R E,Sanders R C.Sonographic findings in adenomyosis of the uterus[J].Am J Roentgenol,1987,148:765.
[7]McCausland A M,McCausland V M.Depth of endometrial penetration in adenomyosis helps determine outcome of rollerball ablation[J].Am J Obstet Gynecol,1996,174:1786.
[8]Loffer F D.Endometrial ablation and resection[J].Curr Opin Obstet Gynecol,1995,7:290.
[9]Speroff L,Glass R H,Kase N G.The uterus.Clinical Gynecologic Endocrinology and Infertility[M].6th ed.Baltimore,Md:Lippincott Williams & Wilkins,1999.Chapter 4.
[10]Laughlin G A,Barrett-Connor E,Kritz-Silverstein D,et al.Hysterectomy,oophorectomy,and endogenous sex hormone levels in older women:the Rancho Bernardo Study[J].J Clin Endocrinol Metab,2000,85(2):645-651.
[11]Rivera C M,Grossardt B R,RhodesD J,et al.A.Increased Mortality for Neurological and Mental Diseases following Early Bilateral Oophorectomy[J].Euroepidemiology,2009,33(1):32 -40.
[12]Farquhar C M,Sadler L,Harvey S A,et al.The association of hysterectomy and menopause:a prospective cohort study[J].BJOG:an international journal of obstetrics and gynaecology,2005,112(7):956 -962.
[13]Nishida M,Takano K,Arai Y,et al.Conservative surgical management for diffuse uterine adenomyosis[J].Fertility and Sterility,2010,94(2):715 -719.
