阿司匹林对人结肠癌细胞中肿瘤干细胞标记物Lgr 5表达的影响*
2012-12-03陈小燕廖永美
陈小燕,廖永美,赵 逵
(遵义医学院附属医院消化内科,贵州遵义 563099)
结直肠癌是胃肠道中最常见的恶性肿瘤之一,发病率和死亡率逐年增高,发病年龄也明显提前。结直肠癌组织中一小部分具有自我更新的能力,并在肿瘤的发生、生长和转移中起重要作用的细胞被称为肿瘤干细胞,是肿瘤根治的靶点。Lgr 5是最新发现的Wnt通路的靶基因,Lgr 5蛋白是肠道干细胞标志物[1],在结直肠癌中高表达,与结直肠癌的发生与发展密切相关[2],可能作为一个潜在的治疗靶点。阿司匹林作为一种临床常用的非甾体抗炎药(NSAIDs),除具有解热镇痛抗炎作用外,研究表明它还可以降低腺瘤和结直肠癌发生的风险,有效预防结直肠癌发生[3]。近年来大量流行病学和实验室研究均表明NSAIDs能抑制甚至逆转结直肠癌癌前病变。阿司匹林抗肿瘤作用可能是通过COX-2途径实现,NSAIDs能降低结直肠癌前腺瘤及癌组织中COX-2表达,抑制肿瘤生长。然而并非所有结直肠癌均表达COX-2,对此类COX-2阴性表达的肿瘤细胞,NSAIDs的作用如何研究尚少。此外,阿司匹林是如何作用于结直肠癌干细胞,对肿瘤干细胞标志物Lgr 5又有何影响,Lgr 5与COX-2之间有何联系,都尚不清楚。本研究拟通过阿司匹林对人结肠癌细胞株COX-2高表达的HT -29、COX -2 阴性表达的 SW -480[4]中肿瘤干细胞标记物Lgr 5表达影响的研究,探讨阿司匹林预防结直肠癌发生的可能机制。
1 材料与方法
1.1 材料
1.1.1 细胞株 人结肠癌细胞株HT-29购于中科院上海细胞库,人结肠癌细胞株SW-480购于重庆医科大学细胞实验室。
1.1.2 药物和主要试剂 阿司匹林、McCoy’S 5a培养基及胰蛋白酶购自美国Sigma公司,胎牛血清购自美国Hyclone公司,兔抗人Lgr 5多克隆抗体购自美国Abcam公司,小鼠抗人β-actin、辣根酶标记山羊抗兔IgG及辣根酶标记山羊抗小鼠IgG购自北京中杉金桥公司,BCA蛋白浓度测定试剂盒(增强型)以及RIPA裂解液购自武汉博士德公司。
1.2 方法
1.2.1 细胞的培养 人结肠癌细胞株HT-29、SW480培养于含10%胎牛血清的McCoy’S 5a培养基,置于37℃、5%CO2的培养箱中常规培养,待细胞贴壁生长至80% ~90%融合时,用0.25%胰蛋白酶-0.02%EDTA混合液进行消化传代。细胞生长状态良好、处于对数期时用于实验。
1.2.2 Western blot检测结肠癌细胞系株 HT-29、SW-480细胞中Lgr 5蛋白的表达 将HT-29、SW480细胞以每瓶5×105个细胞接种于50 cm2的组织培养瓶中,培养24h后分别加入含0、2.5、5.0、10.0 mmol/L 阿司匹林的培养基继续培养24 h。收集不同药物浓度处理后的细胞,按RIPA方案提取细胞总蛋白,用BCA法测定蛋白浓度,定量上样(每孔约30μg)后行8%的聚丙烯酰胺凝胶电泳,转膜后封闭1h。加入兔羊抗人Lgr 5多克隆抗体(1:400稀释)、小鼠抗人β-actin一抗(1:5000 稀释),4℃过夜,0.1%TBST 漂洗 3 ×10 min,于室温与HRP标记山羊抗兔IgG、辣根酶标记山羊抗小鼠 IgG孵育1 h,0.1%TBST漂洗3×10 min。应用Luminol显色,暗室X线胶片曝光,调整曝光时间直至最佳条带,拍照。用凝胶图象分析系统进行结果分析。
1.3 统计学处理 计量资料均采用均数±标准差(珋x±s)表示,采用SPSS 17.0统计学软件进行统计学处理,组内的比较采用单因素方差分析,组间比较采用独立样本t检验,P<0.05表示差异有统计学意义。
2 结果
Western blot检测的结果显示,在HT-29和SW480细胞中,从对照组到不同浓度的阿司匹林组,可见Lgr 5蛋白印记条带颜色由深到浅(见图1)。在HT-29细胞中,Lgr 5蛋白的校准值(Lgr 5蛋白的积分光密度值/β-actin蛋白的积分光密度值)分别为 1.0175 ±0.14796、0.7600 ± 0.09018、0.5976±0.11822,均低于对照组的 1.3025 ±0.17115(见表1);在SW480细胞中,不同浓度的阿司匹林作用组的Lgr 5蛋白的校准值(Lgr 5蛋白的积分光密度值/β-actin蛋白的积分光密度值)分别为 1.1350 ± 0.11030、0.8450 ± 0.17311、0.5774±0.10575,均低于对照组的 1.5050 ±0.20857(见表1),对照组与不同浓度组比较差异有统计学意义(P<0.05)。两种细胞的组间相比均无显著性差异(P>0.05)(见图2)。
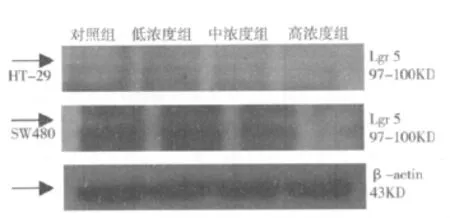
图1 Westem-blot检测Lgr 5蛋白在细胞系HT-29细胞和SW480细胞中不同组别的表达

表1 HT-29细胞和SW480细胞中Lgr 5蛋白质在不同组别表达的比较
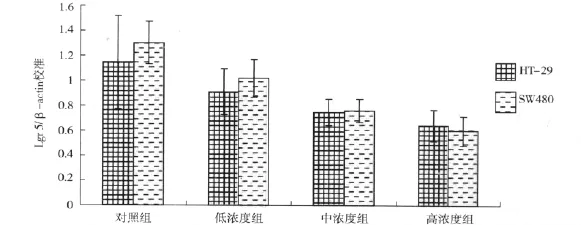
图2 HT-29细胞和SW480细胞中不同组别表达Lgr 5蛋白(Lgr 5/β-actin)的比较
3 讨论
近年来,肿瘤干细胞理论的提出为肿瘤研究提供了新的方向,肿瘤干细胞是肿瘤发生的根源,也是彻底根治肿瘤的靶点[5]。多项研究表明Lgr 5+成体干细胞是肠道肿瘤细胞的起源[6,7]。在关于结肠癌的研究中发现Lgr 5是Wnt通路的靶基因,在小肠隐窝基底部、结肠隐窝、胃腺体底部及毛囊等多种组织中表达,而且是包括肠道和毛囊在内的多种自我更新组织的成体干细胞标志物[8]。Barker等[9]首次提出了 Lgr 5 作为肠道肿瘤干细胞标记物的理论,随后大量研究表明Lgr 5是结直肠癌干细胞标志物。Battle等也报道Lgr 5和其他正常肠道干细胞基因在人结肠癌细胞中都选择性表达,指出Lgr 5+细胞群是结直肠癌干细胞。Lgr 5在结直肠癌中高表达,与癌症的发生、侵润转移以及患者预后密切相关[10],表明其参与了结直肠癌的发生与发展。研究证实,Lgr 5蛋白高表达促进了肿瘤细胞增殖及转移,可能是通过提高结直肠肿瘤干细胞自我更新能力,加速了肿瘤细胞的增殖和未分化程度,肿瘤干细胞亚群增多使肿瘤细胞对化疗及放疗的抵抗能力增强,降低了患者对肿瘤治疗方式的敏感性,从而导致了肿瘤的复发以及治疗失败等[11]。因此,Lgr 5可作为结直肠癌治疗的潜在靶点。
大量的证据表明,服用阿司匹林或其他NSAIDs可以减少患结直肠癌的危险、改善结直肠癌患者的预后以及降低术后复发率等。Jacobs等[12]研究也发现每日服用阿司匹林可使其癌症死亡风险降低16%。然而其对肿瘤干细胞的作用机制尚不清楚,对肿瘤干细胞标志物Lgr 5有何影响,Lgr 5与COX-2之间又有何联系,都有待进一步研究。本研究结果显示,随着阿司匹林浓度的增加,结肠癌细胞株HT-29和SW480中Lgr 5蛋白的表达呈明显的下降趋势,并具有良好的量-效关系,差异有统计学意义(P<0.05)。这表明阿司匹林可能是通过降低Lgr 5的表达而抑制肿瘤干细胞,从而达到防治结直肠癌的作用。通过对遗传性及散发性结直肠癌患者的研究表明阿司匹林等NSAIDs可能干预癌症发生的初始步骤,如抑制Wnt/βcatenin信号通路[13]。COX促进PGE2的生成而抑制β-catenin降解,导致Wnt/β-catenin信号通路活化,促进Wnt通路靶基因Lgr 5的转录。Lgr受体与R脊柱蛋白密切结合,即使是在少量Wnt信号刺激时也能够显著增强Wnt的信号作用[14],进而参与肿瘤的发生。因此,抑制COX的表达是NSAIDs 抗 肿 瘤 的 重 要 因 素[15],阿 司 匹 林 等NSAIDs可以减弱β-catenin/TCF敏感基因(如Lgr 5)的转录,并成量效关系[13],这与本实验研究结果相一致。
NSAIDs可以抑制COX-2表达,阻断结直肠癌细胞增殖,同时选择性COX-2抑制剂塞来昔布通过诱导TCFs降解而阻碍Wnt/β-catenin信号通路,从而抑制结肠癌细胞株,但此作用却不依赖COX -2[16,17],故 NSAIDs 拮抗肿瘤的作用机制并不只局限于COX-2。本实验结果亦显示COX-2高表达的HT-29、COX-2阴性表达的SW480两种细胞的组间相比均无显著性差异(P>0.05),进一步表明阿司匹林抗大肠肿瘤的机制可能涉及到COX-2途径和非 COX-2途径。Lev-Ari等[4]通过塞来昔布联合姜黄素对结肠癌细胞株增殖的研究,以及王春晖等通过选择性及非选择性COX-2抑制剂对结肠癌细胞生长的影响的研究,均同样表明上述观点。NSAIDs对结肠癌的预防作用主要通过非COX-2依赖途径[18],其作用机制可能与肿瘤细胞内多种信号转导通路密切相关。非COX-2依赖性途径的作用机制是近期研究的重点,希望借此能找到新药研究的靶位。Benamouzig等[19]研究也表明阿司匹林可降低COX-2低表达的结肠腺瘤的术后复发率,而对COX-2高表达者无作用。NSAIDs能抑制如HCT116和SW480等COX-2阴性表达的结直肠癌细胞株的生长。阿司匹林诱导COX-2阴性表达的SW480细胞凋亡的一潜在机制可能是通过下调Bcl-2和上调Bax的表达来实现的[20]。此外,有关于NSAIDs在治疗其他疾病中主要以非COX-2途径发挥作用的证据越来越多,例如,Celecoxib以非COX-2依赖途径拮抗顺铂抗胃癌细胞的活性,COX-2抑制剂通过非COX依赖性途径对抗心肌氧化损伤以及COX-2抑制剂NS398通过COX-2非依赖途径诱导胰腺癌细胞BxPC-3细胞凋亡等。
综上所述,本研究结果表明阿司匹林可能通过COX-2途径和非COX-2途径,并且以非COX-2途径为主,减少结直肠癌干细胞标志物Lgr 5蛋白的表达而抑制肿瘤干细胞,从而起到防治结直肠癌的作用,为NSAIDs阿司匹林临床预防结直肠癌提供了相关实验依据。然而关于非COX-2途径涉及的具体作用机制还有待进一步的研究。
[1]Ruffner H,Sprunger J,Charlat O,et al.R - Spondin Potentiates Wnt/β-catenin Signaling through Orphan Receptors LGR4 and Lgr 5[J].PLoS ONE,2012,7(7):40976.
[2]Uchida H,Yamazaki K,Fukuma M,et al.Overexpression of leucine-rich repeat-containing G protein-coupled receptor 5 in colorectal cancer[J].Cancer science,2010,101(7):1731-1737.
[3]Fernández Calderón M,Betés Ibá ez M.Aspirin in the primary prevention of colorectal cancer[J].Anales del sistema sanitario de Navarra,2012,35(2):261-267.
[4]Lev - Ari S,Strier L,Kazanov D,et al.Celecoxib and curcumin synergistically inhibit the growth of colorectal cancer cells[J].Clin Cancer Res,2005,11(18):6738 -6744.
[5]Karlic H,Herrmann H,Schulenburg A,et al.Tumor stem cell research-basis and challenge for diagnosis and therapy[J].Wiener klinische Wochenschrift,2010,122(13-14):346-423.
[6]Leushacke M,Barker N.Lgr 5 and Lgr6 as markers to study adult stem cell roles in self-renewal and cancer[J].Oncogene,2012 ,31(25):3009 -3022.
[7]WalkerF,ZhangH -H,OdorizziA,et al.Lgr 5 Is a Negative Regulator of Tumourigenicity,Antagonizes Wnt Signalling and Regulates Cell Adhesionin Colorectal Cancer Cell Lines[J].PLoSONE,2011,6(7):e22733.
[8]Barker N,Huch M,Kujala P,et al.Lgr 5(+ve)stem cells drive self-renewal in the stomach and build longlived gastric units in vitro[J].Cell Stem Cell,2010,6(1):25-36.
[9]Barker N,Ridgway R A,van Es J H,et al.Crypt stem cells as the cells - of- origin of intestinal cancer[J].Nature,2009,457(7229):608-611.
[10]Merlos- Suárez A,Barriga F M,Jung P,et al.The intestinal stem cell signature identifies colorectal cancer stem cells and predicts disease relapse[J].Cell stem cell,2011,8(5):511 -524.
[11]彭亮,梁纯,梁燕,等.结直肠癌Lgr 5表达对患者预后的影响[J].现代消化及介入诊疗,2010,15(5):284 -287.
[12]Jacobs EJ,Newton C C,Gapstur S M,et al.Daily Aspirin Use and Cancer Mortality in a Large US Cohort[J].J Natl Cancer Inst,2012,104(16):1208 -1217.
[13]Dihlmann S,Siermann A,von Knebel Doeberitz M.The nonsteroidal anti-inflammatory drugs aspirin and indomethacin attenuate beta- catenin/TCF -4 signaling[J].Oncogene,2001,20(5):645 -653.
[14]de Lau W,Barker N,Low T Y,et al.Lgr 5 homologues associate with Wnt receptors and mediate R-spondin signalling[J].Nature,2011,476(7360):293 -297.
[15]Takahashi- Yanaga F,Kahn M.Targeting Wnt signaling:can we safely eradicate cancer stem cells?[J].Clin Cancer Re,2010,16(12):3153-3162.
[16]Sakoguchi-Okada N,Takahashi-Yanaga F,Fukada K,et al.Celecoxib inhibits the expression of survivin via the suppression of promoter activity in human colon cancer cells[J].Biochemical pharmacology,2007,73(9):1318 -1329.
[17]Takahashi- Yanaga F,Yoshihara T,Jingushi K,et al.Celecoxib-induced degradation of T-cell factors-1 and -4 in human colon cancer cells[J].Biochemical and biophysical research communications,2008,377(4):1185-90.
[18]Nath N,Vassell R,Chattopadhyay M,et al.Nitro-aspirin inhibits MCF-7 breast cancer cell growth:effects on COX-2 expression and Wnt/beta-catenin/TCF-4 signaling[J].Biochemical pharmacology,2009,78(10):1298-1304.
[19]Benamouzig R,Uzzan B,Martin A,et al.Cyclooxygenase-2 expression and recurrence of colorectal adenomas:effect of aspirin chemoprevention[J].Gut,2010,59(5):622-629.
[20]Lai M Y,Huang J A,Liang ZH,et al.Mechanisms underlying aspirin-mediated growth inhibition and apoptosis induction of cyclooxygenase-2 negative colon cancer cell line SW480[J].World J Gastroenterol,2008,14(26):4227-4233.
