孕期低强度游泳运动对哺乳期过度喂养子代肥胖大鼠下丘脑弓状核食欲相关基因表达的影响
2012-12-03何玉秀牛凌坤金凤霞
高 峰,何玉秀,郝 强,牛凌坤,金凤霞
“编程作用假说(Programming Hypothesis)”认为,在生长发育的关键期如胚胎期,发育环境的波动会对子代在基因、细胞和组织的功能和结构上产生编程性的影响[16]。López M.研究发现,哺乳期减少母鼠喂养仔鼠数目可对子代过度喂养肥胖大鼠(the overfed rat,OF大鼠)下丘脑摄食调控中枢产生可塑性的作用,OF大鼠断乳后持续保持超重/肥胖表型[15]。OF大鼠是研究哺乳期过度营养诱发子代体重编程作用的经典模型,研究显示,OF大鼠下丘脑摄食和能量调控异常、胰岛素抵抗和瘦素抵抗是OF大鼠持久 表 现 为 超 重 和 肥 胖 的 关 键[9,10,18]。
毋庸置疑,孕期运动有改善子代脑功能、增加学习记忆能力,提高中枢神经兴奋性、增加能量消耗、改善insulin敏感性等对维持和改善机体健康水平的诸多益处[1,14]。“中枢摄食和能量稳态调控系统”是孕期母体和子代的营养分配、子鼠哺乳期营养和子鼠体重表型相互作用和相互联系的重要枢纽。而啮齿类在出生后3周下丘脑摄食调控中枢才发育完全,从孕中期到哺乳期结束其下丘脑摄食中枢具有很强的可塑性[7]。那么,孕期游泳运动是否会通过改善母亲胎盘机能,进而对子代下丘脑摄食调控中枢发育产生怎样的影响?据此,本研究从神经内分泌的角度,探究了孕期低强度游泳运动对断乳后OF大鼠下丘脑弓状核食欲相关肽基因表达的影响。
1 材料与方法
1.1 材料
1.1.1 实验动物与分组
饲养条件:SD纯系大鼠,雌性大鼠80只(275±5g),雄鼠20只(350±5g),购自河北省动物实验中心;室温23℃±2℃,湿度50%±5%,控制光周期,标准饲料饲养。
母鼠 孕 期 运 动 方 案:10min/d,6d/week[14]。 游 泳 设备为150cm×50cm×90cm游泳池,水温34℃±2℃;母鼠分娩后次日,选取每窝产仔数目10~13只的母鼠及其仔鼠,其余剔除。
OF大鼠模型复制:生殖突与肛门间距离甄别性别,调整每窝喂养仔鼠数目,过度喂养为每窝4只雌鼠和正常喂养为每窝10只雌鼠,直至哺乳期21天后断乳[11,12]。模型判定标准为:体重、Lee指数和胰岛素水平显著高于正常喂养组[9]。
子代大鼠实验分组:断乳后按体重配比随机抽取获得实验分组。孕期安静+哺乳期正常喂养模型对照组(CNC1,n=8)、孕期安静+哺乳期过度喂养断乳后OF对照组(CSC1,n=8)和孕期低强度游泳运动+哺乳期过度喂养断乳后 OF组(ESC1,n=8)。
1.1.2 标本采集
子代大鼠取材流程:1)断乳后次日称重,内眦取血分离血清后-30℃保存;2)灌流液固定取全脑,选取自视交叉至乳头体区域后固定4~6h后,移入70%酒精过夜,次日进入石蜡包埋程序。所有溶液配置均用0.1%DEPC处理,以灭活外源性核酸酶。
1.1.3 主要试剂和设备
NPY、POMC和LRb原位杂交检测试剂盒购自武汉博士德。血糖和血脂采用酶化学法在全自动分析仪上测定,试剂盒分别购于北京利德曼生化技术有限公司和河北长城临床试剂有限公司;血清胰岛素(insulin)和瘦素(leptin)采用放射免疫法测定,试剂盒购于中国原子能科学研究所。胰岛素敏感性评价指标为胰岛素与血糖比(the ratio of insulin to glucose,IGR)=FIN值/血糖值[13]。
1.2 材料
1.2.1 原位杂交检测和分析
所有溶液用DEPC水配制,原位杂交程序参照试剂盒(武汉博士德)说明进行。1)脑冠状切片:从弓状核的吻部至尾部分段切片(每20张取1张),切片厚度5μm,捞片于经多聚赖氨酸附膜的载玻片,60℃拷片6h。2)脱蜡至水后,暴露mRNA核酸片段:滴加3%柠檬酸新鲜稀释的胃蛋白酶,37℃消化10min;0.5MPBS洗3次×5min,蒸馏水洗1次。3)预杂交:湿盒内每张切片加预杂交液20μl,恒温箱40℃12h,弃多余液体,不洗。4)杂交:滴加杂交液,恒温箱42℃杂交过夜。阴性对照组在杂交时以不含探针的杂交液进行杂交,其余步骤相同;杂交后洗涤,滴加封闭液,37℃30min,甩去多余液体,不洗。5)杂交后洗涤,滴加生物素化鼠抗地高辛:37℃30min,原位杂交专用PBS洗5min×4次。6)滴加SABC:37℃30min,甩去多余液体,不洗;滴加生物素化过氧化物酶,37℃30min,0.5MPBS洗3次×5min。7)DAB显色和封片:DAB显色5min,苏木素复染细胞核1min,1%盐酸酒精分色,1%氨水反蓝,梯度乙醇脱水,二甲苯透明,中性树脂封片。
阳性表达判断标准:切片背景为浅蓝色或无色,以神经元的胞体呈现浅黄、棕黄、棕褐色均为阳性表达。每只大鼠取3张切片,每张切片取高倍镜(10×40)下4个视野,通过Olympus DP70数码相机拍摄后以JEP文件形式将图片输入计算机。采用IPP 6.0(Image-Pro Plus v6.0)图像采集分析系统,对所采集图像进行积分光密度分析。
1.2.2 统计学处理
2 实验结果
2.1 孕期低强度游泳运动对OF大鼠体重和血清指标的影响
图1和图2显示,CSC1组和ESC1组OF大鼠体重、Lee指数、血糖、胰岛素、IGR、瘦素和总胆固醇(TC)水平均显著高于CNC1组大鼠。ESC1组与CSC1组OF大鼠相比,两组OF大鼠血清代谢指标均无显著性差异(图2)。
2.2 孕期低强度游泳运动对OF大鼠ARH内LRbmRNA表达的影响
LRb mRNA原位杂交结果(图3)显示,ESC1组和CSC1组OF大鼠下丘脑ARH内LRb mRNA水平相比无显著性差异(0.43±0.023vs 0.41±0.006,P>0.05),而CNC1大鼠下丘脑ARH内LRb mRNA水平显著高于ESC1组和CSC1组OF大鼠(0.53±0.009vs 0.43±0.023,P<0.01和0.53±0.009vs.0.41±0.006,P<0.01)。

图1 本研究OF大鼠体重和Lee指数的组间比较示意图(n=8,SD)Figure 1. Comparison of Body Weight and Lee Index of Three Groups

图2 本研究OF大鼠血清学指标的组间比较示意图(n=8,SD)Figure 2. Comparison of Serum Parameters of Three Groups

图3 本研究OF大鼠下丘脑弓状核LRbmRNA水平组间比较示意图Figure 3. Comparison of mRNA Expression of LRb in ARH among Groups
2.3 孕期低强度游泳运动对OF大鼠ARH内NPY和POMC的mRNA水平的影响
孕期游泳运动对断乳后ESC1组和CSC1组OF大鼠下丘脑弓状核NPY mRNA表达无显著性影响(P>0.05);孕期安静正常喂养CNC1组下丘脑弓状核NPY mRNA表达显著低于ESC1组和CSC1组OF大鼠(P<0.01和P<0.01;图4)。孕期游泳运动对断乳后ESC1组OF大鼠下丘脑弓状核POMC mRNA表达显著高于孕期安静CSC1对照组OF大鼠(P<0.01);孕期安静正常喂养对照组(CNC1组)在下丘脑弓状核POMC mRNA表达显著低于ESC1组和CSC1组 OF大鼠(P<0.01和P<0.01;图5)。
3 讨论与分析
3.1 孕期低强度游泳运动对断乳后OF大鼠血瘦素和ARH内LRb mRNA表达的影响
新生早期是机体生长发育最快的阶段,机体正处于能量获得和利用最优化阶段。在大鼠和小鼠研究中显示,新生早期均出现血瘦素激增现象,且这一现象是独立于体重的;尽管新生大鼠或小鼠的血瘦素水平呈现激增,但还保持较高的摄食水平[8]。可见,哺乳动物新生早期表现出的“一过性瘦素抵抗现象”是对新生早期机体快速发育的适应性反应。本研究中,哺乳期过度喂养可诱发大鼠体重超重/肥胖、血瘦素和血胰岛素水平升高,而母鼠孕期游泳运动对子代OF大鼠肥胖、血胰岛素和血瘦素敏感性降低没有显著改善效果。相关研究还显示,哺乳期小窝过度喂养可导致OF大鼠在断乳后21天表现出显著肥胖、高瘦素血症、高胰岛素血症和空腹IGR升高并可持续到成年期[10,17,18]。可见,新生早期营养过剩极易诱发“一过性瘦素抵抗现象”发展为“永久性瘦素抵抗”,而孕期低强度游泳运动对断乳后OF大鼠体重编程作用无显著预防效果。

图4 本研究OF大鼠下丘脑弓状核NPY mRNA水平组间比较示意图Figure 4. Comparison of mRNA Expression of NPY in ARH among Groups
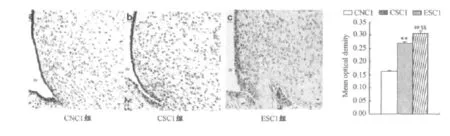
图5 本研究OF大鼠下丘脑弓状核POMC mRNA水平组间比较示意图Figure 5. Comparison of mRNA Expression of POMC in ARH among Groups
瘦素如脑主要通过饱和转运机制跨越血脑屏障进入脑脊液[4,19]。瘦素受体主要有5种亚型,研究显示,瘦素长型受体(LRb)是参与ARH内瘦素信号转导的主要形式[6]。瘦素抵抗是儿童肥胖症代谢异常主要表现[3],但其具体机制尚未完全阐明[20]。本部分实验显示,OF大鼠ARH内LRb mRNA水平显著低于正常喂养对照组大鼠,表明哺乳期过度营养诱发的ARH内瘦素敏感性下降与LRb受体表达降低有关。但也不能排除哺乳期营养过度诱发的瘦素抵抗还可能与血脑屏障饱和转运、受体后信号转导机制异常有关。可见,孕期低强度游泳运动对下丘脑弓状核LRbm RNA表达下降所至瘦素抵抗无显著改善效果,是孕期游泳运动对断乳后OF大鼠体重编程作用无改善效果的潜在中枢机制之一。
3.2 孕期低强度游泳运动对断乳后OF大鼠ARH内NPY和POMC mRNA表达的影响
ARH内POMC/CART和NPY/AgRP神经元是重要的瘦素中枢内作用靶点:当外周血瘦素水平升高,则ARH内参与能量调控的“一级”神经元POMC/CART表达增加,而NPY/AgRP的表达水平降低;同时,位于ARH内参与能量调控的“一级”神经元的轴突进一步将信号传递到下一级神经元(下丘脑腹内侧核、室旁核、背侧核和后侧核),最后在皮层整合以维持体重在调定点范围内[21]。本研究主要针对外周血激素进入中枢的第一靶点——ARH,结果显示,ARH内阳性NPY神经元胞体轮廓较清晰,细胞形态不一,偶可见胞体有短突起。与以往相关OF大鼠体重编程作用中枢机制的研究结果基本一致[15],过度喂养导致OF大鼠ARH内NPY mRNA水平显著高于正常喂养断乳后对照组。这一方面说明,发育期间的过度喂养诱发ARH内NPY mRNA高表达,使OF大鼠食欲亢进,能耗减少,脂肪合成增加,从而导致OF肥胖;另一方面,由于新生早期瘦素通过中枢能量稳态调控通路实现抑制摄食和增加能量消耗的能量平衡负调节网络尚未发育完全[7],ARH内LRb mRNA水平下降使瘦素对NPY神经元的反馈调节受阻,进而又引发NPY抵抗,NPY抵抗与肥胖程度正相关,即肥胖程度越大,NPY抵抗越明显。
本研究还发现,OF大鼠下丘脑弓状核内NPY和POMC mRNA表达均显著高于正常喂养对照组。大鼠新生早期神经肽发育的研究显示,促进食欲和合成代谢的神经肽是优先表达的,抑制食欲促进分解代谢的神经肽滞后表达,这一时序性特点是保证机体早期成长发育所必需的[2]。说明早期过度营养造成OF大鼠体重编程作用,与大鼠NPY系统和POMC系统发育的时序性特点有关;同时,对照组OF大鼠ARH内POMC mRNA表达没有随NPY mRNA表达升高而降低,也说明下丘脑食欲和能量系统中还存在对早期过度喂养的保护性反应。
本实验进一步探究孕期低强度游泳运动对哺乳期小窝喂养OF大鼠ARH内NPY和POMC mRNA的影响,发现孕期低强度游泳运动可使OF大鼠ARH内POMC mRNA水平升高,而对NPY mRNA水平没有显著影响。可见,孕期低强度游泳运动对OF大鼠体重编程作用预防效果虽不显著,但是,孕期低强度游泳运动有提高OF大鼠ARH内POMC mRNA表达水平的作用,说明孕期低强度游泳运动有显著增加机体对摄食过度保护性反应的作用。究其原因,本研究采用孕期低强度游泳运动方式,主要目的是通过有规律的身体锻炼增加孕鼠体力活动水平,改善或缓解由于妊娠所致的血糖生理性升高的致胰岛素抵抗的内环境。本研究还发现,该孕期低强度游泳运动方案对新生仔鼠体重没有显著影响。综上可知,低强度游泳运动没有对宫内胚胎发育产生营养胁迫;从预见性适应反应假说分析,孕期母鼠营养均衡并辅助以有规律的低强度身体锻炼,会对胎鼠的代谢和能量调控系统产生与营养供应充足相适应的应答反应,当后续营养环境与预测一致或错配差异不十分显著时,则早期的应答是有利于机体保持正常的代谢和能量调控系统稳态;孕期低强度游泳运动可能起到增强胎盘机能,优化宫内胎儿发育的激素环境和血液营养供应效果,但尚需要进一步研究以提供有力的证据支持。
4 小结
围产期(孕期和哺乳期)是子代中枢摄食和能量稳态调控发育的可塑期,哺乳期过度喂养可对OF大鼠ARH内食欲相关肽的表达产生可塑性影响,而孕期低强度游泳运动增加OF大鼠下ARH内POMC mRNA水平,显示孕期低强度游泳运动具有对早期过度喂养诱导肥胖的潜在性保护作用。但是,孕期低强度游泳运动对子代中枢摄食和能量稳态调控发育作用的“子宫内机制”有待进一步的研究,以为孕期游泳运动促进子代中枢摄食和能量稳态调控网络发育提供更有力支持。
[1]高峰,牛凌坤,冯鹏,等.孕期低强度游泳运动对哺乳期过度喂养子代肥胖大鼠生长发育和糖脂代谢的影响[J].中国运动医学杂志,2010,29 (6):677-682.
[2]华天懿.中枢神经多肽orexin、NPY、POMC及外周leptin在单纯性肥胖发生机制中的作用[D].中国医科大学博士学位论文,2006.
[3]AKANISHI T,U R,LIU Z J,et al.Sexual dimorphism um leptin and relative weight for the standard in norm overweight children as well as adolescents[J].Eur J Clin Nutr,2001,55(11):899-993.
[4]BANKS W A,KASTIN A J,HUANG W,et al.Leptin enters the brain by a saturable system independent of insulin[J].Peptides,1996,17(2):305-311.
[5]BERMARDIS L L,PATTERSON D B.Correlation between“Lee Index”and carcassfat content in weanling andadult female rats with hypothalamic lesions[J].J Endocrinal,1988,40:527.
[6]BOURET S G,BATES S H,CHEN S,et al.Distinct Roles for specific Leptin receptor signals in the development of hypothalamic Feeding Circuits[J].J Neurosci,2012,32(4):1244-1252.
[7]BOURET S G,DRAPER S J,SIMERLY R B.Formation of projection pathways from the arcuate nucleus of the hypothalamus to hypothalamic regions implicated in the neural control of feeding behavior in mice[J].J Neurosci,2004,24(11):2797-2805.
[8]BOURET S G,SIMERLY R B.Development of leptin-sensitive circuits[J].J Neuroendocrinol,2007,19(8):575-582.
[9]CRYER A,JONES H M.The development of white adipose tissue.Effect of litter size on the lipoprotein lipase activity of four adipose-tissue depots,serum immunoreactive insulin and tissue cellularity during the first year of life in male and female rats[J].Biochem J,1980,186(3):805-815.
[10]DAVIDOWA H,LI Y,PLAGEMANN A.Altered responses to orexigenic(AGRP,MCH)and anorexigenic (alpha-MSH,CART)neuropeptides of paraventricular hypothalamic neurons in early postnatally overfed rats[J].Eur J Neurosci,2003,18:613-621.
[11]EPSTEIN H T.The effect of litter size on weight gain in mice[J].J Nutr,1978,(1):120-123.
[12]FAUST I M,JOHNSON P R,HIRSCH J.Long-term effects of early nutritional experience on the development of obesity in the rat[J].J Nutr,1980,110(10):2027-2034.
[13]FUENMAYOR N T,MOREIRA E,DE LOS R V,et al.Relations Between Fasting Serum Insulin,Glucose,and Dihydroepiandrosterone-Sulfate Concentrations in Obese Patients with Hypertension:Short-Term Effects of Antihypertensive Drugs[J].J Cardiovasc Pharm,1997,30(4):523-527.
[14]HEE-HYUK L,HONG K,JIN-WOO L,et al.Maternal swimming during pregnancy enhances short-term and neurogenesis in the hippocampus of rat pups[J].Brai Deve,2006,28(3):147-154.
[15]LOPEZ M,SEOANE L M,TOVAR S,et al.A possible role of neuropeptide Y,agouti-related protein and leptin receptor isoforms in hypothalamic programming by perinatal feeding in the rat[J].Diabetologia,2005,48(1):140-148.
[16]LUCAS A.Programming by early nutrition in man[A].In:The children environment and adult disease.CIBA Found Symp[C].UK:Chichester Wiley,1991:38-55.
[17]MORTON G J,CUMMINGS D E,BASKIN D G,et al.Central nervous system control of food intake and body weight[J].Nature,2006,443(7109):289-295.
[18]PLAGEMAN A,HARDER T,RAKE A,et al.Increased number of galanin neurons in the paraventricular hypothalamic nucleus of neonatally overfed weanling rats[J].Brain Res,1999,818(1):160-163.
[19]UNGER R H.The physiology of cellular liporegulation [J].Annu Rev Physiol,2003,65(3):333-347.
[20]SINGHAL A,FAROOQI I S O,RAHILLY S,et al.Early nutrition and leptin concentrations in later life[J].Am J Clin Nutr,2002,75(6):993-999.
[21]SZEKELY M,SZELENYI Z.Regulation of energy balance by peptides:A Review [J].Current Protein Peptide Sci,2005,27(6):327-353.
