利用超额拉曼光谱研究硝酸镁水溶液中的离子对
2012-11-30王陈琛胡乃银周晓国刘世林
王陈琛 林 珂 胡乃银 周晓国 刘世林
(中国科学技术大学化学物理系,合肥微尺度物质科学国家实验室(筹),合肥230026)
利用超额拉曼光谱研究硝酸镁水溶液中的离子对
王陈琛 林 珂 胡乃银 周晓国 刘世林*
(中国科学技术大学化学物理系,合肥微尺度物质科学国家实验室(筹),合肥230026)
利用超额拉曼光谱研究了室温下硝酸镁(Mg(NO3)2)溶液的离子缔合情况.测量了该溶液羟基(-OH)伸缩振动谱段和NO-3全对称伸缩振动谱段的拉曼光谱,利用超额拉曼光谱及光谱拟合分析了这些光谱数据.-OH伸缩振动谱段的超额拉曼光谱显示,低浓度(<2.3 mol·kg-1)下阴离子第一水合层的水分子含量随溶液浓度的升高呈线性关系增加,在较高浓度时(>2.3 mol·kg-1),该含量变化偏离了线性关系,这是因为Mg(NO3)2溶液在高浓度时存在直接接触离子对导致的.同样的转折点浓度也在对NO-3全对称伸缩振动谱段的分析中被观测到.除了直接接触离子对,还观测到三种溶剂分隔型离子对.对该谱段下所有浓度的拉曼光谱和超额光谱进行同时拟合,给出了不同浓度下各种离子对的相对含量,结果显示在0.23-4.86 mol·kg-1浓度范围内都有溶剂分隔型离子对和直接接触型离子对.当Mg(NO3)2浓度低于2.3 mol·kg-1时,所有离子对的相对含量随浓度增加呈现直线上升,在高于这个浓度后直接接触离子对的相对含量急剧增加,一种溶剂分隔型离子对的相对含量增加变缓,另一种溶剂分隔型离子对的相对含量逐渐减少,还有一种溶剂分隔型离子对相对含量的增加趋势保持不变,在Mg(NO3)2浓度大于3.5 mol·kg-1后,其相对含量不再发生明显变化.
硝酸镁水溶液;直接接触离子对;溶剂分隔离子对;超额拉曼光谱;同时拟合
1 引言
盐溶液的电导率、粘度等宏观性质决定了盐溶液中离子-溶剂相互作用及离子间的缔合作用.1-4自Eigen和Tamm5,6提出的离子缔合平衡、盐水溶液及非水介质电解液中离子溶剂化效应及离子缔合作用一直受到人们的广泛关注.7-13针对这些相互作用的研究有助于理解溶液的宏观性质,也有利于电池电解液的合理选择及其在电容器中的应用.14除此之外,溶液中离子溶剂化及离子缔合过程在生物化学、环境化学、地球化学等领域也具有重要的作用.15
硝酸盐水溶液是一种常用的盐溶液,硝酸根(NO-3)和镁离子(Mg2+)都是著名的Hofmeister序列中的离子,Mg2+普遍存在于海水、人体细胞及叶绿素中.前人利用各种实验和理论方法对硝酸镁(Mg(NO3)2)水溶液的微观结构做了大量的研究.但是到目前为止,对其微观结构,尤其是对离子缔合结构的认识还存在分歧.一部分工作提出Mg(NO3)2溶液中没有各种离子缔合物,例如Robinson等16根据蒸汽压实验计算得到活度系数,推断浓度小于2.197 mol·kg-1的Mg(NO3)2水溶液是完全解离的; Vollmar17利用拉曼光谱提出浓度低于3.85 mol·L-1的Mg(NO3)2水溶液中无法形成接触离子对(CIP), Chang和Irish18的拉曼光谱研究工作也支持此结论;利用X射线衍射(XRD),Bol19和Caminiti20等在浓度为1.0、2.0和4.0 mol·L-1的Mg(NO3)2水溶液中也没有观察到离子聚合物;最近Xu等15通过对Mg2+-OH2伸缩振动的拉曼光谱分析,认为浓度为2.8 mol· L-1的Mg(NO3)2水溶液中没有CIP.但是也有一部分工作给出相反的结论.例如Righellato和Davies21通过测量电导率指出稀释的Mg(NO3)2水溶液中存在少量聚合物;Chang和Irish18利用拉曼光谱提出浓度大于2.5 mol·L-1的Mg(NO3)2水溶液存在溶剂共享离子对;James等22利用傅里叶变换及谱峰拟合对Mg(NO3)2水溶液进行研究,发现浓度为0.5 mol·L-1时就有溶剂分隔离子对(SSIP),CIP则在浓度高于2 mol·L-1时就大量存在.
除了对室温下Mg(NO3)2水溶液的研究,还有大量的工作探讨了其它条件下Mg(NO3)2水溶液的离子缔合作用,发现在一些特殊条件下Mg(NO3)2水溶液较容易形成离子对.例如Peleg23发现高温下浓度小于2.76 mol·kg-1时,阴阳离子完全水合,互不影响,但是浓度高于9.19 mol·kg-1时出现CIP甚至发生结构重排.Chang和Irish18着重对高温时浓度大于9.19 mol·kg-1的Mg(NO3)2溶液进行了分析,根据谱峰分解,认为存在单齿接触离子对(MCP)和双齿接触离子对(BCP).除此之外,Zhang3和Li24等利用拉曼光谱研究Mg(NO3)2气溶胶时也支持他们的结论,认为当浓度高于9.19 mol·kg-1时可以形成CIP.而Zhao等25利用O-H伸缩振动光谱推断浓度大于5.4 mol·kg-1时或许就已经出现CIP.
除了这些实验工作,也有各种理论工作对Mg(NO3)2水溶液的离子缔合结构进行探讨.Zhang等3通过量子化学计算给出了CIP的优化构型,发现MCP的ν1模式振动频率要高于自由离子而BCP的振动频率则要低些.Zhang和Zhang26利用不同的计算方法同样优化了各种离子对及多离子团簇构型,提出了新的离子缔合机制:Mg(NO3)2水溶液中的离子对在继SSIP之后未直接形成CIP,而是形成了溶剂共享型三离子或多离子团簇,当浓度高于9.19 mol·kg-1时出现接触型多离子团簇.Ramesh等27还利用分子动力学模拟分析了离子-溶剂相互作用及阴阳离子间作用对NO-3离子对称性的破坏.
拉曼光谱是研究溶液微观结构的一种常用技术,其数据处理方法通常是光谱拟合,但是对于重叠非常严重的光谱,拟合很不准确,尤其是重叠谱峰中的某些成分很少时,拟合结果更不准确.例如盐水溶液中的自由离子和离子对的光谱重叠非常严重,且在较低浓度时自由离子占主导,所以很难通过直接拟合盐水溶液中的拉曼光谱给出离子对准确的含量.与光谱拟合不同,Yu及其合作者28-30依据超额函数思想提出超额红外光谱的概念来分析其红外光谱,发现超额光谱具有很多优点,例如利用它可以较准确地发现溶液中一些含量较少的物质,同时也可以提高光谱的分辨率、评价体系的非理想性以及用于研究选择性分子间相互作用.在此基础上,我们发展了超额拉曼光谱,31即实际测量所得的拉曼光谱与把混合物当作理想混合时应该具有的理想拉曼光谱的差别(Iexcess(ν)=Iexp(ν)-Iideal(ν)),借助超额拉曼光谱研究了盐对甲醇微观结构的影响,给出了稀溶液中离子第一溶剂层中甲醇分子的数目,我们的结果也显示了超额拉曼光谱具有研究极少量物质的优势.这里我们将利用之前发展的超额光谱31来研究Mg(NO3)2水溶液的微观结构,提高确认离子缔合物的可靠性.通过对水的O-H伸缩谱段和NO-3全对称伸缩谱段的分析,给出了所有离子对相对含量随浓度的变化关系.发现在很稀浓度(0.23 mol·kg-1)的Mg(NO3)2水溶液中就存在CIP和各种SSIP,在浓度大于2.3 mol·kg-1后CIP相对含量急剧增加,同时我们给出了不同形式离子对的NO-3全对称伸缩振动的谱峰位置.
2 实验方法
Mg(NO3)2·6H2O(>99.0%,国药集团化学试剂有限公司),没有进一步纯化直接使用.水经过二次蒸馏后除去离子(18.2 MΩ·cm),体系浓度由极稀配至近饱和(0.23-4.86 mol·kg-1),浓度间隔约为0.6 mol· kg-1.
实验装置类似于我们之前的工作.31-36采用背向散射配置采集拉曼光谱.半导体固体激光器产生的激光(波长为532 nm)首先经格兰棱镜纯化偏振方向,然后由石英透镜(F=1)聚焦于比色皿(1 cm×1 cm,宜兴晶科)中的溶液,激光功率到达样品时约为2.2 W.拉曼散射光由同一个石英透镜收集,再由另一个石英透镜(F=4)聚焦,之后经另一个格兰棱镜使其偏振方向平行于入射激光偏振方向,再由退偏器消偏后进入三级联动单色仪,最后由液氮冷却的CCD(Princeton Instruments,Acton TriplePro,Spec-10: 100B)记录光谱数据.使用恒温槽保持样品温度在27.0°C(±0.1°C).我们测量了NO-3的全对称伸缩振动谱段和OH伸缩振动谱段的拉曼光谱.利用汞灯标准线校准拉曼光谱位移.使用Igor Pro软件处理实验数据.
3 结果与讨论
3.1 O-H伸缩振动的拉曼光谱和超额光谱
盐溶解于水中将会影响水的O-H伸缩振动,所以首先测量了O-H伸缩振动区间的拉曼光谱.图1(a)给出了纯水和不同浓度Mg(NO3)2水溶液的O-H伸缩谱段拉曼光谱.由图1(a)可以明显看出随着盐浓度的增加,在较低波数处的拉曼光谱强度逐渐降低,而在较高波数处的拉曼光谱强度逐渐增高,这是由于盐的加入破坏了水的微观结构.
我们的目的是研究溶液中的离子对,所以认为理想混合溶液中阴阳离子之间完全没有相互作用(即自由离子),此时的理想光谱可以由自由离子和纯水的光谱线性叠加获取(Iideal(ν)=Asalt×Ifree(ν)+AH2O× IH2O(ν)),其中的比例系数很容易由相应的物质的量之比计算得到,即Asalt=nsalt/nfree和AH2O=nH2O/npure,H2O.
在该振动区间内没有自由离子的光谱,所以实验光谱按特定系数扣除纯水拉曼光谱即为超额拉曼光谱,如图1(b)所示.超额拉曼光谱中出现了正峰和负峰,其中负峰表示减少的体相水,随着盐溶液浓度的升高,更多的体相水结构遭到破坏,表现为随着盐浓度的增大超额光谱中的负峰积分面积增大.超额拉曼光谱中的正峰表示相对理想体系新增加的成分,即与离子相互作用的水分子,其强度随着浓度升高而增强.
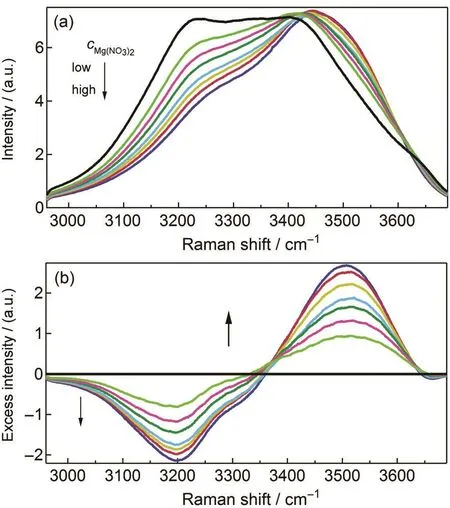
图1 Mg(NO3)2水溶液在各浓度下的O-H伸缩谱段拉曼光谱(a)和相应的超额拉曼光谱(b)Fig.1 Raman spectra(a)and corresponding excess Raman spectra(b)of aqueous Mg(NO3)2solution at various concentrationscMg(NO3)2/(mol·kg-1): 0.00, 1.11, 1.71, 2.30, 2.93, 3.54, 4.18, 4.83
在之前我们利用O-H伸缩谱段的超额拉曼光谱研究不同离子对甲醇结构的影响时,31观察到在含有同样阴离子不同阳离子的甲醇电解质溶液中,超额拉曼光谱的正峰完全重合,所以将超额拉曼光谱中的正峰归属为受阴离子影响的溶剂分子,而溶剂分子的伸缩振动受阳离子影响较小,其振动频率在负峰区间内.Liu等37利用全反射傅里叶变换差额红外光谱分析Mg(NO3)2水溶液时也支持这个结论.之前大量的研究表明离子仅能明显地影响到第一水合层,例如Omta等38利用飞秒泵浦探测光谱指出阴离子对第一水合外层以外的水结构没有影响; Näslund等39利用X射线吸收光谱和X射线拉曼散射同样指出受阴阳离子影响主要是第一水合外层;我们利用超额拉曼光谱方法在研究甲醇电解质溶液时也肯定了阴阳离子仅影响第一溶剂层.31从而认为Mg(NO3)2水溶液的超额拉曼光谱(图1b)中的正峰表示NO-3第一水合层的水分子.
当Mg(NO3)2浓度增加时,溶液中NO-3第一水合层的水分子总含量也相应地增加,表现为超额光谱中正峰逐渐增强.图2给出了Mg(NO3)2水溶液OH伸缩振动谱段超额光谱的正峰积分强度随溶液浓度变化的情况.由图中可以看出,随着浓度的增大,正峰积分强度也随之增大.在较低浓度(<2.3 mol· kg-1)时,该变化呈线性关系,但是在较高浓度时明显偏离了线性关系.在所有的离子对中仅有CIP会缺少第一水合层中的水分子.当溶液中出现大量的CIP时,第一水合层中的水分子便不会再随着离子浓度的增加而增加很多.由此,我们认为在浓度高于2.3 mol·kg-1时Mg(NO3)2水溶液中存在数目可观的CIP.
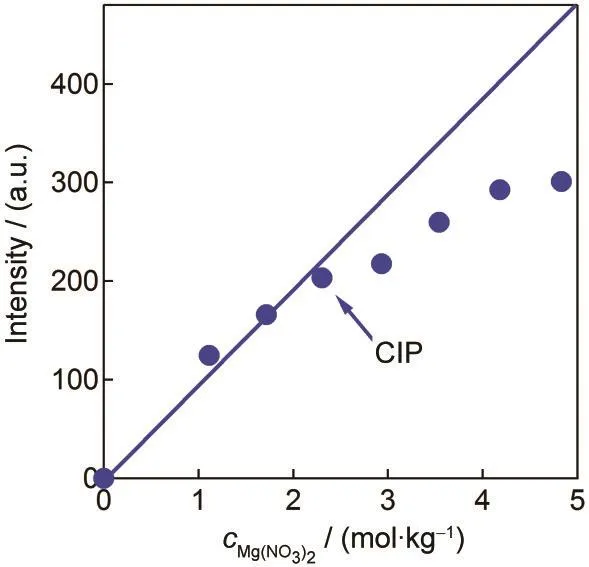
图2 Mg(NO3)2水溶液中O-H伸缩谱段超额光谱的正峰积分强度随浓度的变化情况Fig.2 Concentration dependence of the integrated area of positive peak in the excess Raman spectra of aqueous Mg(NO3)2solution CIP:contact ion pairs
我们的超额拉曼光谱表明,在2.3 mol·kg-1浓度后Mg(NO3)2水溶液会出现较多CIP,这与James等22的结论相类似,他们利用FTIE及谱峰拟合指出,浓度高于1 mol·L-1时的Mg(NO3)2溶液中就存在CIP.但与其它的一些研究结论不一致,例如Chang和Irish18在Mg(NO3)2溶液的振动光谱中没有观测到718 cm-1附近拉曼谱峰的分裂,所以认为不会出现CIP,类似的Xu等15根据718 cm-1谱峰未分裂,再结合Mg2+(-OH)2伸缩振动的拉曼光谱分析,认为浓度为4.9 mol·kg-1的Mg(NO3)2溶液中没有CIP.虽然我们观测到了CIP的证据,但无法判断这个CIP是通常意义的两离子形式的接触离子对,还是最近Zhang和Zhang26提出的多离子形式的接触离子对.
3.2 NO-3全对称伸缩振动拉曼光谱和超额光谱
在NO-3所有拉曼振动谱峰中,全对称伸缩振动谱峰的强度最强,这里我们测量了不同Mg(NO3)2浓度下NO-3全对称伸缩振动谱段的拉曼光谱(图3).如图3所示,Mg(NO3)2溶液浓度增大时,NO-3全对称伸缩振动谱峰强度也随之增强.更为重要的是,随着浓度增加,谱峰的位置蓝移,宽度增大.我们认为溶液中离子存在形式不发生变化的话,谱峰的位置、宽度都不应当发生变化.这里观测到的变化应当归结为在较高浓度时出现的各种离子对.对谱峰的频移,前人开展了大量的讨论.例如Zhang3和Peleg23等在研究了各状态下的Mg(NO3)2溶液时,提出在高浓度时Mg2+与NO-3的氧原子相互作用,导致NO-3全对称伸缩振动谱峰蓝移.与之不同的是,Xu等15认为谱峰的移动方向决定于两个作用力的竞争,一个是阳离子与NO-3的强相互作用,它削弱了N-O键强度,从而会引起谱峰的红移;另一个是阳离子破坏NO-3与水分子间的氢键,会使NO-3全对称伸缩振动谱峰蓝移.虽然对谱峰移动的具体原因有所争议,但都认为是离子对的形成改变了谱峰位置和宽度. James等22利用FTIR和光谱成分分析拉曼光谱,提出了Mg(NO3)2溶液中含有三种离子对,并且他们有着固定的振动频率.与James等不同的是,这里我们将使用超额光谱来确定离子对的形式和数目.
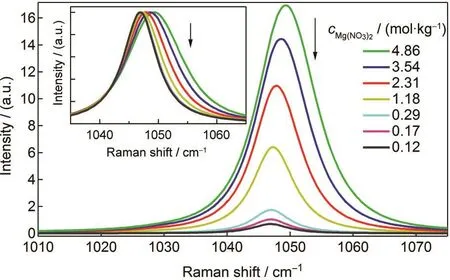
图3 Mg(NO3)2水溶液的NO-3全对称伸缩振动拉曼光谱Fig.3 Raman spectra of NO-3symmetric stretching modes at various concentrations of aqueous Mg(NO3)2solution Inset spectra are the normalized Raman spectra according the height of the Raman peak.Limited spectra are shown here for clarity.
在计算超额拉曼光谱时需要知道自由离子的拉曼光谱及其相应的浓度.溶液浓度无限稀时, Mg(NO3)2水溶液中的NO-3当然为自由离子.我们测量了浓度为0.12和0.17 mol·kg-1时的NO-3对称伸缩振动拉曼光谱(图3),谱峰强度最大值归一化后,我们发现光谱完全重合,这表明这两个浓度下,溶液中的NO-3都主要是自由离子.我们将浓度为0.17 mol·kg-1的NO-3对称伸缩振动拉曼光谱认为是自由离子光谱.
利用自由离子的光谱,按照超额拉曼光谱的定义,将实验光谱扣除理想光谱后即可得到超额拉曼光谱,见图4.超额拉曼光谱主要呈现一个或两个正峰和一个负峰.其中负峰表示减少的自由NO-3,正峰表示体系相比于理想溶液增加的成分,即离子对.各浓度下的超额拉曼光谱负峰的谱峰位置不随浓度变化,正峰谱峰位置随着浓度发生变化,这表明离子对的形式不止一种.特别的是我们在Mg(NO3)2浓度为0.23 mol·kg-1的超额光谱中观测到两个正峰(图4插图),且它们的谱峰位置处于自由离子的谱峰位置两侧.这类似于Chang和Irish18的拉曼光谱结果,他们认为发生红移的是MCP,发生蓝移的是BCP.Zhang和Zhang26利用量子化学计算优化讨论离子对构型时,发现构型不同的离子对的谱峰位置可以比自由离子的谱峰位置或高或低.
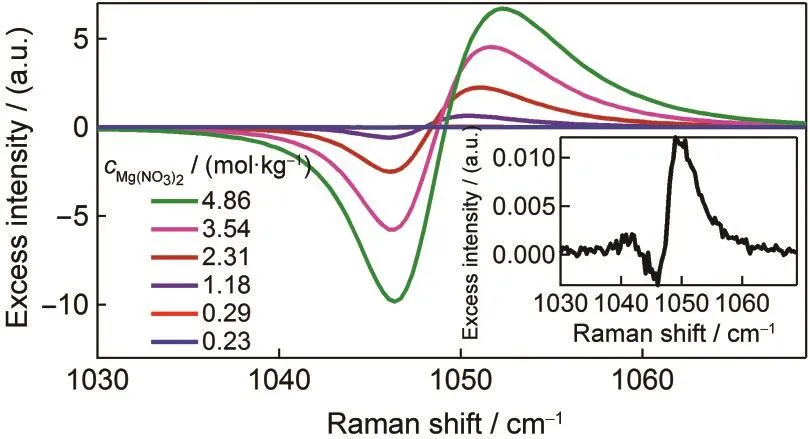
图4 不同浓度Mg(NO3)2水溶液的NO-3全对称伸缩振动区间的超额拉曼光谱Fig.4 Excess Raman spectra of NO-3symmetric stretching mode of aqueous Mg(NO3)2at various concentrationsInsert spectrum is the excess Raman spectrum at the concentration of 0.23 mol·kg-1. Limited spectra are shown here for clarity.
在之前我们研究离子对甲醇结构的影响时,31先通过拟合超额拉曼光谱确定新出现的光谱组分的谱峰位置和半高全宽,再利用这些位置和半高全宽进一步拟合原始的拉曼光谱,这样就可以得到确定的子峰强度信息.与之前不同的是,这里我们将同时拟合所有浓度下的超额光谱和拉曼光谱,使所有浓度下的拟合结果与原始拉曼光谱和超额拉曼光谱的偏差同时达到最小,从而得到更为可信的拟合结果.
图5给出了4.86 mol·kg-1浓度的拟合结果,表明在这个浓度下有5种形式的NO-3,其中谱峰位置在1047.0 cm-1为自由离子,另外4个组分的谱峰位置分别在1043.9、1048.7、1050.9和1054.1 cm-1,应当为各种离子对.
若各形式的NO-3散射截面相同,那么某种NO-3的相对含量可以由谱峰的面积比计算得到,即R=Si/∑Si,其中Si为谱峰的面积.通过计算各浓度下的组分光谱积分强度,我们可以得到各组分相对含量与溶液浓度的关系,见图6.
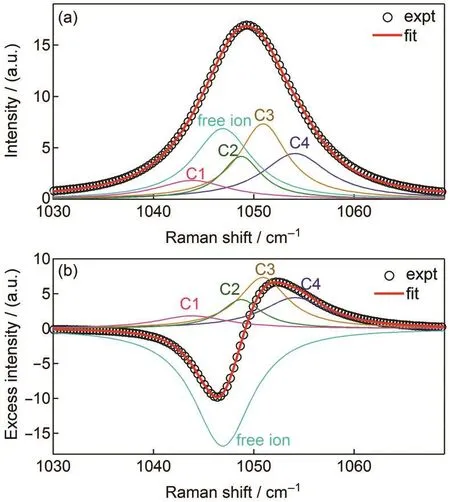
图5 Mg(NO3)2水溶液的NO-3全对称伸缩振动区间的拉曼光谱(a)和超额光谱(b)的谱峰分解Fig.5 Decomposition of Raman spectra(a)and excess Raman spectra(b)of symmetric stretching mode cMg(NO3)2:4.86 mol·kg-1.Global fitting was used to decompose the Raman and excess Raman spectra at all concentrations.
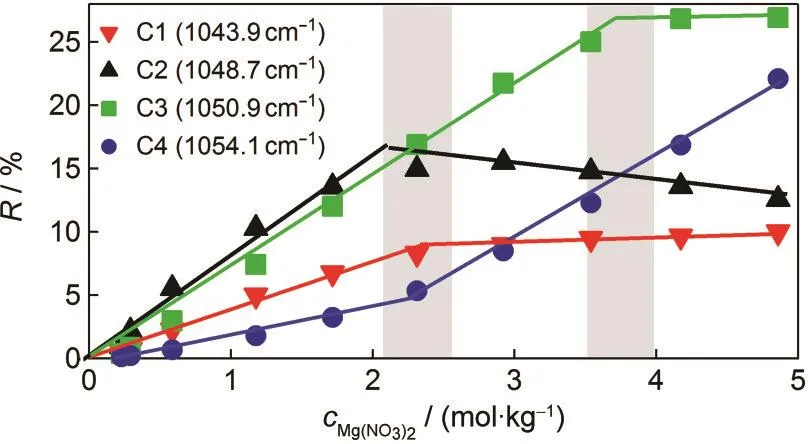
图6 各种离子对的相对含量与溶液浓度的关系Fig.6 Concentration dependence of the relative ratios of various ion pairsR=Si/∑Si,where Siis peak area.
随着Mg(NO3)2浓度的增加,自由离子在逐渐减少,转变为各种离子对.这些离子对在低于2.3 mol· kg-1时随着溶液浓度增大其相对含量线性增多,在这个浓度之后,其中一种离子对(C1)的增加趋势变缓,另外一种离子对(C2)相对含量减少,除此之外还有一种离子对(C4)的相对含量急剧增多.尤为重要的是,这里观测到的浓度转折点和之前在-OH超额拉曼光谱段观测到的浓度转折点(图2)一致,这表明了在2.3 mol·kg-1浓度后急剧增多的离子对C4应当是CIP,其振动频率是所有离子对中最高的,即Zhang3和Peleg23等提出的Mg2+与NO-3的直接相互作用会导致NO-3全对称伸缩振动谱峰蓝移.其它的离子对则为SSIP,在2.3 mol·kg-1浓度后,部分SSIP将转变为CIP.与C1和C2离子对不同的是,另外一种SSIP(C3)的增多要在浓度为3.5 mol·kg-1后才停止,该转折浓度要更大,可能是因为C3离子对中分隔阴阳离子的水分子较C1和C2离子对更少的缘故.我们的结果显示在接近饱和浓度(4.86 mol·kg-1)时, NO-3有72%为离子对,其中50%为各种SSIP,22%为CIP.
我们的拉曼光谱结果显示在较低浓度时就存在各种离子对,甚至CIP,虽然其含量相对较少.这些离子对的含量是逐渐发生变化的,并不是某个浓度后才突然出现一些离子对.这和之前的一些研究相矛盾,之前的研究结果常给出一些特定浓度,他们认为只有高于某些浓度后才可能出现SSIP或者CIP.例如James等22认为CIP出现在浓度大于1.0 mol·L-1的Mg(NO3)2水溶液中;Tomišić和Simeon8利用主成分分析和渐进因子分析方法得到两种拉曼活性成分,与Chang和Irish18的结论一致,认为只有当浓度大于2.5 mol·L-1时才会有SSIP.
4 结论
利用拉曼光谱研究了Mg(NO3)2水溶液中的离子缔合情况.-OH伸缩振动谱段和NO-3对称伸缩振动谱段的拉曼光谱都揭示了Mg(NO3)2水溶液从0.23 mol·kg-1至4.86 mol·kg-1范围内存在所有不同形式的离子,包括自由离子,SSIP和CIP.在所有浓度范围内,自由离子相对含量随着浓度的增高而减少,自由离子转变为各种离子对.其中CIP的相对含量随着浓度的升高而增多,并在浓度大于2.3 mol· kg-1后急剧增多.我们一共观测到三种SSIP,在浓度小于2.3 mol·kg-1范围内,所有SSIP的相对含量随着浓度的升高而增多.在该浓度之后,一种SSIP保持低浓度的增长幅度至3.5 mol·kg-1,另一种SSIP相对含量虽然继续增长,但是增长幅度远小于低浓度,还有一种SSIP的相对含量则出现下降.我们的结果显示拉曼光谱和超额拉曼光谱是研究盐溶液中离子缔合作用很好的方法.
(1) Mahiuddin,S.;Ismail,K.Can.J.Chem.1982,60,2883.
(2) El Guendouzi,M.;Marouani,M.J.Solut.Chem.2003,32,535.
(3)Zhang,Y.H.;Choi,M.Y.;Chan,C.K.J.Phys.Chem.A 2004, 108,1712.
(4)Wahab,A.;Mahiuddin,S.;Hefter,G.;Kunz,W.;Minofar,B.; Jungwirth,P.J.Phys.Chem.B 2005,109,24108.
(5) Eigen,M.;Tamm,K.Z.Elektrochem.1962,66,93.
(6) Eigen,M.;Tamm,K.Z.Elektrochem.1962,66,107.
(7) Martínez,J.M.;Pappalardo,R.R.;Sánchez Marcos,E.J.Am. Chem.Soc.1999,121,3175.
(8)Tomisˇicˇ,V.;Simeon,V.Phys.Chem.Chem.Phys.2000,2,1943.
(9)Mason,P.E.;Neilson,G.W.;Dempsey,C.E.;Barnes,A.C.; Cruickshank,J.M.Proc.Natl.Acad.Sci.U.S.A.2003,100, 4557.
(10) Buchner,R.;Chen,T.;Hefter,G.J.Phys.Chem.B 2004,108, 2365.
(11) Park,S.;Ji,M.;Gaffney,K.J.J.Phys.Chem.B 2010,114,6693.
(12)Bian,H.T.;Wen,X.W.;Li,J.B.;Chen,H.L.;Han,S.;Sun,X. Q.;Song,J.;Zhuang,W.;Zheng,J.R.Proc.Natl.Acad.Sci.U. S.A.2011,108,4737.
(13) Funkner,S.;Niehues,G.;Schmidt,D.A.;Heyden,M.; Schwaab,G.;Callahan,K.M.;Tobias,D.J.;Havenith,M. J.Am.Chem.Soc.2012,134,1030.
(14)Chandrasekaran,R.;Koh,M.;Yamauchi,A.;Ishikawa,M. Z.Elektrochem.2009,77,51.
(15) Xu,M.;Larentzos,J.P.;Roshdy,M.;Criscenti,L.J.;Allen,H. C.Phys.Chem.Chem.Phys.2008,10,4793.
(16) Robinson,R.A.;Wilson,J.M.;Ayling,H.S.J.Am.Chem.Soc. 1942,64,1469.doi:10.1021/ja01258a064
(17) Vollmar,P.J.Chem.Phys.1963,39,2236.doi:10.1063/ 1.1701424
(18) Chang,T.G.;Irish,D.E.J.Phys.Chem.1973,77,52.doi: 10.1021/j100620a011
(19) Bol,W.;Gerrits,G.J.A.;van Panthaleon Eck,C.L.J.Appl. Crystallogr.1970,3,486.doi:10.1107/S0021889870006738
(20) Caminiti,R.;Licheri,G.;Piccaluga,G.;Pinna,G.Chem.Phys. Lett.1979,61,45.doi:10.1016/0009-2614(79)85081-2
(21) Righellato,E.C.;Davies,C.W.Trans.Faraday Soc.1930,26, 592.doi:10.1039/tf9302600592
(22) James,D.W.;Carrick,M.T.;Frost,R.L.J.Raman Spectrosc. 1982,13,115.doi:10.1002/jrs.1250130204
(23) Peleg,M.J.Phys.Chem.1972,76,1019.doi:10.1021/ j100651a013
(24) Li,X.H.;Zhao,L.J.;Dong,J.L.;Xiao,H.S.;Zhang,Y.H. J.Phys.Chem.B 2008,112,5032.doi:10.1021/jp709938x
(25) Zhao,L.J.;Zeng,Q.X.;Zhang,Y.H.J.Phys.Chem.A 2009, 113,215.doi:10.1021/jp8084974
(26)Zhang,H.;Zhang,Y.H.J.Comput.Chem.2010,31,2772.doi: 10.1002/jcc.21570
(27) Ramesh,S.G.;Re,S.;Boisson,J.;Hynes,J.T.J.Phys.Chem.A 2010,114,1255.doi:10.1021/jp903626t
(28)Li,Q.Z.;Wu,G.S.;Yu,Z.W.J.Am.Chem.Soc.2006,128, 1438.doi:10.1021/ja0569149
(29)Li,Q.Z.;Wang,N.N.;Zhou,Q.;Sun,S.Q.;Yu,Z.W.Appl. Spectrosc.2008,62,166.doi:10.1366/000370208783575663
(30) Wang,N.N.;Jia,Q.;Li,Q.Z.;Yu,Z.W.J.Mol.Struct.2008, 883-884,55.
(31)Yu,X.C.;Lin,K.;Hu,N.Y.;Zhou,X.G.;Liu,S.L.Acta Phys.-Chim.Sin.2010,26,2473. [余小春,林 珂,胡乃银,周晓国,刘世林.物理化学学报,2010,26,2473.]doi:10.3866/ PKU.WHXB20100922
(32)Yu,Y.Q.;Lin,K.;Zhou,X.G.;Wang,H.;Liu,S.L.;Ma,X.X. J.Phys.Chem.C 2007,111,8971.10.1021/jp0675781
(33)Yu,Y.Q.;Lin,K.;Zhou,X.G.;Wang,H.;Liu,S.L.;Ma,X.X. J.Raman Spectrosc.2007,38,1206.doi:10.1002/jrs.1754
(34) Zhao,R.L.;Lin,K.;Zhou,X.G.;Liu,S.L.Acta Phys.-Chim. Sin.2010,26,1915.[赵荣丽,林 珂,周晓国,刘世林.物理化学学报,2010,26,1915.]doi:10.3866/PKU.WHXB20100728
(35) Lin,K.;Zhou,X.G.;Luo,Y.;Liu,S.L.J.Phys.Chem.B 2010, 114,3567.doi:10.1021/jp9121968
(36)Lin,K.;Hu,N.Y.;Zhou,X.G.;Liu,S.L.;Luo,Y.J.Raman Spectrosc.2012,43,82.doi:10.1002/jrs.2997
(37) Liu,J.H.;Zhang,Y.H.;Wang,L.Y.;Wei,Z.F.Spectrochim. Acta A 2005,61,893.doi:10.1016/j.saa.2004.06.030
(38)Omta,A.W.;Kropman,M.F.;Woutersen,S.;Bakker,H.J. J.Chem.Phys.2003,119,12457.doi:10.1063/1.1623746
(39) Näslund,L.Å.;Edwards,D.C.;Wernet,P.;Bergmann,U.; Ogasawara,H.;Pettersson,L.G.M.;Myneni,S.;Nilsson,A. J.Phys.Chem.A 2005,109,5995.doi:10.1021/jp050413s
April 1,2012;Revised:May 14,2012;Published on Web:May 15,2012.
Ion Pairs in Aqueous Magnesium Nitrate Solution by Excess Raman Spectroscopy
WANG Chen-Chen LIN Ke HU Nai-Yin ZHOU Xiao-Guo LIU Shi-Lin*
(Hefei National Laboratory for Physical Sciences at the Microscale,Department of Chemical Physics,University of Science and Technology of China,Hefei 230026,P.R.China)
We study the ion associations in magnesium nitrate solution by Raman spectroscopy.Utilizing the excess spectra and peak decomposition,we analyze the-OH stretching and NO-3symmetric stretching regions.Analysis of the-OH stretching region demonstrates that the amount of water molecules in the first hydration shell of the anion follows a linear relationship in the low concentration range(<2.3 mol·kg-1), but deviates from this linear relationship at high concentrations(>2.3 mol·kg-1).The contact ion pairs at high concentration result in the nonlinear variation.In the NO-3symmetric stretching region,the contact ion pairs and solvent separated ion pairs exist in the Mg(NO3)2concentration region of 0.23-4.86 mol·kg-1. From a global fitting of the Raman spectra over the whole concentration region,we deduce that the concentration of ion pairs varies.When the Mg(NO3)2concentration is below 2.3 mol·kg-1,the relative amounts of all ion pairs increase with the concentration.However,above this concentration,the relative amount of contact ion pairs increases sharply,and solvent separated ion pairs either decrease or increase in their slower rate,until the Mg(NO3)2concentration is 3.5 mol·kg-1,and above this concentration the relative amount of one kind of solvent separated ion pair does not change.
Aqueous magnesium nitrate solution;Contact ion pair;Solvent separated ion pair; Excess Raman spectrum;Global fitting
10.3866/PKU.WHXB201205154
O645
∗Corresponding author.Email:slliu@ustc.edu.cn;Tel:+86-551-3602323.
The project was supported by the National Natural Science Foundation of China(21103158)and Specialized Research Fund for the Doctoral Program of Higher Education,China(20103402110019).
国家自然科学基金(21103158)和高等学校博士学科点专项科研基金(20103402110019)资助项目