肾消康对糖尿病大鼠肾组织基因Gna12表达的影响*
2012-11-29白玉宾刘春红柳成刚常佳怡高恩宇韩洁茹姜德友
乔 羽,解 颖,白玉宾,王 兵,陈 飞,刘春红,柳成刚,常佳怡,高恩宇,韩洁茹,姜德友
(黑龙江中医药大学基础医学院,哈尔滨 150040)
糖尿病肾病(DN)是糖尿病的一种严重的微血管并发症,其主要病理改变为肾小球肥大,基底膜增厚,以及系膜区基质增加,导致弥漫性或结节性肾小球硬化。临床上早期表现为尿中排出微量白蛋白,继之出现临床蛋白尿,最后进展为慢性肾功能不全。近年来随着其发病率和病死率的提高,DN严重地威胁着人类的健康,影响患者的生存质量,因此,对DN的研究已成为世界性医学攻关课题。由于该病的发病机制较复杂,临床尚无理想药物,而中医药在防治DN方面颇具优势,为此笔者借助分子生物学研究方法,采用基因芯片技术,利用目前国际学术界公认的美国Affymetrix公司生产的Rat2302.0基因表达谱芯片,首先进行差异基因筛选,然后进一步用实时荧光定量逆转录聚合酶链反应法(RT-PCR)检测,寻找DN相关基因,探讨DN病变机制,筛选药效靶点,阐释中药复方肾消康治疗DN的作用机制,为此笔者对链脲佐菌素(STZ)诱导DN大鼠的肾脏基因表达谱进行了研究。本文仅报告肾消康对DN大鼠肾脏组织基因鸟嘌呤核苷酸结合蛋白α12(Gna12)表达的影响。
1 基因芯片实验
1.1 主要试剂、药品和仪器 链脲佐菌素(STZ)为Calbiochem公司产品;肾消康制成浸膏,由黑龙江中医药大学附属第一医院制剂室制备,-20℃的冰箱保存,使用前加温至37℃。有关芯片检测试剂及仪器,均为上海生物芯片有限公司制备,包括Affymetrix Genechip Scanner2.0、Affymetrix Fluidics Station450、Affymetrix Genechip Hybridization Oven640等。
1.2 动物造模及分组 Wistar大鼠120只,雄性,体质量180~210 g(由哈尔滨医科大学实验中心提供),合格证号:P00102004,分笼饲养,每笼饲养7只,室温(18±2)℃,相对湿度 50%~60%,通风良好,每日光照12 h,自由摄食、饮水。适应性喂养1周后,随机选取10只作为空白对照组,以普通饲料喂养,经左下腹注射柠檬酸缓冲液25 mg/kg(pH 4.4),其余大鼠称质量,以25 mg/kg STZ左下腹腔注射,每日上午注射1次,连续5 d。注射前12 h禁食,不禁水。注射后1 h,大鼠自由饮水、进食。造模1周后测血糖。血糖值在16.7 mmol以上的大鼠共50只,再随机分为模型组、西药对照组、肾消康高、中、低治疗组,各组均10只。各组均喂以高热量饲料(1%胆固醇、10%猪油、10%蛋黄粉、1%蔗糖、78%为基础饲料)19周,继续喂养普通饲料7周,共喂养26周。
1.3 给药方法 喂养高热量饲料19周后,随机抽取各组大鼠进行病理检测,光镜、电镜下病理检测近似人类糖尿病慢性肾组织损伤的病理变化。空腹称质量,按大鼠的体表面积与成人剂量之间的换算关系计算给药量。肾消康治疗组给药量为0.79 g/mL,每200 g体质量每次给药2 mL,每日灌胃1次,空白组、模型组以等量生理盐水灌胃。
1.4 标本采集 以电子秤称取每只大鼠体质量,禁食、水12 h,摘眼球取血,分装不同试管,4℃保存备检,以测肌酐、尿素氮等指标。乙醚麻醉后,常规固定、消毒、铺布等处理,沿正中线切开腹壁,快速用180℃、12 h处理过的手术剪刀摘取肾脏、称质量,立即用预冷的生理盐水冲洗,冲洗后在冰上操作。将右肾置于4%多聚甲醛固定,供光镜观察及免疫组化实验使用;将1/3左肾置于2.5%戊二醛中固定,以备制做电镜;将其余2/3左肾置于液氮中冻存以备提取核糖核酸(RNA)使用。
1.5 统计方法 采用SPSS 18.0统计软件,计量资料采用均数±标准差(±s)表示,组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
1.6 DN大鼠肾脏损伤的生化指标及病理变化
1.6.1 血肌酐、血尿素氮的变化 模型组血尿素氮(BUN)水平明显升高,与空白组比较差异具有统计学意义(P<0.01),各治疗组较模型组有较大幅度降低(P<0.01),其中西药对照组、肾消康高剂量组和中剂量组(P<0.01),肾消康低剂量组(P<0.05),各治疗组间比较差异无统计学意义(P>0.05);血肌酐(SCr)模型组水平明显升高,与空白组比较差异具有统计学意义(P<0.01),各治疗组较模型组有较大幅度降低(P<0.01),各治疗组组间比较差异无统计学意义(P>0.05)。说明肾消康可使血肌酐、血尿素氮的生化指标降低。
表1 各组血清 Scr、BUN 水平比较(n=10,±s)Tab.1 Comparison of serum levels of Scr and BUN in three groups(n=10,±s)

表1 各组血清 Scr、BUN 水平比较(n=10,±s)Tab.1 Comparison of serum levels of Scr and BUN in three groups(n=10,±s)
注:与空白组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01。
组别Scr(μmol/L)BUN(mmol/L)空白组 107.19±13.216.33±1.14模型组 162.66±17.06** 15.78±3.95**西药对照组 133.74±16.7## 11.34±2.26##高剂量组 128.80±18.66## 10.95±0.97##中剂量组 121.44±22.48## 10.52±2.17##低剂量组 123.9±21.37## 11.78±3.35#
1.6.2 尿微量白蛋白、β2-微球蛋白的变化 模型组大鼠尿微量白蛋白(Alb)、β2-微球蛋白(β2-MG)排泄量明显高于空白组(P<0.01),治疗组与模型组比较,尿微量白蛋白、β2-微球蛋白排泄量明显降低,差异有统计学意义(P<0.01)。提示肾小球和肾小管的结构和功能受损,肾消康能降低尿微量白蛋白、β2-微球蛋白排出量,说明其对肾脏结构及功能有较好的保护作用。
表2 各组 24 h Alb,β2-MG 水平比较(n=10,±s)Tab.2 Comparison of Alb and β2-MG levels during 24 h in three groups(n=10,±s)
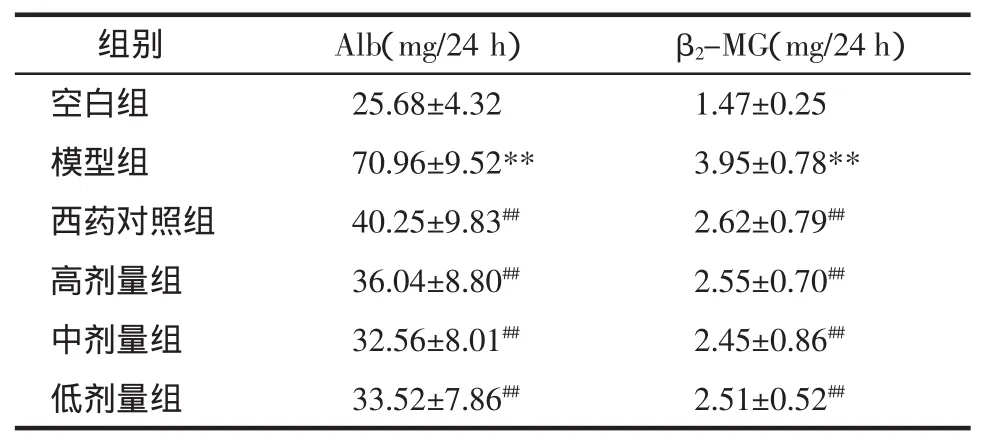
表2 各组 24 h Alb,β2-MG 水平比较(n=10,±s)Tab.2 Comparison of Alb and β2-MG levels during 24 h in three groups(n=10,±s)
注:与空白组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01。
组别 Alb(mg/24 h)β2-MG(mg/24 h)空白组 25.68±4.321.47±0.25模型组 70.96±9.52** 3.95±0.78**西药对照组 40.25±9.83## 2.62±0.79##高剂量组 36.04±8.80## 2.55±0.70##中剂量组 32.56±8.01## 2.45±0.86##低剂量组 33.52±7.86## 2.51±0.52##
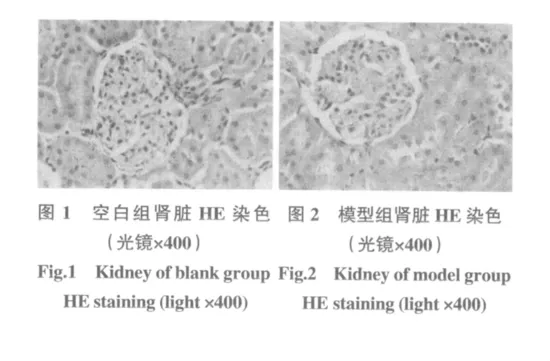
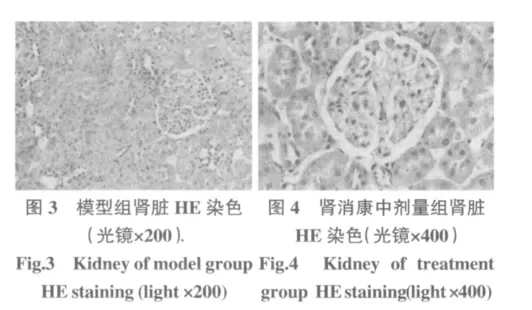
1.6.3 肾脏组织病理及超微结构变化 光镜下观察,空白组:大鼠肾小球毛细血管基底膜厚薄均匀。近曲小管的上皮细胞较少,胞浆,管腔狭窄而不规则;远曲小管上皮细胞较多,胞浆伊红淡染,管腔宽而规则,见图1。模型组:肾小球系膜细胞增生,基质堆积明显,肾小球肥大,肾小球基底膜增厚,发生透明样改变,肾小球与囊壁粘连(渗出性肾小球硬化),小球分叶、分瓣明显(弥漫性肾小球硬化),趋向纤维化,见图2、图3。肾消康中剂量组:少数肾小球轻微的基底膜增厚,轻微的透明样变,部分肾小球囊壁增厚,少数肾小球粘连、有分叶状,有少数纤维增生,少数有局部系膜基质增生及轻度的肾小管扩张和上皮细胞脱落,见图4。
电镜下观察,空白组:近端小管上皮细胞微绒毛密集,胞质内可见大量圆杆状线粒体和少量溶酶体,游离蛋白丰富,高尔基复合体、粗面内质网发达。远端小管上皮细胞结构正常,细胞器形态清晰,系膜细胞完好,见图5。模型组:肾小球基膜增厚,足细胞坏死,滤孔膜溶解,血管内皮细胞质呈网状排列。近端肾小管上皮微绒毛溶解脱落,细胞间连接消失。胞质内溶酶体数量增多,线粒体絮状变。远端小管坏死的细胞质膜脱落,质膜内褶区可见较多的小空泡,见图6、图7。肾消康中剂量组:肾小球毛细血管内皮清晰可见,滤孔膜栅栏状排列,足细胞核清晰,部分核呈凋亡状。近端小管微绒毛脱失、溶解,胞质内有大量的溶酶体,游离核蛋白体丰富。间质血管内皮功能活跃,细胞器数量增多,见图8。
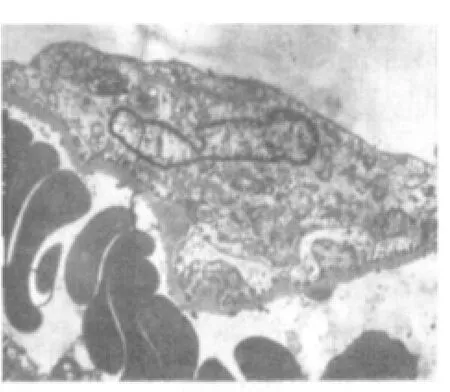
图6 模型组肾脏(电镜 ×6000)Fig.6 Kidneyofmodelgroup(electron microscope×6000)
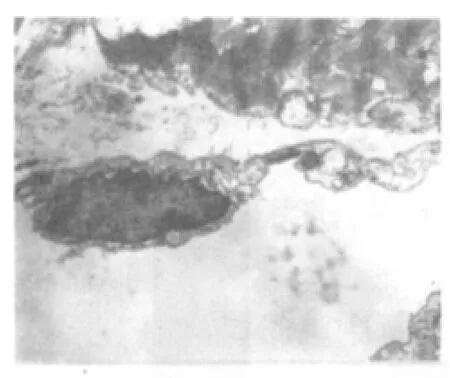
图5 空白组肾脏(电镜 ×6000)Fig.5 Kidney of blank group(electron microscope×6000)
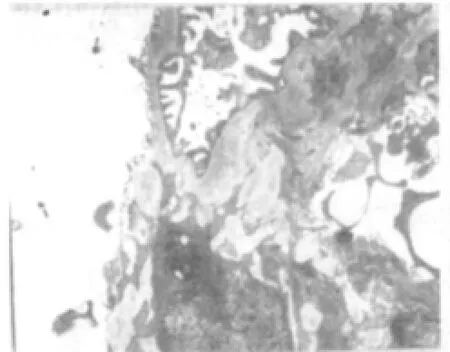
图7 模型组肾脏(电镜 ×6000)Fig.7 Kidney of model group(electron microscope×6000)
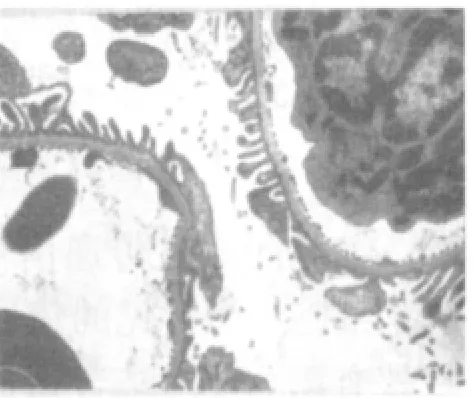
图8 肾消康中剂量组肾脏(电镜 ×6000)Fig.8 Kidney of Shenxiaokang middle dose group(electron microscope×6000)
1.7 基因芯片实验方法 从各组大鼠中取肾脏,使用QIAGEN RNA Isolation Kit抽提总RNA,由纯化的总RNA合成双链cDNA,经PLG提取、乙醇沉淀将双链互补脱氧核糖核酸(cDNA)纯化,用Bio Array High Yield RNA Transcript Labeling Kit方法以生物素标记互补核糖核酸(cRNA)合成,QIAGEN Rneasy Columns法体外转录纯化生物素标记的cRNA,用分光光度计分析RNA浓度进行质控,凝胶电泳检测产物,片断化cRNA,合成cRNA探针。合成好的cRNA探针经片段化处理后用于与基因芯片杂交。芯片的杂交、洗脱、染色及检测利用Affymetrix公司生产的专用设备“基因芯片检测工作站”进行,一切操作过程均按Affymetrix公司推荐的条件进行。
1.8 基因芯片检测数据的处理 芯片扫描所得数据应用“Affymetrix Microarray Suite software 5.0”进行数据处理。
1.9 基因芯片筛选结果按照比较严格的条件筛选出差异表达基因,表达差异2倍以上的基因列表,包括基因名称、GenBank号、Uni号和染色体定位。其中,NM_03 段落tr.1:Gna12即是筛选出的差异表达基因之一,在DN大鼠肾脏组织表达下调,经肾消康治疗后表达上调,见图9。
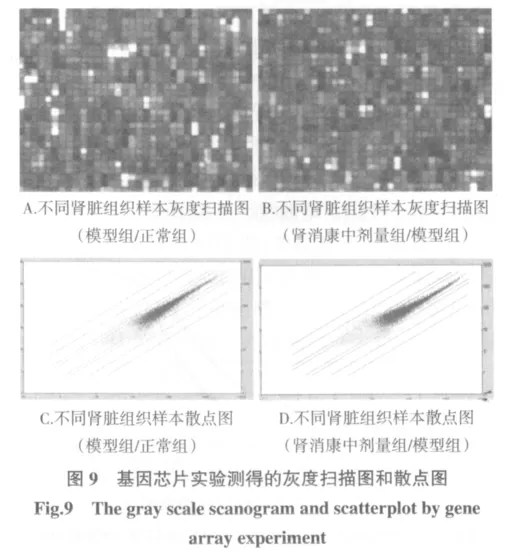
灰度扫描图中采用芯片图像分析软件分析芯片灰度扫描图,得到芯片上每个基因点的原始信号值(包括前景信号值和背景信号值),从而进行差异表达基因的判定。散点图中X轴为对照组信号值,Y轴为实验组信号值,图中红色点为实验组和对照组该基因的Detection均为P,蓝色为两组中有一个值不是P,而黄色为两组均为A。这些点在Affymetrix公司的MASS5.0软件中可以显示Probe Set ID。
2 实时荧光定量RT-PCR的实验检测
2.1 主要实验仪器 PCR仪,PTC-225 Peltier Thermalcycler, MJ Research Inc.,Waltham,Massachusetts;荧光定量PCR仪,Rotor-Gene RG-3000 Real-Time Thermal Cycler,Corbett Reseach,Sydney,Australia。
DN大鼠肾组织 Gna12的 sense primer、antisense primer、product值如下:sense primer:5’-GGAGAAGGTGAAGTCGGTGAGC-3’,length:22 bp,Tm值:60.30℃。anti-senseprimer:5’-GGCAGTGGTGAAGTGGTGGAAC-3’,length:22 bp,Tm 值:61.30℃。product length:154 bp,product Tm值:92.50℃。
2.2 实验方法 本实验采用Eve green法,使用TAKARA公司的RNA PCR kit反转录试剂盒,按照试剂盒提供的反应体系进行反转录反应。反转录体系 10 μL,30℃反应 10 min,42 ℃反应 30~50 min,95℃加热5 min,4℃反应5 min中止。
利用TAKAR公司的TaKaRa Ex Taq Rt-PCR Version.2.1进行荧光定量PCR反应。反应体系25μL,反应条件95℃ 120秒,95℃ 15秒,60℃ 20秒45个循环,72℃20秒中止。
2.3 实时荧光定量RT-PCR数据分析 实验结果利用软件Rotor-Gene 6.0以及Excel 7.0进行数据分析处理。
2.4 实时荧光定量RT-PCR结果
2.4.1 Gna12的扩增曲线 见图10。
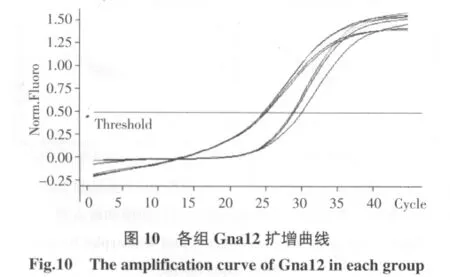
2.4.2 Gna12的标准曲线 见图11。
2.4.3 Gna12的扩溶解曲线 见图12。
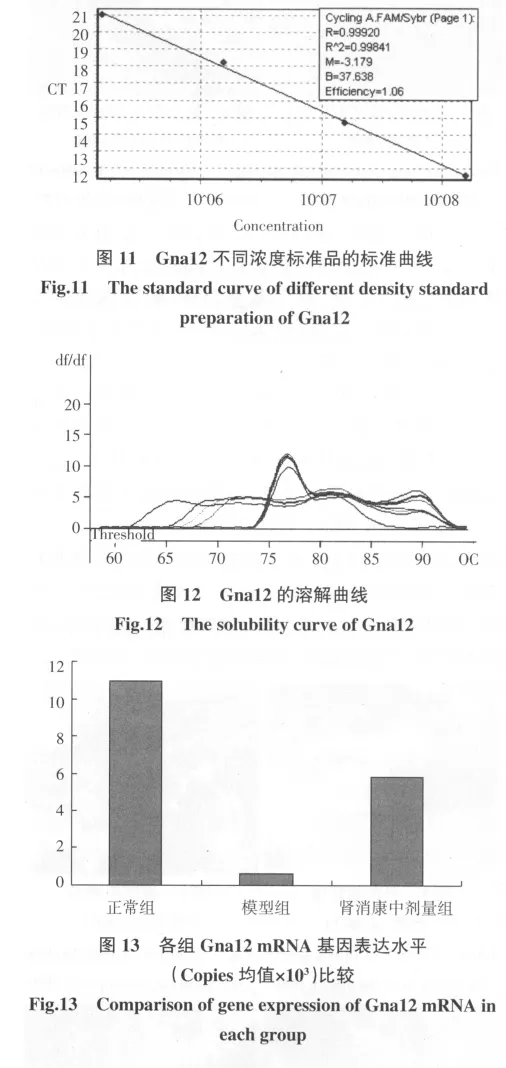
2.4.4 Gna12的Copies值 Gna12实时定量结果表明,模型组大鼠肾脏组织Gna12表达下调,而经肾消康治疗后大鼠肾脏组织中Gna12表达上调,见图13。
3 讨论
细胞间通过传递信号分子相互交流,G蛋白系统是细胞中最常见的信号传递方式。G蛋白即鸟嘌呤核苷酸(GTP)结合蛋白,具有GTP酶活性,是在细胞信号通路中起信号转换器或分子开关作用的蛋白质,是细胞信号传导通路上的重要组成部分,体内外许多激素、递质、毒物和药物等均可通过G蛋白引起细胞内相应的第二信使改变,导致一系列生理生化变化[1]。
G蛋白可分为两类:1)由α、β和γ亚单位组成的异三聚体,在膜受体与效应器之间的信号转导中起中介作用;2)小分子G蛋白,为分子质量21~28 ku的小肽,只具有G蛋白α亚基的功能,在细胞内进行信号转导,属于小GTP酶的Ras超家族。
当受体被配体激活后,Gα上的GDP为GTP所取代,这是G蛋白激活的关键步骤。此时G蛋白解离成GTP-Gα和Gβγ两部分,它们可分别与效应器作用,直接改变其功能,如离子通道的开闭,或通过产生第二信使影响细胞的反应。Gα上的GTP酶水解GTP,终止G蛋白介导的信号转导。此时,Gα与Gβγ又结合成无活性的三聚体[2]。
目前,Gα亚基主要有Gαs、Gαi、Gαq/11 和Gα12/13几种不同的类型。它们主要是在效应识别上不同,但却有着相似的激活机制。Gαi抑制ATP生成cAMP;Gαq/11刺激膜结合的磷脂酶C测试,然后将PIP2裂解成两个第二信使:IP3和二酰基甘油(DAG);Gα12/13参与Rho家族GTP酶信号转导(通过RhoGEF家族)和控制细胞骨架重构,从而调节细胞的迁移[3]。
细胞骨架是一动态纤维网络,具有细胞收缩、维持细胞形状、细胞运动、黏附、吞噬等功能[4]。细胞骨架的主要成分是微丝,肌动蛋白(actin)是微丝的基础蛋白,以纤维状肌动蛋白(F-actin)和单球状肌动蛋白(G-actin)两种形式存在并相互转换,调节系膜细胞的收缩状态,从而调节毛细血管口径及肾小球滤过率[5]。
G蛋白是细胞中重要的信号转导分子,是许多信号传递途径的中心环节,因此也就成了众多药物和毒素攻击的靶位点。事实上,如糖尿病、失明、过敏、抑郁症、心血管缺陷和某些癌症疾病以及其他病症,都被认为是由于G蛋白信号紊乱引起的[6]。但Gna12在DN发病机制中的作用目前还不得而知,国内外相关研究极少,从本实验研究结果可以看出:在DN状态下,模型组大鼠肾脏Gna12表达下调,笔者由此推断高糖影响了Gna12的信号转导功能,从而使F-actin解聚,细胞骨架重构导致系膜细胞收缩功能失调,造成早期DN肾小球的高滤过状态,导致DN的发生。
DN为本虚标实之证,病及五脏六腑、气血经络,其脏腑虚损以脾肾为著,脾虚则其运化、升清、散精的作用不足,血中精微不能输布脏腑,濡养四肢,积蓄过多则随小便漏泄体外,发为消渴[7]。脾肾两虚是病理基础,湿浊瘀血既是病理产物又是致病因素,脾肾亏虚、湿浊瘀血贯穿DN始终。
肾消康具有补肾健脾、利湿泄浊、化瘀通络的作用。肾阴得充则一身阴液得养,肾阳不虚,其蒸腾气化功能正常,肾之封藏功能如常,精微物质存内为机体所用而不外泄。健脾益气,培补后天之本,使水谷精微得以四布,脏腑得养,清者得升,浊者得降,湿浊得化,精微得布;脾气充盛又可化生气血,血流通畅,祛除瘀血形成之源。利湿泄浊可通过促进代谢,使体内精微物质得到利用,使本身有害物质得到清除。活血化瘀可使经络之瘀滞得除,各脏腑得新血濡养。
肾消康,其药物组成有生地、山药、山茱萸、茯苓、泽泻、牡丹皮、人参、黄芪、枸杞子、陈皮、葛根、水蛭等。方中以六味地黄汤为基础方,滋阴清热。枸杞子药性平和,为平补阴阳之佳品,用之增强补肾之力;人参、黄芪补虚扶正,且人参、黄芪与茯苓、泽泻、葛根、水蛭配伍,使扶正与祛邪协调兼顾,祛邪不伤正、扶正不留邪;陈皮与葛根配伍,陈皮辛散苦降,长于理气燥湿健脾泻胃浊,调中快膈;葛根升津、升发清阳、鼓舞脾胃清阳之气;水蛭破血逐瘀,效强而不伤正。方中诸药相合,祛邪而不伤正,扶正而不留邪,标本兼顾,为临床治疗DN的良方[8]。王盛发等[9]通过糖尿病肾病中医治疗用药规律分析,总结了一些用药频度较高的中药,如黄芪、茯苓、山药、山茱萸等,中药类型则以补益、健脾、活血、清热类为多,这为本方用药提供了有力的参考依据。
现代药理证实:生地、山茱萸、山药、黄芪、茯苓、泽泻均有降血糖作用;黄芪有双向调节血糖作用和减少尿蛋白排泄作用;茯苓、泽泻降糖降脂改善糖脂代谢,增加肾血流量,促进肾功能恢复[10]。谭俊珍等[11]认为六味地黄丸对糖尿病大鼠糖、脂代谢有一定的改善作用。
4 结论
本研究应用Affymetrix Rat2302.0基因芯片检测糖尿病大鼠肾脏基因表达谱,筛选差异表达基因,Gna12基因是筛选出的肾脏差异表达基因和药效靶点之一,并对该基因做荧光定量RT-PCR测序分析。基因功能分析表明,在DN状态下,模型组大鼠肾脏Gna12表达下调,表明Gna12的信号转导功能受到影响。肾消康中剂量组Gna12表达上调,中药复方肾消康可调控Gna12的信号转导功能,对Gna12有良性调节作用。其作用机制有待于更深入研究。
[1]李 岩,谢克勤.化学物对G蛋白影响的研究进展[J].卫生毒理学杂志,2002,16(2):127-130.
[2]Eric RK,James HS,Thomas MJ.Principles of Neural Science[M].New York:McGraw-Hill,2000.
[3]Neves SR,Ram PT,Iyengar R.G protein pathways[J].Science,2002,296(5573):1636-1639.
[4]Baumann CA,Ribon V,Kanzaki M,et al.CAP defines a second signaling pathway required for insulin-stimulated glucose transport[J].Nature,2000,407(6801):202-207.
[5]Chiang SH,Baumann CA,Kanzaki M,et al.Insulin stimulated GLUT4 translocation requires the CAP-dependent activation of TC10[J].Nature,2001,410(6831):944-948.
[6]Alcazar O,Ho RC,Fujii N,et al.cDNA cloning and functional characterization of a novel splice variant of c-Cbl-associated protein from mouse skeletal muscle[J].Biochem Biophys Res Commun,2004,317(1):285-293.
[7]段艳蕊,杜义斌.糖尿病肾病从脾论治机制初探[J].天津中医药,2011,28(5):399-400.
[8]白玉宾.肾消康对糖尿病肾损伤保护作用机制的研究[D].哈尔滨:黑龙江中医药大学,2007.
[9]王盛发,唐 劭,曹克光.糖尿病肾病中医治疗用药规律分析[J].天津中医药,2009,26(2):167-168.
[10]张 威.中西医结合治疗糖尿病肾病60例临床观察[J].天津中医药大学学报,2007,26(3):119.
[11]谭俊珍,李庆雯,范英昌,等.六味地黄丸对糖尿病大鼠血糖和血脂的影响[J].天津中医药大学学报,2007,26(4):196-198.
