基于针铁矿法的沉铁过程动态建模
2012-11-29熊富强桂卫华阳春华李勇刚
熊富强,桂卫华,阳春华,李勇刚
(中南大学 信息科学与工程学院,湖南 长沙,410083)
传统的湿法炼锌工艺是火法−湿法的联合过程[1],所产生的SO2气体对大气造成严重的污染。新的锌湿法冶炼过程虽然摆脱了火法的约束,但是,闪锌矿因其铁质量分数高达30%以上,当浸出液中的铁离子质量浓度过高时,不利于后续工序的进行,甚至严重影响锌产品的质量和产量。由于在针铁矿法沉铁过程中存在时滞和非线性,且对工艺条件要求苛刻,凭借现场操作人员的经验,铁离子质量浓度和pH都难以稳定控制。工艺参数的不稳定直接造成原料和能源大量消耗。因此,实现针铁矿法沉铁过程的自动优化控制,是提高沉铁效率、节能降耗的有效手段和迫切需要解决的问题。针铁矿法沉铁过程(以下简称沉铁过程)是一个由气、液、固三相参加的反应,其中包括Fe2+的氧化反应、Fe3+的水解反应和H+的中和反应。最近10多年来,许多学者对沉铁过程进行了大量研究,如:邓永贵等[2]从针铁矿晶种制备的角度研究了水热法制备过程中温度对晶种形成过程的影响;胡国荣等[3−7]据针铁矿除铁的原理分析了影响针铁矿形成过程的相关因素,如氧化剂的选择、溶液终点 pH的适宜范围以及反应时间等;马莹等[8]针对 Fe3+在酸性溶液中的水解产物进行了分析,对Fe3+水解形成针铁矿提供了理论依据。Krehula等[9]针对pH较高的情况情况,发现温度在25~160 ℃时,溶液中Fe3+的起始质量浓度对针铁矿形成过程影响较大;Soumya等[10]则在一定温度下分析了不同 pH时针铁矿的形成过程。这些研究者大多局限于对沉铁过程的动力学机理进行研究,但没有涉及在实际工业生产中如何采用计算机优化控制技术实现沉铁过程自动优化控制。为了实现最优控制,必须基于沉铁过程的反应动力学机理建立具有输入输出关系的数学模型。在此,本文作者针对针铁矿法沉铁过程,分析气−液和固−液两相反应特点,根据串联连续搅拌槽式反应器(n-CSTR)[11−12]的特性,并基于反应动力学和质量守恒定律,对沉铁过程的输入量和状态变量进行动态的数学描述,以建立针铁矿法沉铁过程的机理模型;通过所建立的多重时滞的微分方程组和输出方程给出沉铁过程的状态方程;最后,通过将数值计算结果与实际生产过程中对应的输出结果相比较,以验证所建立的模型的有效性。
1 沉铁过程的工艺分析
针铁矿法沉铁工艺流程如图1所示:沉铟后液经溜槽首先进入1号反应器;1号反应器溢出液经溜槽流入2号反应器;2号反应器溢出液经溜槽流入3号反应器;3号反应器溢出液经溜槽流入4号反应器;4号反应器溢出液即为针铁矿法除铁后液。这4个反应器根据低铁离子质量浓度下降梯度要求通入一定量的O2;1号和2号反应器根据反应器内溶液的pH分布要求加入一定量的焙砂(主要成分是 ZnO);为了加快针铁矿的形成速率和满足4号反应器出口溶液的含固量要求,1号反应器需要适量添加返流晶种;将浓密机的上清液送往下一个工序,浓密机的底流大部分送到压滤机去压滤产生铁渣,少部分作为晶种返流。
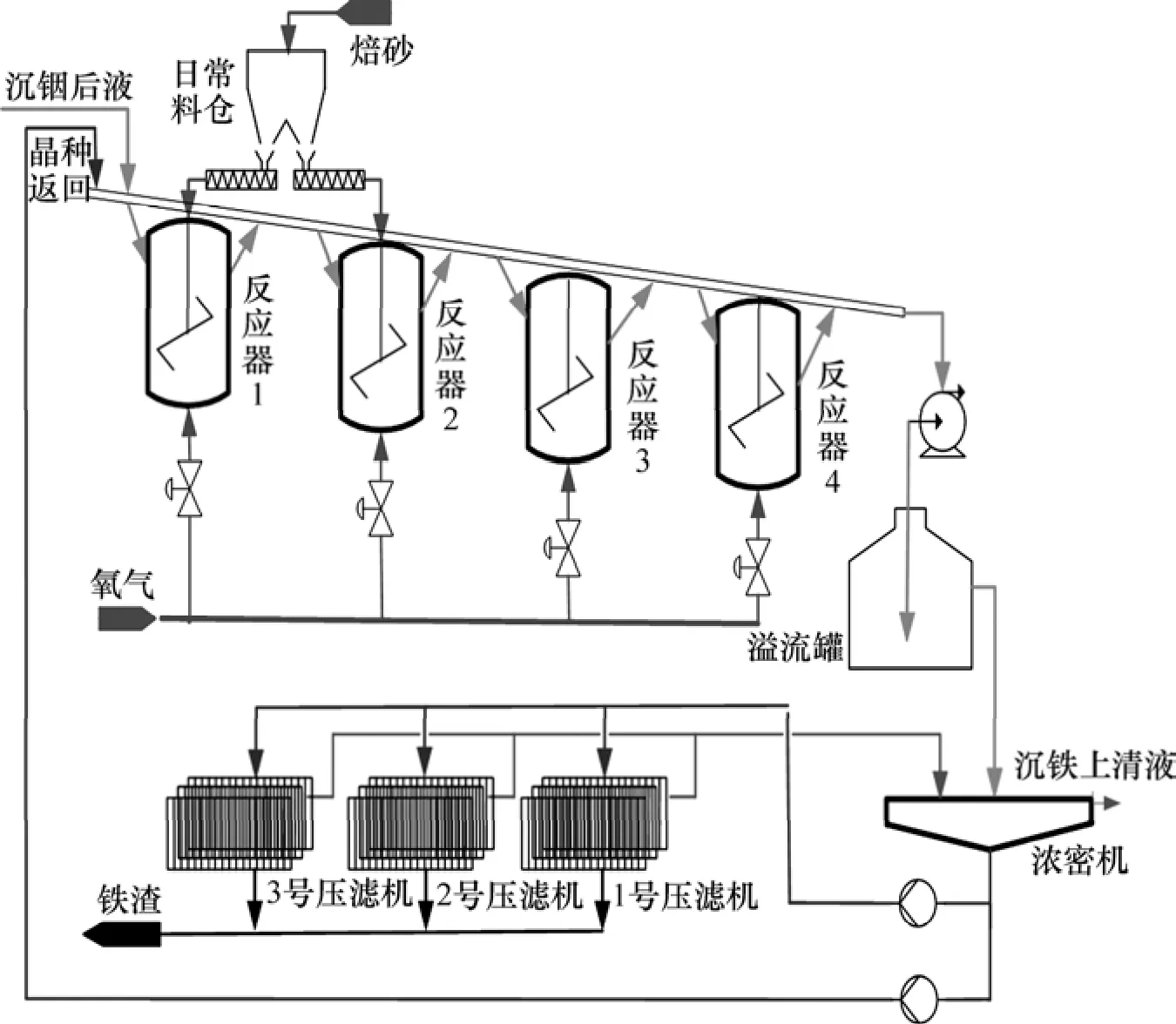
图1 针铁矿法沉铁工艺流程示意图Fig.1 Sketch map of iron precipitation by goethite process
在V.M法针铁矿法沉铁过程中,主要化学反应可由以下3个化学方程式表示。
氧化反应:
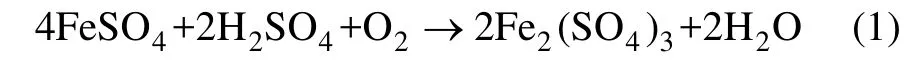
水解反应:
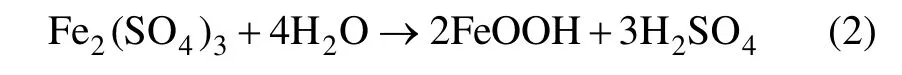
中和反应:
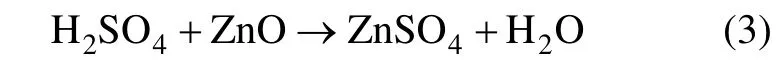
沉铁过程的工艺指标为沉铁后液的酸度 pH,pH=3.5~4.0;沉铁后液的铁质量浓度满足:ρ(Fe2+)+ρ(Fe3+)≤1 g/L;ρ(Fe2+)≤0.5 g/L。
在沉铁过程中,对沉铁效果有影响的2个关键的工艺参数分析如下。
(1) 氧化速度。氧化速度太慢会使沉铁后液的Fe2+质量浓度超标。氧化速度太快会影响溶液中 pH上升速度过快,致使沉铁反应器最后的出口溶液pH超标,同时会影响其他各反应器的终点pH。另外,Fe3+的生成速度过快,致使Fe3+的质量浓度过于饱和,会快速形成氢氧化铁胶体,而不会形成针铁矿微晶。
(2) pH。pH太低不利于Fe3+的水解,同时增加了针铁矿微晶的返溶,从而导致沉淀效率降低;pH太高会使Zn2+发生不必要的沉淀,降低中和剂的反应效率。另外,Fe2+的氧化及针铁矿的形成对 pH的要求都很高,只有当pH大于1.5时,Cu2+的催化作用才能有效发挥;只有当pH大于3.5时,Fe3+才能以针铁矿形式沉淀完全。
根据沉铁过程的工艺,以及便于机理模型的建立,本文进行如下假设:
(1) 反应器中溶液的温度保持在一个很小的温度范围内波动(75~80 ℃),并且各沉铁反应器中溶液的温度相差1~2 ℃,故假设整个沉铁过程都是在恒温条件下进行。
(2) 由于各沉铁反应器是呈高低阶梯排列,溶液自溢而出,故可假设反应液体体积是常数。
(3) 由于各沉铁反应器是连续搅拌器,搅拌功率一定,故假设气液两相是理想宏观混合情况下的均相反应。
(4) 由于沉铟后液中Fe2+和H+浓度远大于晶种返流中的 Fe2+和 H+的浓度,故忽略晶种返流中的 Fe2+和H+浓度。
2 沉铁过程的动态建模
针对针铁矿法沉铁过程中涉及的3个主要化学反应进行研究,分别对氧化反应、水解反应和中和反应建立基于质量平衡定律的动态数学方程。
由于沉铁反应器个数达到4个,因此,可以认为整个沉铁过程是在一个全混流的反应器进行。设1号反应器总的流量为Fsum。
2.1 氧化反应的动态建模
纯氧作为一种很好的氧化剂,其与Fe2+的氧化反应可表示为[13]:
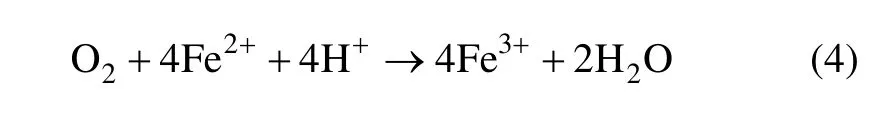
当Cu2+的质量浓度达到0.3 g/L以上时,其增加的催化效果不明显,这时,Fe2+的氧化速率只与其浓度和溶解在水中的O2浓度有关。
根据化学动力学方程可知,Fe2+氧化速率可表示为:
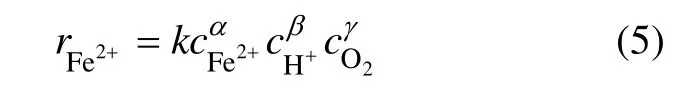
式中:k为反应速率常数;α,β和γ为反应级数;cFe2+,cH+和cO2分别为Fe2+浓度、H+浓度和溶液中的氧气浓度。
2.1.1 应速率常数k
式中:k0为频率因子,受温度影响不大,可视为常数,通过辨识获得;E为活化能,取94.1 kJ/mol;R为气体常数,取8.314 J/(mol·k);T为热力学温度,可在线检测。
2.1.2 反应级数α,β和γ
为了方便建模,将反应级数简化成:
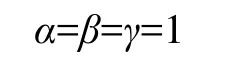
从而Fe2+的氧化速率可表示为:
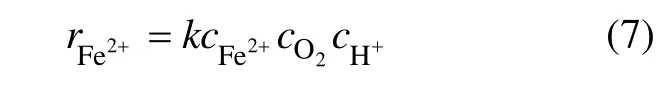
2.1.3 氧浓度 cO2
由于溶液中的氧气浓度 cO2与温度、溶液组分、搅拌功率和氧分压都有密切关系,所以,很难得到氧气在溶液中的精确浓度。在一定温度和搅拌功率下,根据双膜理论,界面的氧浓度与氧流量有关,液相本体的氧浓度与氧分压有关,为了得到 cO2和氧气流量的关系,故设:
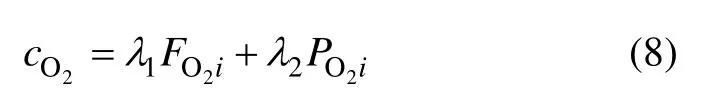
式中:FO2i为氧流量;PO2i为氧分压。将式(8)代入式(7)得到:
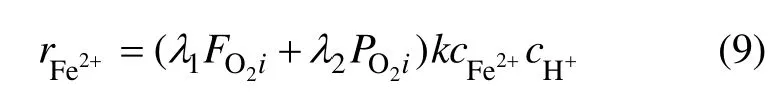
式中:λ1和 λ2为线性回归系数,并且 λ1∈R,λ2∈R,为待辨识参数。
根据质量守恒定律,Fe2+浓度的质量平衡方程为:
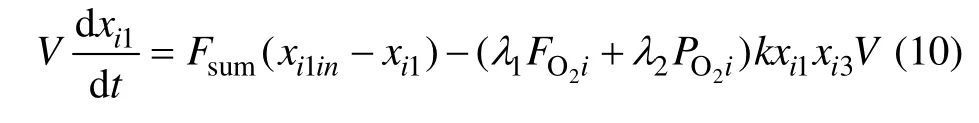
2.2 水解反应的动态建模
铁离子在水解过程中,并不是单纯地按照Fe3+→Fe(OH)3那样进行,Fe3+单核水解产物的生成是非常迅速的[14],然后生成二聚体以及多聚物。Fe3+的水解平衡和简化表示成:
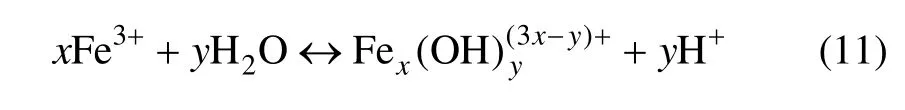
式中:x和y分别为水解产物中的铁离子数和羟基数。在酸性溶液中,Fe3+水解平衡除用式(11)表示外,还可以用下面的反应式予以描述:
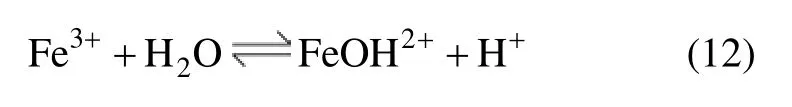
式(12)的平衡常数为[8]:
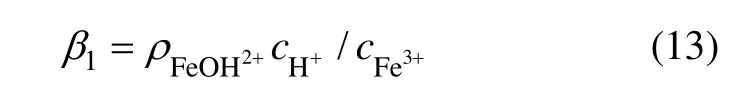
根据针铁矿的形成化学反应方程式:
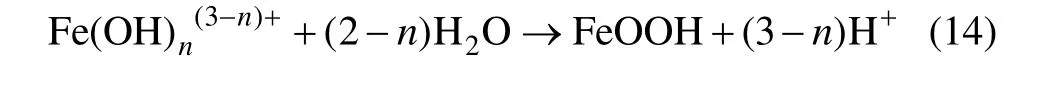
可知:Fe3+水解反应生成的单核FeOH2+是形成针铁矿的主要离子来源。根据平衡常数 β1可以得到 FeOH2+浓度:
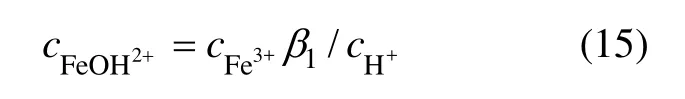
Fe3+的反应速率可表示为:
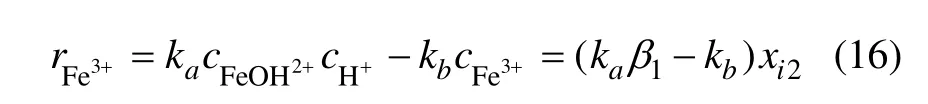
式中:ka和 kb为反应速率常数。令 k2=kaβ1−kb,k2可以通过辨识得到,则有:

根据质量守恒定律,Fe3+浓度的质量平衡方程为:
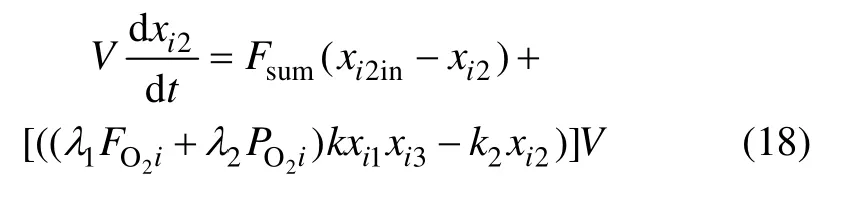
其中:xi1in为各反应器入口的 Fe2+质量浓度;xi1为各反应器出口的 Fe2+浓度;xi2in为各反应器入口的 Fe3+浓度;xi2为各反应器出口的Fe3+浓度;FO2i为各反应器所添加氧气的流量;各反应器的有效反应体积为V。
2.3 中和反应的动态建模
根据氧化反应和水解反应的化学方程式可以得知1个Fe2+转化为1个FeOOH微晶时会净生成2个H+,因此,为了维持反应器中溶液 pH稳定,就必须加入中和剂。在某冶炼厂中,中和剂为焙砂(挥发窑烟灰),其主要含ZnO,质量分数达80%左右,其他是一些不溶性固体。中和反应是典型的固−液两相反应。对于该类反应,常用的反应模型有2种:整体反应模型和收缩末反应芯模型(即缩芯模型)[15]。这里选择缩芯模型中颗粒粒径不变的这种反应过程作为理论基础建模。反应过程中的颗粒变化示意图见图2。
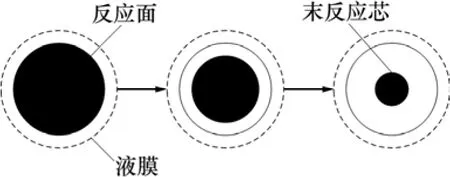
图2 反应过程中的颗粒变化示意图Fig.2 Particle change scheme of reaction process
设焙砂单颗粒为球形,若反应过程中是H+的液膜扩散控制,则在等温条件下单颗粒上H+通过液膜到达颗粒外表面的质量即为反应速率,可表示为:
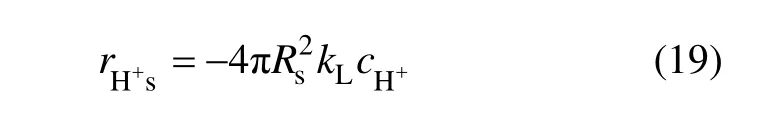
式中:Rs为颗粒半径;kL为液膜传质系数,可以通过现场工业数据辨识得到; cH+为H+的浓度。
当添加的所有焙砂同时参加中和反应时,所产生的H+的反应速率为:
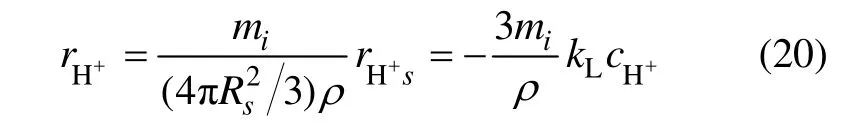
同样,根据质量守恒定律,H+的质量平衡方程为:
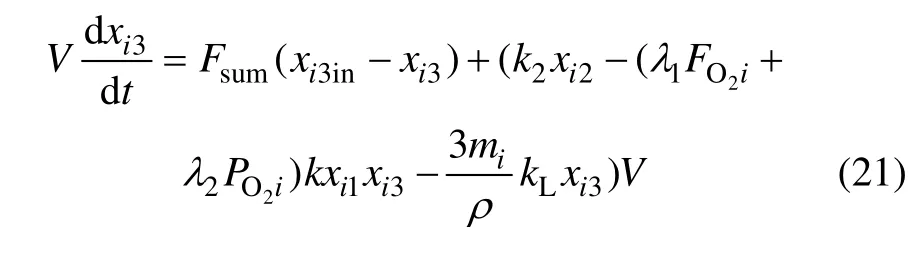
其中:xi3in为各反应器入口的H+浓度,xi3为各反应器出口的H+浓度;FO2i为各反应器所添加氧气的流量;mi为焙砂每小时的添加量;各反应器的有效反应体积为V。
连续沉铁过程是一个长流程工序,整个沉铁时间大约为4 h,每个沉铁反应器流过的时间为50~60 min。由于时滞是真实存在的,因此,在模型中考虑时滞,得到沉铁过程的动态模型:
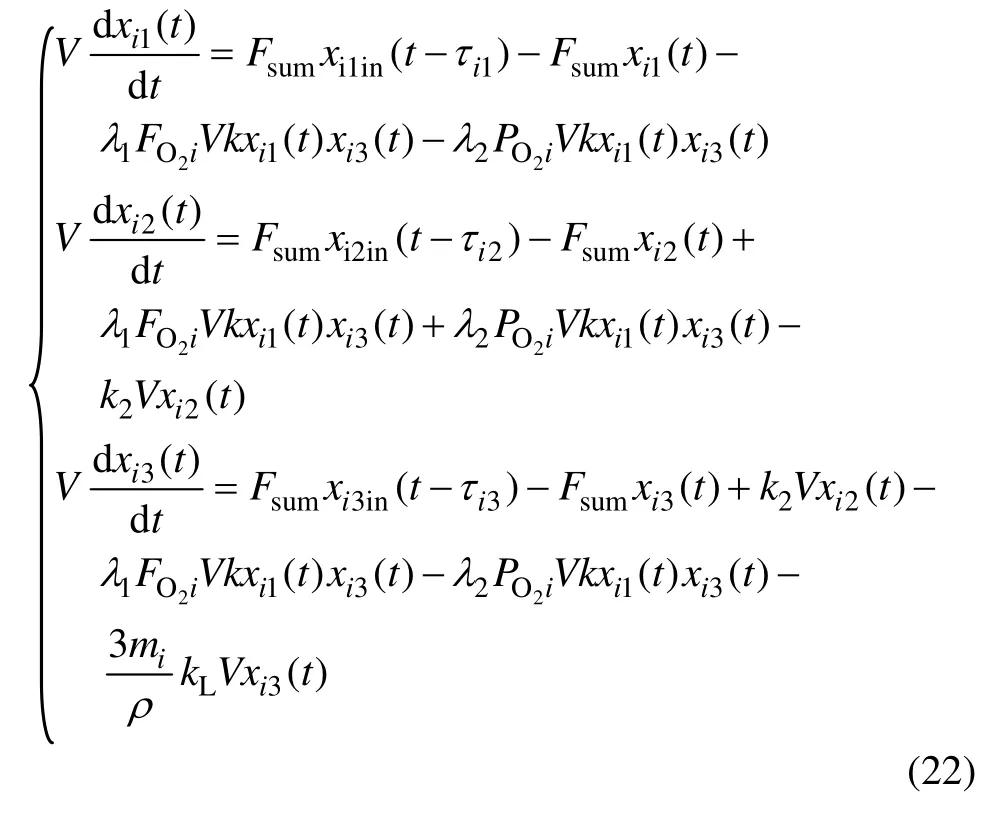
沉铁过程的动态模型有3个输入量:串联连续搅拌槽式反应器n-CSTR的入口总流量Fsum,O2流量FO2i和单位时间内焙砂添加量 mi;3个状态变量:Fe2+浓度,Fe3+浓度和H+浓度。
根据工业运行中实际考核的工艺指标,选择Fe2+浓度和H+浓度建立输出方程。
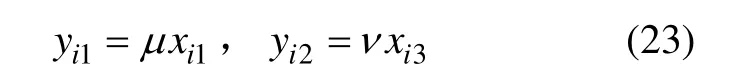
式中:μ和v为辨识参数。
由沉铁过程的微分动态方程组(22)和输出方程(23)表示的系统状态空间模型为:
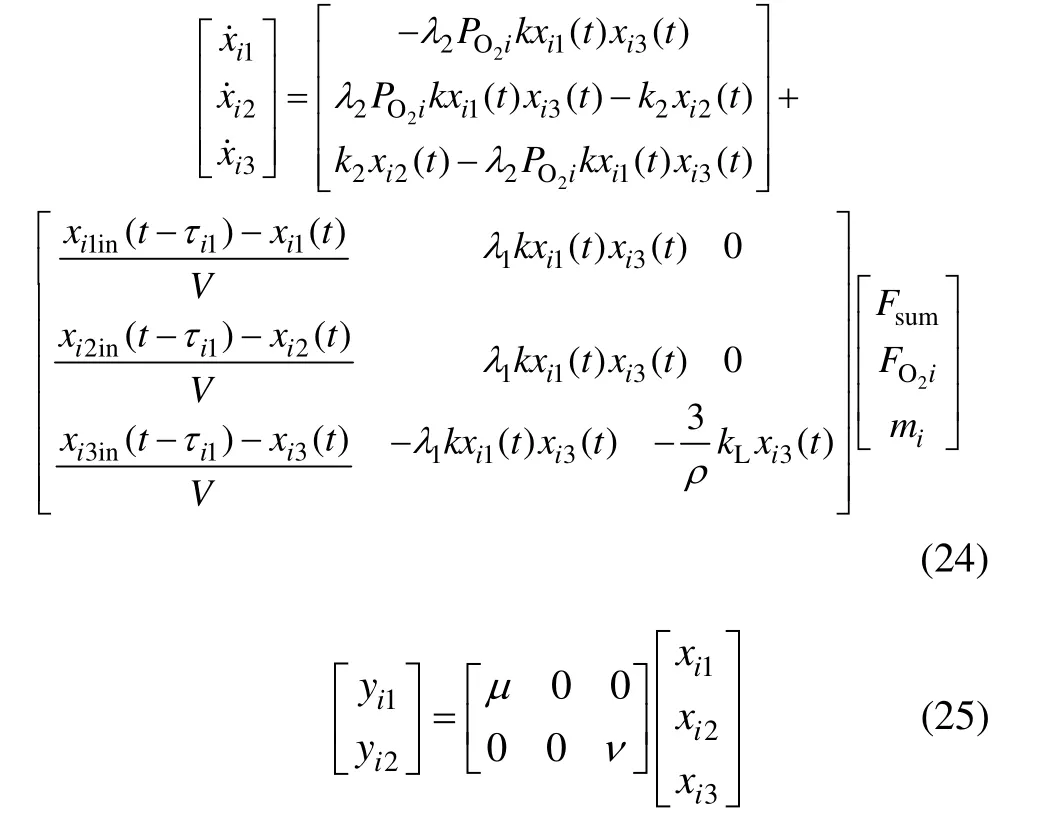
3 数值计算、仿真及分析
针对式(9),(17)和(20)中待辨识的参数,采用现场采集的500组各反应器入口和出口的Fe2+和Fe3+质量浓度化验值,以及对应时刻的温度、pH、氧分压、氧流量、焙砂流量和1号反应器入口总流量的在线检测值,通过lsqnonlin函数实现的最小二乘算法辨识得到的参数如下:k0=1.02×10−5s−1;k2=1.04×108s−1;kL=0.224 m·s−1;λ1=1.25×10−7mol·L−2;λ2=2.78×10−7mol·L−2·Pa−1。
选择1组初始状态变量进行数值仿真研究,变量初始取值如表1所示。1~4号沉铁反应器中Fe2+质量浓度及pH的实测值与计算值分别见表2和表3。

表1 变量初始取值Table 1 Initial value of variables
从表2和表3可见:尽管模型误差比较大,但是,还是能基本反映整个沉铁过程各反应器中Fe2+质量浓度和H+浓度(这里用pH表示)的变化情况。这些误差的产生主要是在机理建模过程中把实际生产的工艺条件都进行了一些假设(如溶液流量恒定、焙砂流量均匀等)。并且由于沉铁过程中三相反应的复杂性和耦合性,机理模型还不能精确地反映整个沉铁过程,因此,沉铁过程的反应机理还有待进一步研究。
通过 Matlab仿真,得到了 1~4号沉铁反应器中Fe2+质量浓度和 H+浓度(这里用 pH 表示)的连续变化曲线,如图3和图4所示。
从图3和图4可见:Fe2+质量浓度呈一定的梯度下降,验证了所建立的沉铁过程动态模型的有效性;在1号反应器中,Fe2+质量浓度和H+浓度较高,因而,在较小的氧气流量下就能达到理想的氧化效果。图4中4号反应器的pH在3号应器的pH上升到3.55后有所下降,这是因为在3号和4号反应器中没有添加焙砂,生成的净酸使得4号反应器的H+浓度有细微上升。综合图3和图4还可以看出:在4个沉铁反应器中,1号和2号反应器中化学反应最剧烈,Fe2+和Fe3+质量浓度下降的梯度都较大,确保整个沉铁工序的工艺指标能够达标。
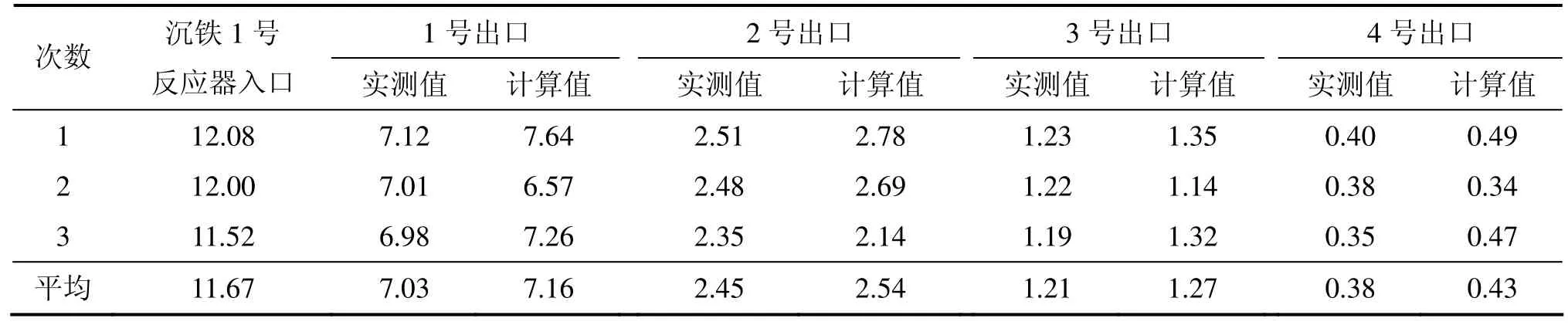
表2 1~4号沉铁反应器中的Fe2+质量浓度实测值与计算值Table 2 Measured values and calculated values of Fe2+ concentration in No.1−4 iron precipitation reactor g/L
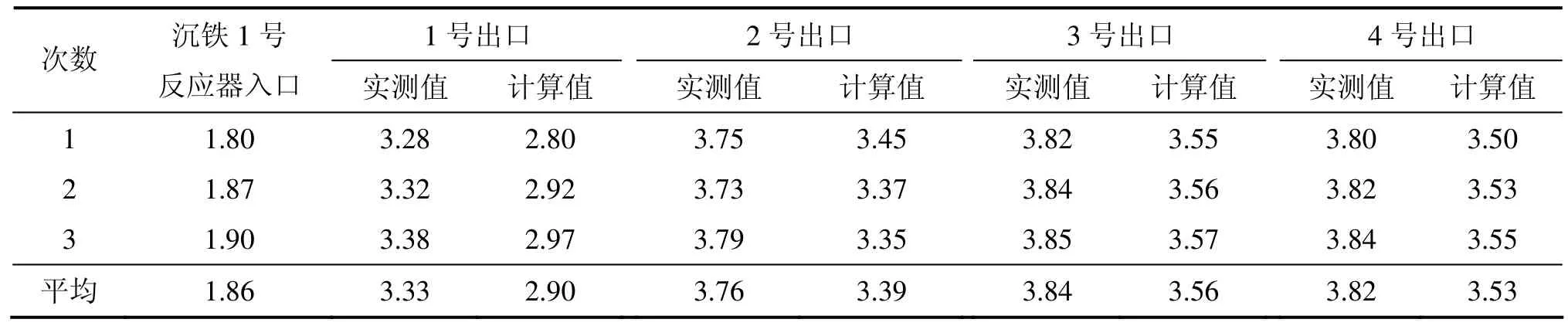
表3 1~4号沉铁反应器中的pH实测值与计算值Table 3 Measured and calculated values of pH in a No.1−4 iron precipitation reactor
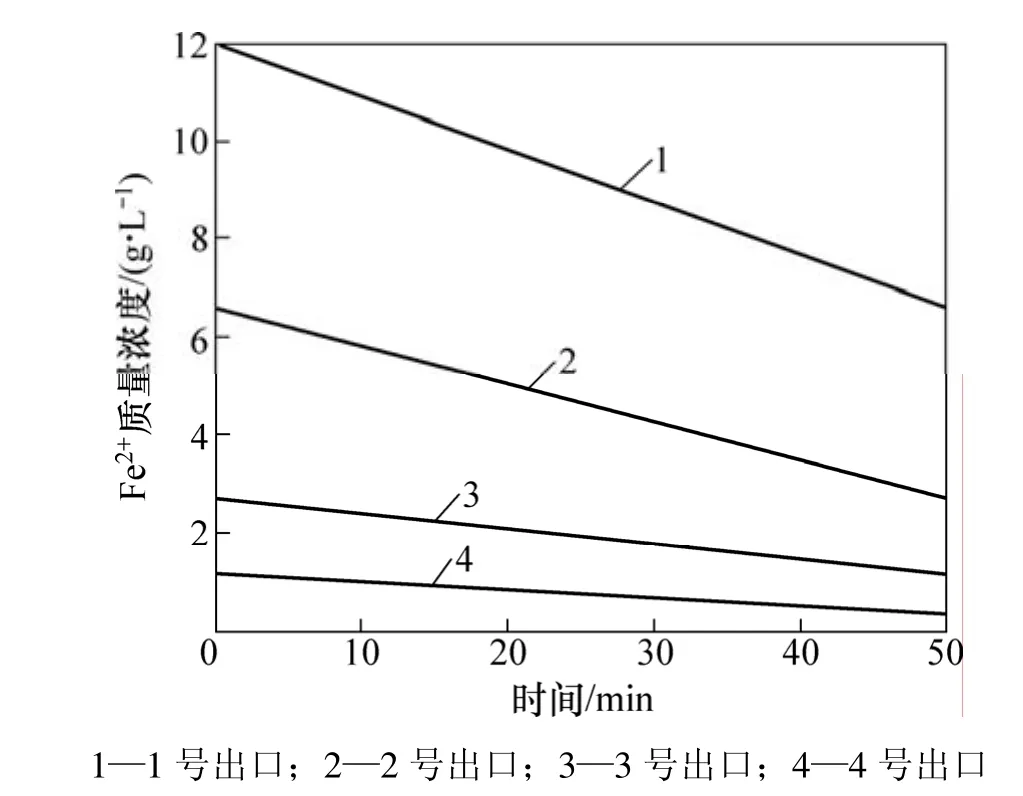
图3 1~4号反应器Fe2+质量浓度的连续变化曲线Fig.3 Continuous change curves of子 No. 1−4 reactors
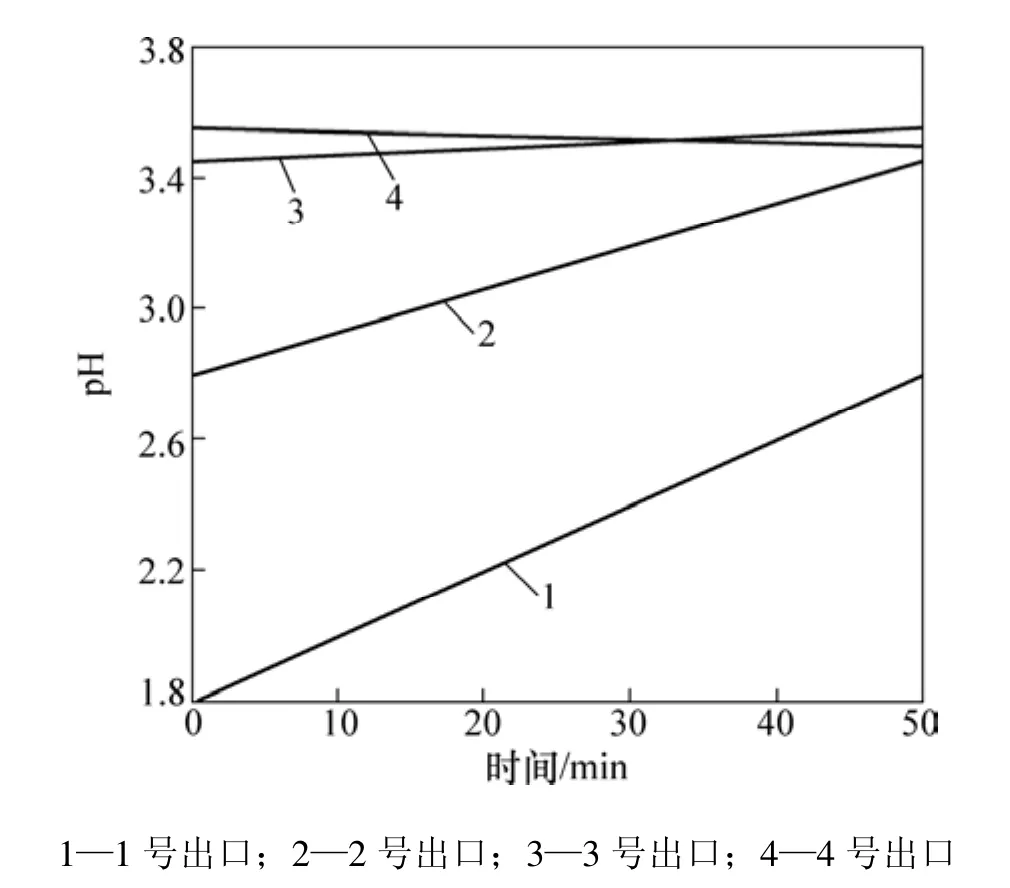
图4 1~4号反应器pH的连续变化曲线Fig.4 Continuous change curves of pH of No. 1−4 reactors
4 结论
(1) 通过研究整个沉铁过程的化学反应机理,简化了沉铁过程中的氧化反应、水解反应和中和反应,建立了带时滞的动态微分方程;同时,在确定整个沉铁过程的输入、输出变量后,给出了沉铁过程的状态方程,通过数值计算和仿真结果验证了模型的有效性,为先进优化控制技术在沉铁过程中的实施打下良好的基础。
(2) 通过对建立沉铁过程的动态微分方程模型及仿真结果的分析,表明本文所建机理模型能够较为准确地描述针铁矿法沉铁过程,为实现氧化反应和中和反应的协调优化控制提供了思路。
[1]牟望重, 张庭安, 吕国志, 等. 硫化锌氧压浸出过程的 φ−pH图[J]. 中国有色金属学报, 2010, 20(8): 1636−1644.MU Wang-zhong, ZHANG Ting-an, LÜ Guo-zhi, et al. φ−pH figure during oxidative pressure leaching of zinc sulfide[J]. The Chinese Journal of Nonferrous Metals, 2010, 20(8):1636−1644.
[2]邓永贵, 陈启元, 尹周澜, 等. 湿法炼锌浸出液针铁矿法除铁晶种的制备[J]. 中国有色金属学报, 2008, 18(1): 27−31.DENG Yong-gui, CHEN Qi-yuan, YIN Zhou-la, et al.Preparation of goethite seeds for removal of ferrous/ferric ions from leaching solution of zinc in hydrometallurgy process[J].The Chinese Journal of Nonferrous Metals, 2008, 18(1): 27−31.
[3]胡国荣, 李国, 邓新荣, 等. 针铁矿法从铬铁合金硫酸浸出液中除铁[J]. 湿法冶金, 2006, 25(4): 198−201.HU Guo-rong, LI Guo, DENG Xin-rong, et al. Removal of ironfrom sulfuric acid leaching solution of ferrochromium alloy by goethite[J]. Hydrometallurgy of China, 2006, 25(4): 198−201.
[4]赵永, 蒋开喜, 王德全, 等. 用针铁矿法从锌焙烧烟尘的热酸浸出液中除铁[J]. 有色金属: 冶炼部分, 2005, 5(1): 13−15.ZHAO Yong, JIANG Kai-xi, WANG De-quan, et al. Iron removal from hot acid leaching solution of zinc roasting dust by goethite Process[J]. Nonferrous Metals: Extractive Metallurgy,2005, 5(1): 13−15.
[5]关亚君. 湿法炼锌常规工艺铁的浸出及沉铁 pH值的研究[J].稀有金属, 2006, 30(3): 419−422.GUAN Ya-jun. Study on iron leaching and pH value of Fe hydrolysis in zinc hydrometallurgy[J]. Chinese Journal of Rare Metals, 2006, 30(3): 419−42.
[6]彭建蓉, 王吉坤, 杨大锦, 等. 富铟高铁硫化锌精矿加压浸出液沉铟后溶液净化除铁研究[J]. 湿法冶金, 2007, 26(2): 88−91.PENG Jian-rong, WANG Ji-kun, YANG Da-jin, et al. Study on removal of iron from pressure acid leaching liquor of zinc sulfide concentrate precipitated indium[J]. Hydrometallurgy of China,2007, 26(2): 88−91.
[7]CHANG Yong-feng, ZHAI Xiu-jing, LI Bin-chuan, et al.Removal of iron from acidic leach liquor of lateritic nickel ore by goethite precipitates[J]. Hydrometallurgy, 2010, 10(1):84−87.
[8]马莹, 何静, 马荣骏. 三价铁离子在酸性水溶液中的行为[J].湖南有色金属, 2005, 21(1): 36−39.MA Ying, HE Jing, MA Rong-jun. Fe (Ⅲ) behaviors in acid solution[J]. Hunan Nonferrous Metals, 2005, 21(1): 36−39.
[9]Krehula S, Popović S, Musić S. Synthesis of acicular α-FeOOH particles at a very high pH[J]. Materials Letters, 2002, 54(5):108−113.
[10]Soumya D, M. Jim Hendry. Changes of crystal morphology of aged goethite over a range of pH (2–13) at 100 °C[J]. Applied Clay Science, 2011, 5(1): 192−197.
[11]邓燕妮, 桂卫华, 阳春华, 等. 氧化铝碳酸化分解动态过程建模及非线性分析[J]. 中国有色金属学报, 2008, 18(9):1736−1741.DENG Yan-ni, GUI Wei-hua ,YANG Chun-hua, et al. Dynamic process modeling and nonlinear analysis for alumina carbonation decomposition[J]. The Chinese Journal of Nonferrous Metals,2008, 18(9): 1736−1741.
[12]Boe K, Angelidaki I. Serial CSTR digester configuration for improving biogas production from manure[J]. Water Research,2009, 4(3):166−172.
[13]陈家镛, 于淑秋, 伍志春. 湿法冶金中铁的分离和利用[M].北京: 冶金工业出版社, 1991: 138.CHEN Jia-yong, YU Shu-qiu, WU Zhi-chun. Separation and utilization of ferric from hydrometallurgy[M]. Beijing:Metallurgical Industry Press, 1991: 138.
[14]梅光贵, 王德润, 周敬元, 等. 湿法炼锌学[M]. 长沙: 中南大学出版社, 2001: 220−225.MEI Guang-gui, WANG De-run, ZHOU Jing-yuan, et al.Hydrometallurgy of zinc[M]. Changsha: Central South University Press, 2001: 220−225.
[15]王录锋, 张杰, 刘志红. 硫酸分解织金含稀土磷矿化学反应过程实验研究[J]. 应用化工, 2009, 38(12): 1785−1790.WANG Lu-feng, ZHANG Jie, LIU Zhi-hong. Research of the chemical reaction process of Zhijin rare-earth containing phosphate rock decomposition with sulfuric acid[J]. Applied Chemical Industry, 2009, 38(12): 1785−1790.
