改性柿子粉吸附剂对Cd2+的吸附性能
2012-11-29郭学益肖彩梅梁莎田庆华
郭学益,肖彩梅,梁莎,田庆华
(中南大学 冶金科学与工程学院,湖南 长沙,410083)
据报道,国内连续发生了重金属污染事件。随着现代工业的迅猛发展,重金属污染日趋严重。重金属离子主要是通过含有大量污染金属的工业废水(主要来源于冶炼、医药、电镀、纺织印染、造纸等)、城市生活废水以及各种矿山废水向自然环境中排放,并进一步通过食物链的传递对动植物造成严重的影响。生物吸附法是一种新兴的重金属废水处理技术,它利用廉价的生物材料对重金属离子进行吸附,尤其适宜低浓度重金属废水的处理,并且具有吸附量高、吸附速率快等优点[1]。生物吸附剂的来源并不局限于微生物和藻类,丰富的农林业副产物如橘子皮[2−3]、甜菜渣[4]、榛子壳[5]、玉米芯[6]、谷壳[7]、树皮[8]、废弃的茶叶[9−10]、马铃薯渣[11]、锯末[12]等亦被认为是有相当潜力的生物吸附剂。我国是柿子主产国,每年的柿子总产量在500万t左右,但由于其味涩未广泛用于食品行业,大部分柿子未得到有效利用而自然腐坏[13]。柿子中的主要有效成分为单宁,又称单宁酸、鞣质,是多酚中高度聚合的化合物,其结构中含有大量的活性官能团酚羟基,可与金属离子通过离子交换、螯合等方式结合,从而用于水溶液中重金属离子的净化[14−16]。但直接采用柿子粉吸附水溶液中的重金属离子,存在单宁等可溶性物质溶解而导致吸附能力降低、水中化学耗氧量增加等问题。近年来,有研究者利用甲醛或浓硫酸交联改性的柿子皮吸附重金属离子[17−19]。在此,本文作者以柿子粉为基体,经丙酮和硫酸改性处理得到柿子生物吸附剂AP并研究其对Cd2+的吸附,包括初始pH、温度等对吸附过程的影响、生物吸附动力学、等温平衡研究以及生物吸附剂的循环再生。
1 实验材料与方法
1.1 仪器与试剂
仪器为:WFX−130B原子吸收分光光度计(北京市瑞利分析仪器公司制造);SHA−C水浴恒温振荡器(江苏省金坛市荣华仪器制造有限公司制造);PHS−3C酸度计(上海雷磁制造);TDL−40B低速台式离心机(上海安亭科学仪器厂制造);LS908型激光粒度分析仪(广东珠海欧美克公司制造)、电子分析天平(上海天平仪器公司制造);FD−1B−50冷冻干燥机(北京博医康实验仪器有限公司制造)。
试剂为:CdCl2·2H2O,CH3COCH3,H2SO4,缓冲剂HEPES等,均为分析纯。
1.2 改性柿子吸附剂的制备
柿子的主要有效成分单宁的分子结构中存在大量的酚羟基,易溶于水,因此,本实验研究通过化学改性的方法使柿子中的有效成分单宁发生缩合沉淀,从而获得柿子生物吸附剂。在45 ℃时,取100 g柿子粉末(PP)加入300 mL丙酮和200 mL 3mol/L H2SO4浸泡搅拌反应24 h,然后离心分离,用蒸馏水洗至中性,冷冻干燥8 h,所得改性柿子粉生物吸附剂简称为AP,采用激光粒度分析仪测其平均粒度为29.97 μm。
1.3 静态吸附实验
在50 mL锥形瓶中加入一定量的改性柿子粉生物吸附剂及Cd2+溶液,密闭瓶口以防实验过程中体积发生变化。将其放入水浴恒温振荡器中振荡反应,达到预定吸附时间后过滤。

滤液中金属离子浓度均用原子吸收分光光度计测定。用下式计算吸附量:式中:V为溶液体积,mL;ρ0和ρe分别为金属离子的初始质量浓度和平衡质量浓度,mg/L;m为所用生物吸附剂的质量,mg。吸附率(R)由下式计算:

1.4 解吸附实验
将达到吸附平衡的生物吸附剂过滤后,往滤渣中加入一定量的0.1 mol/L HCl溶液,恒温振荡解吸3 h,过滤,用蒸馏水洗至中性,烘干,再生后的吸附剂被反复使用。
2 结果与讨论
2.1 吸附剂的表征
图1所示为PP和AP的红外光谱图。由PP的红外光谱图可知柿子粉的成分很复杂,PP的主要成分有单宁、果胶、蛋白质、糖类等,其中在3 550~3 100 cm−1范围内的宽峰表明 PP存在大量的羟基(—OH),在2 937 cm−1附近的峰主要缘于芳香环中C—H键的伸缩振动[20];1 730 cm−1附近的峰属于官能团—COOH和—C=O的吸收峰;1 610~1 455 cm−1范围的峰主要缘于芳香族中C=C键的伸缩振动;1379 cm−1附近的吸附峰是由多酚中的 O—H在面内形变振动形成的[21]。醚键 CH2—O—CH2的吸收峰出现在 1 150~1 085 cm-1范围内。苯环上C—H键的变形振动产生的吸附波段为910~740 cm−1。
对比PP和AP的红外光谱图可知:经化学改性后,PP中3 299 cm−1附近的羟基峰移动到3 329 cm−1,并且 3 329 cm−1附近的波峰较宽,芳香环中 C—H 峰(2 937和931 cm−1)减弱或消失,很可能是其与丙酮发生缩合反应引起的。反应式为:
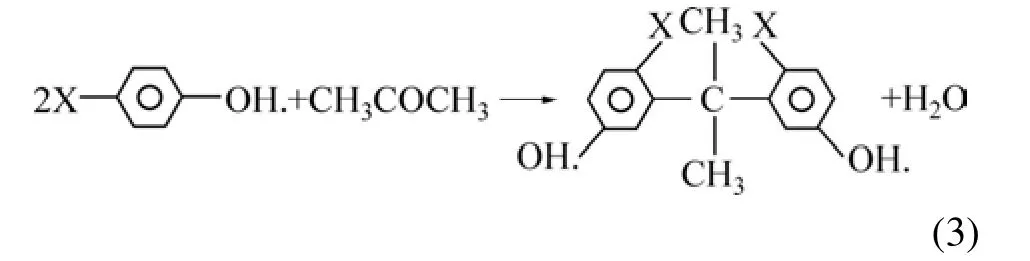
式中:X表示其他官能团。在1 730和1 610 cm−1附近的峰结合成1个峰,并在1 621 cm−1附近变宽,很可能是C=O官能团在AP上的环境发生改所致[22]。在1 213 cm−1附近的波峰得到加强,是由C—O—C键不对称振动引起的。上述分析说明柿子粉在硫酸的催化作用下,与丙酮发生了有效的缩合反应,从而改变柿子粉的水溶性;同时,大量的羟基官能团可以通过离子交换或配合等方式吸附溶液中的重金属离子,进而提高吸附性能。

图1 PP和AP的红外光谱图Fig.1 FIIR spectra of PP and AP
2.2 溶液初始pH的影响
图2 所示为溶液初始pH对吸附过程的影响。显然,溶液初始 pH对吸附过程的影响很大。当溶液初始pH<3.5时,AP对Cd2+的吸附量很小;而当溶液初始pH在4.0~6.0范围内,吸附率迅速增大;在pH为6.8左右趋于平缓。在较低pH下,H+的浓度和活动性较高,与Cd2+形成了竞争吸附,从而吸附率较低[23];随着pH的增大,H+的浓度降低,吸附剂表面暴露更多的负电荷基团,有利于Cd2+吸附在活性位点上。因此,本研究的所有实验选取溶液初始pH为6.5~6.8。
2.3 反应温度的影响

图2 初始pH对吸附过程的影响Fig.2 Effect of initial pH on adsorption
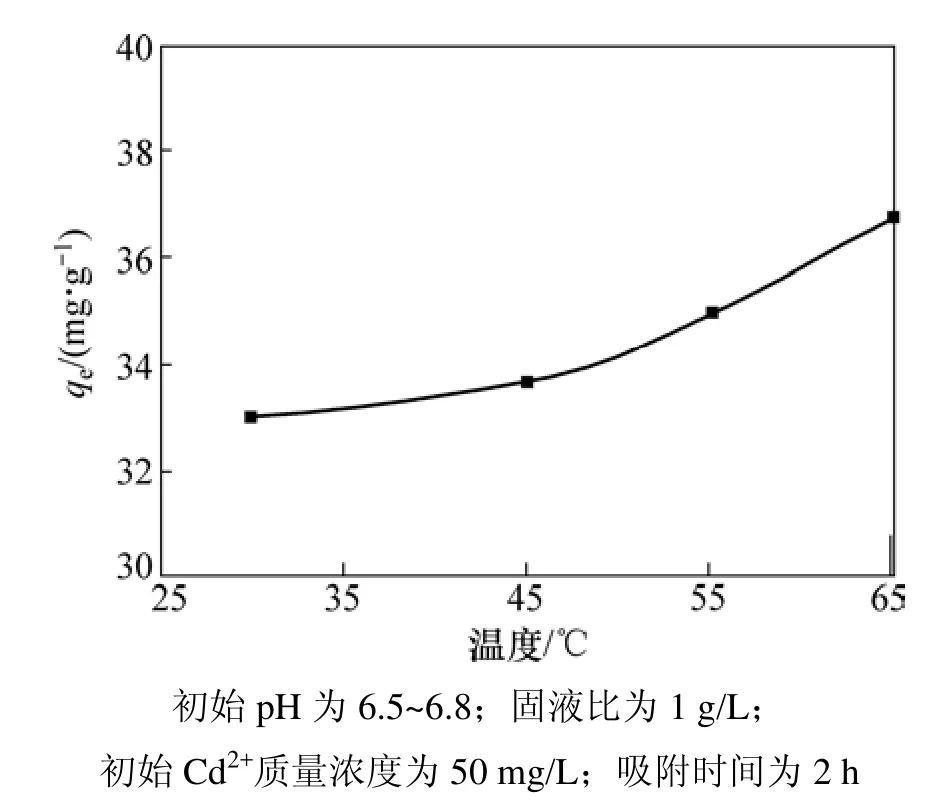
图3 反应温度对吸附量qe的影响Fig.3 Effect of temperature on adsorption
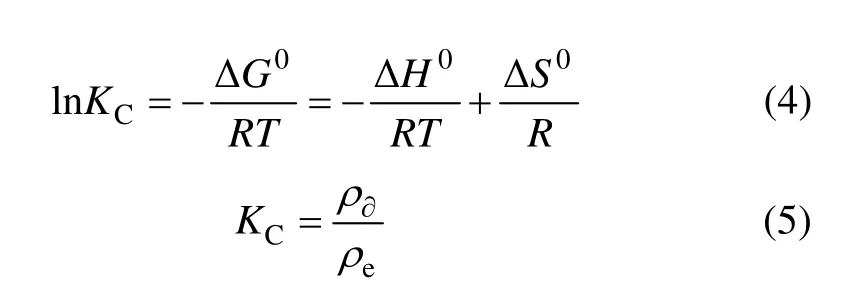
图3所示为反应温度对吸附过程的影响。由图3可知:AP对 Cd2+的吸附过程受温度影响较小,Cd2+的吸附量随温度升高而缓慢增大。吸附热(ΔH0)可根据下式计算:式中:ΔG0为标准吉布斯自由能,kJ/mol;R为热力学气体常数,8.314 J/(mol⋅K);T为热力学温度,K;ΔH0为反应的焓变量,kJ/mol;ΔS0为反应的熵变量,J/(mol⋅K);KC为热力学平衡常数;ρ∂为吸附到吸附剂上的金属离子的质量浓度,mg/L。以lnKC对1/T作图并进行线性拟合,计算热力学参数,所得结果见表1。
由表1所示热力学参数可知ΔH0>0,说明AP吸附Cd2+的反应为吸热反应。吸附吉布斯自由能ΔG0是吸附驱动力和吸附优先性的体现,ΔG0在试验温度范围内均为负值,这说明AP对Cd2+的吸附过程是自发进行的。
2.4 动力学研究
在生物吸附动力学的研究中,通常用准二级动力学方程对实验数据进行模拟以分析金属离子浓度随吸附时间的变化关系(如图4所示)。准二级动力学方程的线性表达式为:
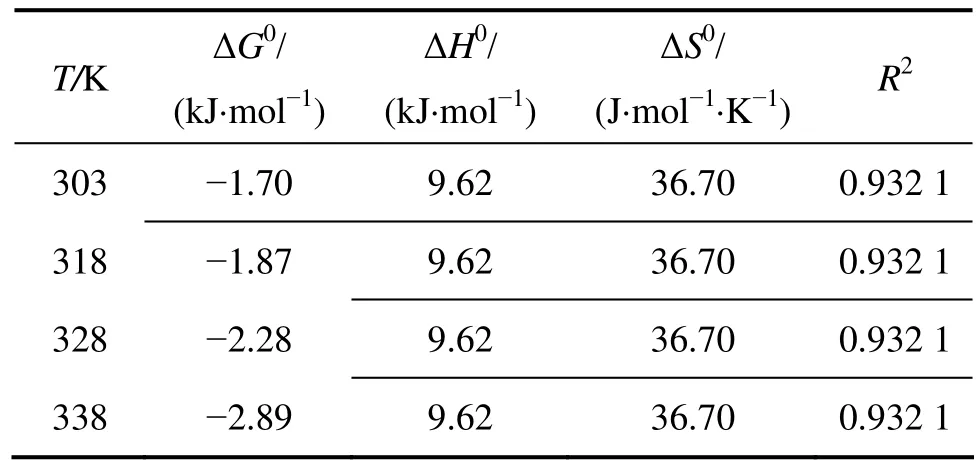
表1 AP吸附Cd2+的热力学参数Table 1 Thermodynamics parameters of adsorption
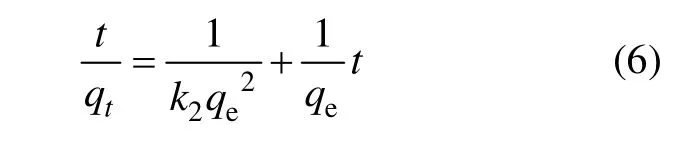
式中:qt为t时间时生物吸附剂对金属离子的吸附量,mg/g;qe为吸附平衡时的吸附容量,mg/g;k2为准二级动力学方程速率常数,g/(mg·min)。利用上述方程对图4所示实验结果进行模拟,以t/qt对t作图,所得结果见表2。从表2可以看出:试验结果可以很好地用准二级动力学方程进行模拟,相关系数均接近于 1,且qe的实验值与理论值相差很小。这表示吸附过程遵循准二级反应机理,吸附过程被化学吸附所控制[24]。
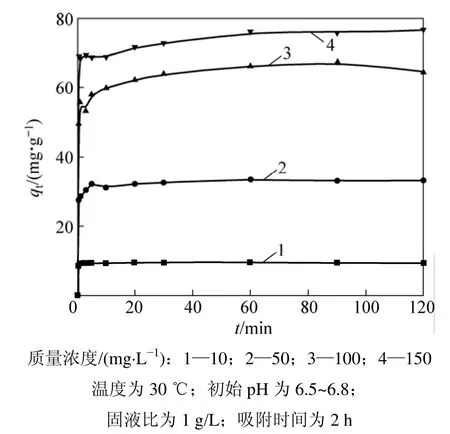
图4 初始离子质量浓度对吸附的影响Fig.4 Effect of initial mass concentration on adsorption

表2 AP吸附Cd2+的准二级反应动力学参数Table 2 Kinetic parameters of pseudo-second-order equation for adsorption
2.5 等温平衡研究
图5所示为AP和PP吸附Cd2+的等温吸附曲线。可以直观看出柿子粉吸附剂AP对Cd2+的吸附量明显大于原始柿子粉 PP的吸附量。采用 Langmuir和Freundlich吸附等温模型对图5中的数据进行模拟。Langmuir模型的表达式为:

式中:qm为生物吸附剂吸附金属离子饱和容量,mg/g;b为Langmuir常数,L/mg。qm和 b可分别由 ρe/qe对 ρe作直线方程的斜率和截距求出。Freundlich 模型的表达式为:
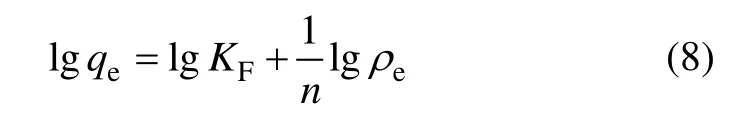
式中:KF和n为Freundlich吸附经验常数,分别由lgqe对lgρe作直线方程的斜率和截距求出。模拟结果如表3所示。从表 3可以看出:AP对 Cd2+的吸附均符合Langmuir和 Freudlich模型,模拟所得的相关系数为0.972 3;AP和PP对Cd2+的最大吸附量分别为82.78 mg/g和3.50 mg/g,即通过化学改性制备的柿子粉吸附剂AP较原始柿子粉PP对Cd2+的吸附量有很大提高,进一步说明了改性处理使得柿子粉表面有效官能团增加,与金属离子结合能力增强。
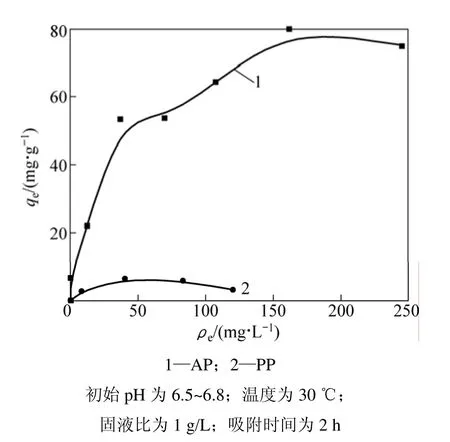
图5 AP和PP吸附Cd2+的等温线Fig.5 Adsorptions isotherms of adsorption

表3 AP吸附Cd2+的Langmuir和Freundlich模型参数Table 3 Parameters of Langmuir and Freundlich equations for adsorption
2.6 解吸再生
实验考察了已吸附Cd2+的改性柿子生物吸附剂的解吸与再吸附性能,结果如图6所示。由图6可知:用再生后的生物吸附剂进行吸附试验,吸附能力稳定,Cd2+的吸附率均在99%左右,并且吸附剂的质量略微减少,且每次解吸率均在97%左右,说明改性后柿子吸附剂至少可以循环使用5 次以上。
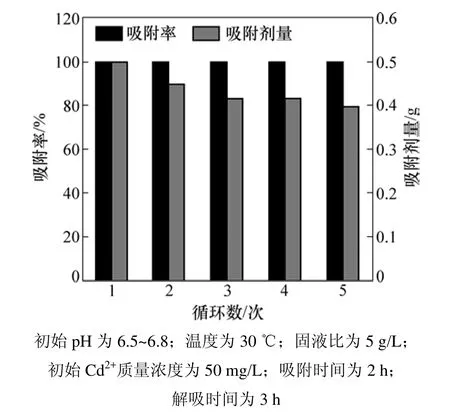
图6 AP吸附Cd2+的循环吸附实验Fig.6 Cd2+ adsorption cycles of AP
3 结论
(1) 将改性柿子粉生物吸附剂用于处理含 Cd2+的水溶液,吸附率显著提高且可再生循环使用,是一种性能良好的生物吸附剂。
(2) 溶液初始pH是影响吸附效果的重要因素,最佳吸附pH为6.5~6.8。吸附动力学可以用准二级动力学方程很好地描述。AP对Cd2+的吸附均符合Langmuir和Freudlich模型。PP和AP对Cd2+的最大吸附量分别为82.78 mg/g和3.50 mg/g。
[1]WANG Xue-song, QIN Yong. Equilibrium sorption isotherm for Cu2+on rice bran[J]. Process Biothem, 2005, 40(2): 677−680.
[2]冯宁川, 郭学益, 梁莎, 等. 皂化交联改性橘子皮生物吸附剂对 Cu2+的吸附[J]. 中南大学学报: 自然科学版, 2009, 40(4):857−862.FENG Ning-chuan, GUO Xue-yi, LIANG Sha, et al. Adsorption of Cu2+by saponified and cross-linked orange peel[J]. Journal of Central South University: Science and Technology, 2009, 40(4):857−862.
[3]LIANG Sha, GUO Xue-yi, FENG Ning-chuan, et al. Application of orange peel xanthate for the adsorption of Pb2+from aqueous solutions[J]. Journal of Hazardous Materials, 2009, 170(1):425−429.
[4]Reddad Z, Gerente C, Andres Y, et al. Ni (II) and Cu (II) binding properties of native and modified sugar beet pulp[J]. Carbohydr Polym, 2002, 49(1): 23−31.
[5]Cimino G, Passerini A, Toscano G. Removal of toxic cations and Cr(VI) from aqueous solution by hazelnut shell[J]. Water Research, 2000, 34(11): 2955−2962.
[6]王文华, 冯永梅, 常秀莲, 等. 玉米芯对废水中铅的吸附研究[J]. 水处理技术, 2004, 30(2): 95−98.WANG Wen-hua, FENG Yong-mei, CHANG Xiu-lian, et al.Removal of lead from aqueous solution by corncobs[J].Technology of Water Treatment, 2004, 30(2): 95−98.
[7]Mohanty K, Jha M, Biswas M N, et al. Removal of chromium(VI) from dilute aqueous solutions by activated carbon developed from Terminalia arjuna nuts activated with zinc chloride[J]. Chem Eng Sci, 2005, 60(11): 3049−3059.
[8]Randall J M. Variations on effectiveness of barks as scavengers for heavy metal ions[J]. Forest Product Journal, 1977, 27(11):51−56.
[9]章明奎, 方利平. 利用非活体生物质去除废水中重金属的研究[J]. 生态环境, 2006, 15(5): 897−900.ZHANG Ming-kui, FANG Li-ping. Use of non-living biomass materials to remove selected heavy metals from wastewater[J].Ecology and Environment, 2006, 15(5): 897−900.
[10]Tee T W, Khan R M. Removal of lead, cadmium and zinc by waste tea leaves[J]. Environ Technol Lett, 1988, 9(11):1223−1232.
[11]吕金顺, 姜春华, 王小芳, 等. 用PDF处理含Pb2+、Cu2+重金属离子废水的研究[J]. 甘肃科学学报, 2004, 16(3): 110−112.LU Jin-shun, JIANG Chun-hua, WANG Xiao-fang. The treatment of waste water containing heavy metal ions of Pb2+and Cu2+by PDF adsorption[J]. Journal of Gansu Sciences, 2004,16(3): 110−112.
[12]Shukla S S, Yu L J, Dorris K L, et al. Removal of nickel from aqueous solutions by sawdust[J]. Journal of Hazardous Materials,2005, 121(1/2/3): 243−246.
[13]张宝善, 伍晓红, 陈锦屏. 柿单宁研究进展[J]. 陕西师范大学学报: 自然科学版, 2008(1): 99−105.ZHANG Bao-shan, WU Xiao-hong, CHEN Jin-ping. Research progress of Kaki tannin[J]. Journal of Shanxi Normal University:Natural Science, 2008(1): 99−105.
[14]Parajuli D, Adhikari C R, Kawakita H, et al. Reduction andaccumulation of Au(Ⅲ) by grape waste: A kinetic approach[J].Reactive & Functional Polymers, 2008, 6(8): 1194−1199.
[15]Mack C, Wilhelm B, Duncan J R, et al. Biosorption of precious metals[J]. Biotechnology Advances, 2007, 25(3): 264−271.
[16]Şengil İ, Özacar M. Biosorption of Cu(II) from aqueous solutions by mimosa tannin gel[J]Journal of Hazardous Materials, 2008, 157(2/3): 277−285.
[17]Parajuli D, Kawakita H, Inoue K, et al. Persimmon peel gel for the selective recovery of gold[J]. Hydrometallurgy, 2007,87(3/4): 133−139.
[18]Nakajima A, Baba Y. Mechanism of hexavalent chromium adsorption by persimmon tannin gel[J]. Water Research, 2004,38(12): 2859−2864.
[19]XIONG Ying, Adhikari C R, Kawakita H, et al. Selective recovery of precious metals by persimmon waste chemically modified with dimethylamine[J]. Bioresource Technology, 2009,100(18): 4083−4089.
[20]Özacar M, Şengil İ, Türkmenler H.Equilibrium and kinetic data,and adsorption mechanism for adsorption of lead onto valonia tannin resin[J]. Chemical Engineering Journal, 2008, 143(1/2/3):32−42.
[21]Yurtsever M, Şengil İ. Biosorption of Pb(II) ions by modified quebracho tannin resin[J]. Journal of Hazardous Materials, 2009,163(1): 58−64.
[22]Oo C W, Kassim M J, Pizzi A. Characterization and performance of Rhizophora apiculata mangrove polyflavonoid tannins in the adsorption of copper (II) and lead (II)[J]. Industrial Crops and Products, 2009, 30(1): 152−161.
[23]Şengil İ, Özacar M, Türkmenler H. Kinetic and isotherm studies of Cu(II) biosorption onto valonia tannin resin[J]. Journal of Hazardous Materials, 2009, 162(2/3): 1046−1052.
[24]Cruz C C, Costa A C, Henriques C A, et al. Kinetic modeling and equilibrium studies during cadmium biosorption by dead Sargassum sp.biomass[J]. Biores Technol, 2004, 9l(3): 249−257.
