金莲花中荭草苷和牡荆苷小鼠体内抗氧化作用研究
2012-11-28王治宝贾晓坤
王治宝,袁 博,贾晓坤,安 芳
(1.河北北方学院药学系,河北 张家口075000;2.河北省张家口市中心血站,河北 张家口075000)
金莲花是毛茛科植物金莲花(TrolliuschinensisBunge)的干燥花及花蕾,临床上主要用其制剂来治疗上呼吸道感染、扁桃体炎[1]等。现代药物分析研究表明,金莲花中主要含有黄酮、多糖、色素、挥发油等化学成分。前期研究表明,金莲花总黄酮、荭草苷和牡荆苷体外具有清除超氧阴离子、羟基自由、DPPH能力以及对红细胞溶血的保护作用,荭草苷和牡荆苷在一定浓度范围内体外抗氧化作用均优于金莲花总黄酮,牡荆苷当其浓度大于2μg·mL-1时对羟基自由基的产生有促进作用[2-3]。研究表明,荭草苷和牡荆苷具有较强的体外抗氧化活性。药代动力学研究表明,静脉给药后,荭草苷和牡荆苷在兔体内肾脏中分布最多[4-5],进一步研究荭草苷和牡荆苷在动物体内的抗氧化作用,初步探讨其抗氧化的作用机制有积极意义。荭草苷和牡荆苷化学结构极其相似(图1),通过比较荭草苷和牡荆苷的体内抗氧化作用,以期筛选出抗氧化作用最佳药物的构效关系。
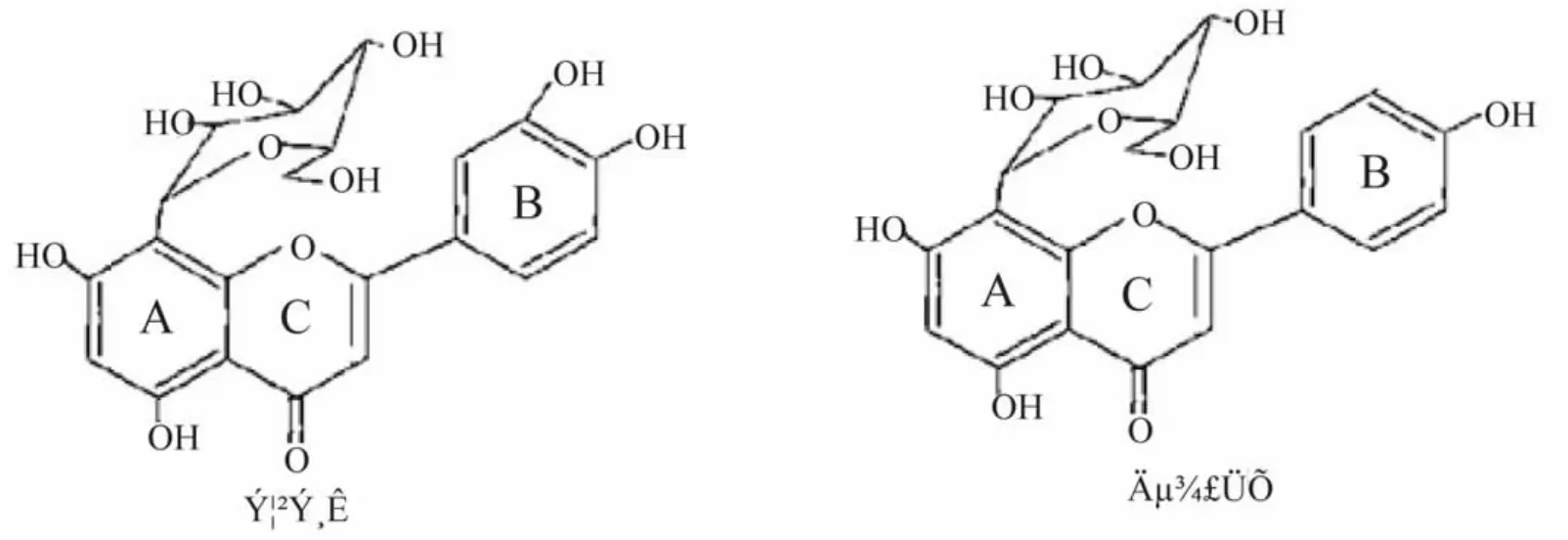
图1 荭草苷和牡荆苷结构
1 材料与方法
1.1 材料
1.1.1 药品和试剂 野生金莲花采自河北省张家口沽源,经河北北方学院药物研究所鉴定为金莲花(TrolliuschinensisBunge)。荭草苷和牡荆苷(自制,经1H-NMR和 HPLC鉴定纯度98.6%);SOD、CAT、GSH-PX、MDA测定试剂盒均购买自南京建成生物工程研究所(批号分别为:20100610、20100810、20100823、20101208);其它试剂均为分析纯。
1.1.2 动物 健康的昆明种小鼠70只(雌雄各半),河北北方学院动物中心提供(许可证号:SCXK京2004-0001),分笼饲养,室温18~25℃,湿度40%。
1.1.3 仪器 U-3900紫外可见分光光度计(日本);ME235S十万分之一电子天平(日本);DK-8型电热恒温水槽(上海精密实验设备有限公司);低温高速离心机(赛多利斯公司);HQ-60型旋涡混合器(北方同正生物技术发展公司)。
1.2 方法
1.2.1 给药与分组
荭草苷和牡荆苷溶液的配制:N,N-二甲基甲酰胺∶吐温-80∶生理盐水=1∶1∶20为溶剂,按要求配制不同浓度的荭草苷和牡荆苷溶液。分为正常对照组、荭草苷和牡荆苷高、中、低各三个剂量组,各组每日上午分别给药,正常对照组给等体积的荭草苷和牡荆苷溶剂(N,N-二甲基甲酰胺∶吐温-80∶生理盐水=1∶1∶20),每日一次。以临床维生素E给药剂量做标准,按人与小鼠体表面积换算,确定荭草苷和牡荆苷高、中、低剂量组为40mg·kg-1,20mg·kg-1,10mg·kg-1。每天称重一次,依据小鼠体重调整给药剂量,给药时间12d。
1.2.2 观察指标与方法
1.2.2.1 小鼠血清中SOD、CAT、GSH-PX的测定
给药12d后,d 13,小鼠断头取血,以4 000r·min-1离心10min,取血清按照试剂盒上说明操作,测定SOD、CAT、GSH-PX的含量。
1.2.2.2 小鼠组织中SOD、CAT、GSH-PX、MDA的测定
迅速取出肝、脑、肾组织于冰盘中,精确称量,用预冷的生理盐水制成10%的组织匀浆液,8 000r·min-1离心得上清液。取1.0mL的上清液,加入1.0mL乙醇-氯仿混合液(两者体积比为5∶3),震荡2min,4 000r·min-1离心5min以除去蛋白质,取上清液按试剂盒说明操作,测定SOD、CAT、GSH-PX的活性及MDA。
1.3 统计学方法
2 结 果
2.1 荭草苷和牡荆苷对小鼠血清SOD、CAT、GSH-PX的影响,见表1。
表1 荭草苷和牡荆苷对小鼠血清SOD、CAT、GSH-PX的影响(±s)

表1 荭草苷和牡荆苷对小鼠血清SOD、CAT、GSH-PX的影响(±s)
注:与对照组相比*P<0.05,**P<0.01;与荭草苷中剂量组相比△P<0.05;与荭草苷低剂量组相比#P<0.05
分组 n SOD(U·mL-1)CAT(U·mL-1)GSH-PX(U·μL-1)10 47.22±8.1 69.15±16.42 1.63±0.08荭草苷高剂量组 10 86.81±6.7** 112.28±13.56** 4.79±0.07**荭草苷中剂量组 10 73.10±6.4** 99.47±11.24** 4.04±0.06**荭草苷低剂量组 10 60.98±6.2** 85.39±12.75** 3.75±0.08**牡荆苷高剂量组 10 83.97±7.0** 109.20±13.91** 4.59±0.07**牡荆苷中剂量组 10 62.04±5.0**△ 86.34±10.27**△ 3.02±0.06**△牡荆苷低剂量组 10 55.26±6.1*# 76.15±11.20*# 2.25±0.08*#对照组
与正常组相比,荭草苷牡荆苷各给药组均具有提高小鼠血清SOD、CAT、GSH-PX的作用,差异有显著性(P<0.05,P<0.01)。
荭草苷中、低剂量组提高小鼠血清SOD、CAT、GSH-PX的作用高于牡荆苷同等剂量组,差异有显著性(P<0.05),荭草苷和牡荆苷高剂量组相比差异无显著性(P>0.05)。
2.2 荭草苷和牡荆苷对小鼠肝、脑、肾、SOD、CAT、GSH-PX、MDA的影响,结果见表2、表3。
表2 荭草苷和牡荆苷对小鼠肝、脑、肾中SOD、CAT的影响(±s)

表2 荭草苷和牡荆苷对小鼠肝、脑、肾中SOD、CAT的影响(±s)
注:与对照组相比*P<0.05,**P<0.01;与荭草苷中剂量相比△P<0.05;与荭草苷低剂量组相比#P<0.05
分组 n SOD(U·mL-1)CAT(U·mL-1)肝脑肾肝脑肾0.83 6.02±0.91 8.208±0.91荭草苷高剂量组10 127.24±7.82** 147.36±7.12** 134.76±6.02** 9.20±0.78** 9.84±0.71** 12.48±0.60**荭草苷中剂量组10 111.23±7.06** 129.36±7.04** 117.36±7.59* 8.23±0.71** 8.94±0.70** 10.24±0.76**荭草苷低剂量组10 102.14±8.07* 119.36±6.89* 112.32±6.34* 7.71±0.81* 7.96±0.68* 9.64±0.64*牡荆苷高剂量组10 124.01±7.72** 138.36±8.01** 127.24±6.86** 8.90±0.78** 9.34±0.71** 11.78±0.61**牡荆苷中剂量组10 100.23±6.76*△ 119.36±7.06*△ 110.36±7.63*△ 7.93±0.69*△ 7.94±0.68*△ 9.24±0.72*△牡荆苷低剂量组10 95.14±7.77# 111.36±7.67# 102.32±6.55# 6.71±0.86# 6.86±0.76*# 8.62±0.70*#对照组 10 92.17±8.26 110.24±9.08 100.08±9.15 6.52±
表3 荭草苷和牡荆苷对小鼠肝、脑、肾中GSH-PX、MDA的影响(±s)

表3 荭草苷和牡荆苷对小鼠肝、脑、肾中GSH-PX、MDA的影响(±s)
注:与对照组相比*P<0.05,**P<0.01;与荭草苷中剂量组相比△P<0.05;与荭草苷低剂量组相比#P<0.05
分组 n GSH-PX(U·μL-1)MDA(nmol·mL-1)肝脑肾肝脑肾.26 8.48±2.37 15.17±3.64荭草苷高剂量组10 49.88±1.16** 33.34±1.69** 53.42±1.96** 9.35±2.58** 5.22±3.76** 8.10±3.09**荭草苷中剂量组10 42.32±1.18** 27.40±1.37** 45.24±1.04** 10.71±2.02** 6.25±2.63** 11.56±2.54**荭草苷低剂量组10 37.93±1.20* 23.56±2.14* 40.21±1.94* 12.32±4.01* 7.69±3.59* 13.65±3.65*牡荆苷高剂量组10 47.57±0.94** 33.02±2.03** 52.46±1.02** 9.69±3.61** 6.01±3.24** 8.96±2.58**牡荆苷中剂量组10 37.16±1.06*△ 22.93±1.97*△ 39.926±1.65*△ 11.24±2.97*△ 7.03±3.06*△ 12.87±3.52*△牡荆苷低剂量组10 36.04±1.68*# 20.96±1.21*# 31.64±1.29*# 13.04±2.43*# 7.45±2.52*# 11.46±2.83*#对照组 10 32.46±1.10 16.58±2.05 34.56±1.12 15.52±3
与正常组相比,荭草苷和牡荆苷各给药组均具有提高小鼠肝、脑、肾组织中SOD、CAT、GSH-PX含量,明显降低MDA含量,差异具有显著性(P<0.01)。
荭草苷中、低剂量组提高小鼠肝、脑、肾组织中SOD、CAT、GSH-PX的作用和降低MDA的作用高于牡荆苷中、低剂量组,差异具有显著性(P<0.05);荭草苷与牡荆苷的高剂量组差异无显著性。
3 讨 论
在正常代谢情况下,机体产生和清除自由基处于一种动态平衡中,内源性的清除自由基的酶系有SOD、CAT、GSH-PX等,外源性的清除剂有维生素E、维生素C以及从植物提取出的黄酮类等化合物。SOD可以催化超氧阴离子自由基的歧化反应,产生破坏能力相对较低的H2O2,而CAT和GSH-PX能将H2O2分解成H2O和O2,减轻或阻断脂质过氧化作用的一级引发作用,保护机体免受过氧化氢的侵害,延缓细胞的衰老,从而预防自由基导致的疾病的发生[6]。根据自由基学说,适当补充外源性自由基清除剂,增强肌体自由基防御系统能力,即可达到抗衰老的目的。MDA是氧自由基引起细胞膜不饱和脂肪酸脂质过氧化损伤的终产物,是极其活泼的交联剂,能与蛋白质、核酸等交联,从而使细胞变性甚至失活,MDA可反映机体内过氧化程度,间接反映出细胞的受损程度[7]。
本实验结果表明荭草苷和牡荆苷在提高机体内SOD、CAT、GSH-PX的活性方面发挥较好的作用,且荭草苷和牡荆苷均能降低组织内的MDA的含量,提示荭草苷和牡荆苷可能通过直接清除体内氧自由基,激活抗氧化酶系的防御系统等作用,提高机体的抗氧化能力,减少自由基对机体的损伤,从而起到延缓衰老的作用。其中荭草苷中、低剂量组提高机体抗氧化酶和降低组织MDA的作用分别比牡荆苷中、低剂量组的作用强,这与文献所说B环上具有邻二酚羟基的黄酮抗氧化活性要比B环上连有一个酚羟基的黄酮抗氧化性强相一致[8]。
[1]江苏新医学院.中药大辞典(上册)[M].上海:上海人民出版社,1977:1398.
[2]颜娟,胡海娜,田嘉铭,等.金莲花中总黄酮抗氧作用的研究 [J].时珍国医国药,2010,26(2):20-22.
[3]杨国栋,饶娜,田嘉铭,等.金莲花中荭草苷和牡荆苷的抗氧作用研究 [J].时珍国医国药,2011,22(9):110-111.
[4]曲彩红.金莲花中荭草苷兔体内药代动力学研究 [D].河北北方学院.2010.
[5]颜娟.金莲花中牡荆苷兔体内药代动力学研究 [D].河北北方学院.2010.
[6]Wang H,Joseph JA.Structure-activity relationships of quercetin antagonizing hydrogen peroxide-induced calcium dysregulation in PC12cells [J].Free Radic Biol Med,1999,27(5-6):683-694.
[7]Gawel S,Wardas M,Niedworok E,et al.Malondialdehyde(MDA)as a lipid peroxidation marker[J].Wiad Lek,2004,57(9-10):453-455.
[8]刘利华,宛晓春.黄酮类化合物抗氧化活性构效关系的研究进展 [J].安徽农业大学学报,2002,29(3):265-267.
