阳和汤对裸鼠移植性乳腺癌骨转移模型作用机制的探讨
2012-11-26王云丹黄立中田雪飞许利纯伍参荣彭吉勇
田 莎,王云丹,黄立中,田雪飞,许利纯,伍参荣,彭吉勇
(1.湖南中医药大学中西医结合学院,湖南 长沙410208;2.长沙市中医院,湖南 长沙410100)
乳腺癌是女性最常见的恶性肿瘤之一,而骨转移又是乳腺癌常见的并发症,其临床主要表现为进行性骨痛、骨折、功能障碍、脊索及神经根受压、贫血、高钙血症,严重影响患者的生活质量,危及生命[1-2]。黄立中教授运用阳和汤加味治疗骨转移癌疼痛取得较好疗效[3-4]。本实验探讨名方阳和汤对裸鼠移植性乳腺癌骨转移模型的作用,以及对模型鼠血清甲状旁腺激素相关蛋白 (PTHrP)、NF-KB 配体的受体(RANKL)、骨保护素(OPG)含量的影响,揭示阳和汤体内抗癌作用的分子机制,为临床治疗乳腺癌骨转移提供科学的理论依据。现将实验方法及结果报道如下。
1 材料与方法
1.1 材料
1.1.1 动物 BALB/c 6~8 周龄裸小鼠,SPF 级,体质量18~22 g,雌性,购于湖南斯莱克景达实验动物有限公司,动物合格证号:SCXK(湘)2009-2004。
1.1.2 药物 阳和汤由熟地黄30 g、鹿角胶9 g、肉桂3 g、炮姜炭2 g、白芥子6 g、麻黄2 g、生甘草3 g 组成。购自湖南中医药大学第一附属医院药剂科,将药物制成高剂量水煎液 (1 mL 药液中含1.17 g 生药)、低剂量水煎液(1 mL 药液中含0.39 g生药),密封备用。唑来磷酸,正大天晴药业,规格4 mg/5 mL,批号0908272。
1.1.3 瘤株 人乳腺癌细胞株MDA-MB-231,购于中南大学湘雅医学院现代实验中心细胞库。
1.1.4 试剂PTHrP ELISA kit,批号:E0900100226;RANKL ELISA kit,批号 :E0900100101;OPG ELISA kit,批号:E0900613;均购自长沙市佳和生物科技有限责任公司(美国INVITROGEN 公司生产)。
1.1.5 仪器 超净工作台:SW-CJ-1CV,苏净安泰公司;CO2培养箱:SHEL-LAB,美国Hitachi;酶标仪:奥地利TECAN;台式离心机:TDZ5-40,长沙天创仪器公司;恒温水浴箱:GG112-10B,上海医疗器械厂;恒温干燥箱:101B-2,上海亚明公司;自动酶标仪:奥地利TECAN;37 ℃恒温箱:GG112-10B,上海医疗器械厂。
1.2 方法
1.2.1 动物分组 将成瘤后的裸鼠移植性乳腺癌骨转移模型随机分为4 组:阳和汤高剂量组、阳和汤低剂量组、唑来磷酸组、模型组,每组8 只。另取8 只裸鼠股骨注射生理盐水(其他手术方法同“1.2.2”)设为假手术组。
1.2.2 动物造模 裸鼠腹腔注射10%水合氯醛(4 mL/kg) 麻醉后,75%乙醇消毒裸鼠皮肤,1 mL 注射器抽取2×107个/mL 人乳腺癌细胞悬液0.08 mL(约含1.6×106个乳腺癌细胞),从股骨远端进针,平行经皮下,至股骨近端骨质疏松处刺透骨皮质,然后将针尖插入骨干内,缓慢推注细胞悬液(0.08 mL/只),接种完成。
1.2.3 给药方法 阳和汤高、低剂量组:每天灌胃阳和汤23.40 g/(kg·d)(相当于阳和汤临床剂量3 倍)、7.80 g/(kg·d)(相当于阳和汤临床剂量),连续给药20 d;唑来磷酸组:取浓度为3 μg/mL 唑来膦酸稀释液腹腔注射,按30 μg/kg。阳和汤用药开始日设为第1 天,第5、7、9、12、14、16、19 天,每天每只1 次[5];模型组、假手术组:取生理盐水0.4 mL 灌胃,每天每只1 次,连续给药20 d。给药剂量均按60 kg 成年人体表面积换算。
1.2.4 肿瘤大小 造模术后第5、10、15、20、25 天用游标卡尺体外测量骨转移癌灶的长径 (a) 及短径(b),按公式V(mm3)=ab2π/6 计算骨转移癌的体积。根据肿瘤体积的变化绘制各组的骨转移癌生长曲线。
1.2.5 抑瘤率 公式:抑瘤率=(模型组平均瘤重-给药组平均瘤重)/模型组平均瘤重×100%,计算肿瘤的生长抑制率。
1.2.6 指标测定 采用ELISA 法检测各组裸鼠血清中相关调节因子PTHrP、RANKL、OPG 含量。
1.3 统计学分析
2 结果
2.1 裸鼠移植人乳腺癌骨转移模型的复制
股骨接种人乳腺癌细胞5 d 后32 只裸鼠股骨接种处陆续出现可触及的结节。实验结束后,种瘤处组织的HE 染色切片置于光镜下观察,均发现骨组织完全破坏,被癌组织代替。证实乳腺癌骨转移模型复制成功(见图1)。
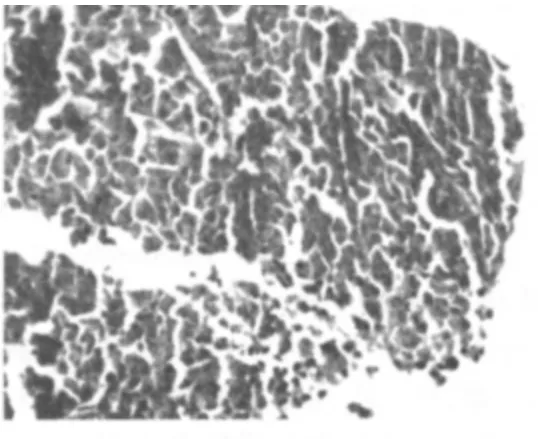
图1 接种乳腺癌细胞25 d 后,裸鼠接种处组织形态(HE 染色×200)
2.2 阳和汤对各组裸鼠骨转移癌生长的影响
根据各组裸鼠骨转移癌的生长情况绘制生长曲线(见图2),与模型组比,给药各组对骨转移癌生长均产生不同程度的抑制作用。其中阳和汤高剂量组和唑来磷酸组骨转移癌生长缓慢,抑制作用优于阳和汤低剂量组。
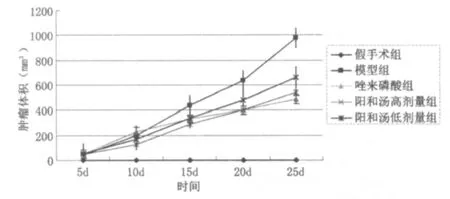
图2 各组裸鼠骨转移癌生长曲线
2.3 阳和汤对各组裸鼠移植人乳腺癌骨转移瘤抑瘤率的影响
结果显示唑来磷酸组、阳和汤高、低剂量组的骨转移癌抑制率分别为50.61%、45.05%、32.42%。阳和汤高、低剂量组、唑来磷酸组的骨转移瘤质量与模型组相比,差异有统计学意义(P<0.05),见表1。
表1 阳和汤对各组裸鼠移植人乳腺癌骨转移瘤质量的影响(±s,n=8)
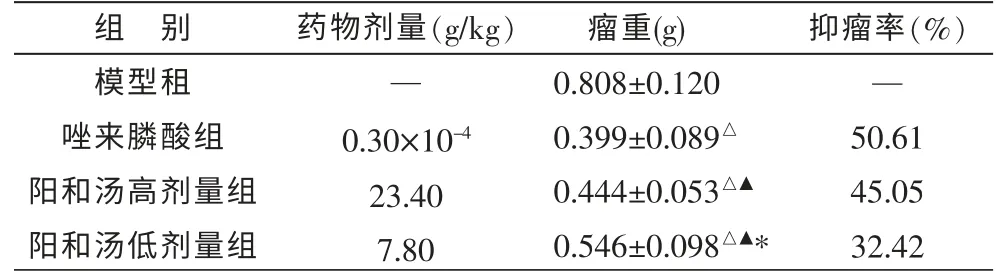
表1 阳和汤对各组裸鼠移植人乳腺癌骨转移瘤质量的影响(±s,n=8)
注:与模型组比较△P<0.05;与唑来磷酸组比较▲P<0.05;与阳和汤高剂量组比较*P<0.05。
组 别模型租唑来膦酸组阳和汤高剂量组阳和汤低剂量组药物剂量(g/kg)—0.30×10-4 23.40 7.80瘤重(g)0.808±0.120 0.399±0.089△0.444±0.053△▲0.546±0.098△▲*抑瘤率(%)—50.61 45.05 32.42
2.4 阳和汤对裸鼠移植人乳腺癌骨转移血清PTHrP、RANKL、OPG、RANKL/OPG 的影响
根据各组PTHrP、RANKL、OPG 的浓度方差齐性的比较,用LSD 法进行组间比较,阳和汤高剂量组PTHrP 含量明显低于模型组(P<0.05),与假手术组、唑来磷酸组比较差异有统计学意义(P<0.05);阳和汤高剂量组对RANKL 的增殖抑制作用,其含量明显低于模型组,高于假手术组、唑来膦酸组,差异有统计学意义(P<0.05);阳和汤高剂量组OPG 含量明显高于模型组,低于假手术组、唑来膦酸组以及低剂量组,差异有统计学意义(P<0.05)。阳和汤高剂量组队对RANKL/OPG 比值的影响,明显高于模型组,低于假手术组、唑来磷酸组以及低剂量组,差异有统计学意义(P<0.05),见表2。
3 讨论
乳腺癌骨转移属中医“骨蚀”、“骨瘤”、“骨痹”、“骨疽”等范畴,骨转移癌局部肿块坚硬不移、疼痛、入夜尤甚、皮色不变、面色晦暗等临床特征,与“阴盛则寒、寒主收引、主凝滞、主痛”等中医理论相符,属阴寒证。推测阳虚可能是乳腺癌发生骨转移的促发因素。则可以通过温阳散寒的方法防治乳腺癌骨转移。
阳和汤出自清·王洪绪的《外科证治全生集》[6],是温阳散寒代表方。阳和汤方中重用熟地、鹿角胶为君,辅以炮姜炭、肉桂为臣,以麻黄、白芥子为佐,甘草为使药。全方共奏温阳补肾、散寒通滞之功。这是温阳养血散寒通滞的阳和汤治疗骨转移癌的理论依据。前期实验研究证明温阳散寒治法有一定抗癌、镇痛、提高肿瘤浸润淋巴细胞和树突状细胞功能[7]。长期临床观察发现,乳腺癌骨转移患者多有阳气不足、寒凝瘀滞状态,化疗后患者尤其明显,验之以温阳散寒通滞的阳和汤制剂,确对乳腺骨转移癌有显著疗效[8]。文献报道用阳和汤治疗骨肿瘤,多数骨转移癌患者疼痛减轻,服药期间原有病灶未见扩大及转移[9]。
乳腺癌骨转移动物模型是研究人乳腺癌骨转移的发病机制及其治疗措施的重要工具。在实验动物中,自发性的乳腺癌骨转移现象很少发生。目前,移植性乳腺癌骨转移动物模型复制方法有三:①局部注射法;②乳腺癌的原位种植;③血流播散法。采用骨组织局部注射法复制骨转移模型,这种方法简便易行,不受多脏器转移的影响。造模成功率高,模型结果也与临床上所见的骨转移状况相类似[10-11]。
表2 阳和汤对各组裸鼠移植人乳腺癌骨转移血清PTHrP、RANKL、OPG、RANKL/OPG 的影响 (±s,n=8)

表2 阳和汤对各组裸鼠移植人乳腺癌骨转移血清PTHrP、RANKL、OPG、RANKL/OPG 的影响 (±s,n=8)
注:与假手术组比较*P<0.05;与模型组比较△P<0.05;与唑来磷酸组比较▲P<0.05;与阳和汤高剂量组比较#P<0.05。
组 别假手术组模型组唑来膦酸组阳和汤高剂量组阳和汤低剂量组药物剂量(g/kg)— —0.30×10-4 23.40 7.80 PTHrP(ng/mL)44.72±6.26 86.54±15.58*64.14±8.95*△52.30±5.77△73.15±6.99*#RANKL(pg/mL)188.54±19.78 388.80±86.20*244.78±23.73*△331.59±47.81*▲297.30±30.67*▲OPG(pg/mL)289.85±39.76 95.65±10.40*202.31±12.74*△149.39±22.73*△▲124.37±7.61*△▲RANKL/OPG 0.66±0.13 4.07±0.85*1.21±0.12*△2.27±0.51*△▲2.39±0.22*△▲
正常的骨代谢是通过成骨细胞的成骨作用与破骨细胞的骨吸收作用进行调节,从而保持一种动态平衡[12]。在这个过程中,大量的相关因子参与其中,成为骨微环境主要部分。乳腺癌以溶骨性转移为主,它以骨组织的破坏吸收为特点,是破骨细胞直接作用的结果[13]。乳腺癌细胞、成骨细胞、破骨细胞和骨基质细胞共同参与这一过程。这些细胞分泌的相关因子在骨转移发生和发展中起重要作用。其中,肿瘤细胞产生的PTHrP 是主要的破骨细胞激活因子[14]。在肿瘤骨转移的过程中,起到正性调节作用[15]。PTHrP 刺激成骨细胞或基质细胞合成RANKL,通过未成熟破骨细胞表面的RANK 信号系统,RANKL 刺激转录因子起始转录,导致未成熟的破骨细胞分化为成熟的破骨细胞[16];并且同时抑制OPG 的合成。OPG 是RANKL 的无功能受体,它能与破骨细胞表面的RANK 竞争性结合RANKL,在体内、体外情况下均能抑制破骨细胞成熟和活化。目前认为RANKL/OPG 的比例是破骨细胞活性的决定因素之一[17-18]。成骨细胞和破骨细胞之间失去平衡,促进骨吸收作用。其主要作用机制为:骨溶解——释放生长因子——刺激肿瘤细胞增殖——PTHrP 等破骨细胞激活因子——通过RANKL/RANK 激活破骨细胞——骨溶解,形成恶性循环导致溶骨性转移的不断演进[13]。
在骨转移过程中,OPG 的表达量会很低,PTHrP和RANKL 的表达量增加,这样就促使骨转移的发生。而当促进或抑制相关调节因子的产生时,就能够在一定程度上抑制骨的转移。通过ELISA 法检测,发现阳和汤高、低剂量均对相关调节因子产生了调控作用:促进OPG 的表达,抑制PTHrP、RANKL的表达。其中尤以阳和汤高剂量应用效果最为明显。因此阳和汤抑制乳腺癌骨转移的作用和机制值得我们更深入研究。
[1]王凤良,凌立君,刘晓安,等.乳腺癌溶骨性骨转移机制的研究进展[J].国际外科学杂志,2006,33(3):216-219.
[2]蔡东焱,陶 敏.肿瘤骨转移机制研究进展[J].国际肿瘤学杂志,2006,33(6):459-462.
[3]黄立中,张晓明,何 欣.温阳止痛胶囊抗骨转移癌疼痛作用的疗效观察[J].中国中医药信息杂志,2004,11(3):197-198.
[4]黄立中,蒋益兰,曾松林,等.阳和汤加味治疗骨转移癌疼痛63 例[J].湖南中医学院学报,1997,17(1):20-21.
[5]Walker K,Medhurst SJ,Kidd BL,et al.Disease modifying and anti-nociceptive effects of the bisphosphonate,zoledronic acid in a model of bone cancer pain[J].Pain,2002,100(3):219-229.
[6]王维德.外科证治全生集[M].北京:人民卫生出版社,2002:35.
[7]何 欣,朱 婴,黄立中.温阳散寒补气养血法对非小细胞肺癌患者外周血树突状细胞影响的研究[J].中国中医急症,2007,16(11):1 308-1 310.
[8]黄立中,张晓明,何 欣.温阳止痛胶囊抗骨转移癌疼痛作用的疗效观察[J].中国中医药信息杂志,2004,11(3):197-198.
[9]郑翠娥,王晓红.阳和汤加减治疗骨肿瘤[J].山东中医杂志,1998,17(2):62.
[10]Rosol TJ,Tannehill Gregg SH,LeRoy BE,et al.Animal models of bone metastasis[J].Cancer.2003,97(3):748-757.
[11]Guarini S,Altavilla D,Cainazzo M,et a1.Efferent VagalFibre stimulationblunts nuclear factor -B activation and protects against hypovolemichemorrhagic shock[J].Circulation.2003,1(7):1 189.
[12]周宗枚.骨转移癌的治疗,临床肿瘤学[M].北京:人民卫生出版社,2002:370-372.
[13]吴晓徽,陆汉魁.骨代谢指标在肿瘤骨转移诊治中的应用[J].肿瘤,2007,6(27):505-507.
[14]Jemal A,Tiwari RC,Murray T,ct a1.Cancer statistics[J].Cancer J Clin,2004,54(1):8-29.
[15]Liao J,McCauley LK.Skeletal Metastasis:Established and Emerging Roles of Parathyroid Hormone Related Protein(PTHrP)[J].Cancer Metastasis Rev,2006,25(4):559-571.
[16]陈严严,李向阳,陈惟隽.骨代谢指标对肺癌骨转移诊断的意义[J].老年医学与保健,2008,3(14):187-189.
[17]Mikami S,Katsube K,Oya M,et al.Increased RANKL expression is related to tumour migration and metastasis of renal cell carcinomas[J].J Pathol,2009(218):530-539.
[18]Fili S,Karalaki M,Schaller B.Mechanism of bone metastasis:the role of osteoprotegerin and of the host -tissue microenvironment-related survival factors [J].Cancer Lett,2009,28(1):10-19.
