miR-214对人肺癌A549细胞增殖和侵袭能力的影响
2012-11-26林述琨王耀鹏温吉海
林述琨 王耀鹏 温吉海
1.大连,普兰店市中心医院病理科;2.普兰店市中心医院肺外科
肺癌是对人类生命威胁最大的恶性肿瘤之一。 早期研究表明在部分人类癌症发病机制中MicroRNA(miRNA)的改变可能参与调控[1]。小分子RNA(miRNAs)是一种内源性的单链非编码RNA,成熟miRNA主要通过与靶基因的3UTR区特异结合来抑制靶基因的转录和翻译过程,引起靶基因mRNA发生降解或翻译受到抑制,进而发挥其生物学功能[2]。miRNA被认为在多种细胞过程中发挥关键作用如扩散、生长、分化与细胞凋亡[3,4]。近年来越来越多的研究发现miRNA在乳腺癌、 胃癌、直肠癌及白血病等许多恶性肿瘤的发生过程起着癌基因及抑癌基因作用。但对于miRNA在肺癌发病机制中的作用还知之甚少[5]。本研究构建了miR-214的真核表达载体,并将其转染人肺癌A549细胞,以探讨其对A549细胞增殖和侵袭能力的影响。
1 材料和方法
1.1 细胞培养和转染人肺腺癌细胞株A549,用含有10%新生牛血清,100 U/ml的青霉素和100 U/ml的链霉素的DMEM培养液在37℃、5%CO2饱和湿度条件下培养。当细胞生长至对数生长期后,按照lipo2000(Invitrogen公司)说明书的方法进行转染。细胞转染48h后进行后续相关实验。
1.2 Real-time PCR用Trizol(Invitrogen公司)提取细胞总RNA后反转录为cDNA(Takara)。miR-214的反转录引物为5′-GTC GTA TCC AGT GCA GGG TCC GAG GTA TTC GCA CTG GAT ACG ACA CTG CC-3′;real-time PCR引物序列:上游引物5′- GGA CAG CAG GCA CAG ACA-3′,下游引物5′- CAG TGC AGG GTC CGA GGT-3′。以U6为内参,反转录引物序列为5′-GTC GTA TCC AGT GCA GGG TCC GAG GTA TTC GCA CTG GAT ACG ACA AAA TAT GGA AC-3′;real-time PCR引物序列:上游引物5′-TGC GGG TGC TCC GCT TCG GCA GC-3′,下游引物5′-CAG TGC AGG GTC CGA GGT-3′。使用SYBR Green(Takara)染料法进行反应,95 ℃预变性10min,95℃变性5s,60℃退火34s,74℃荧光检测3s,共40个循环。以2–ΔΔCt值比较两者之间的差异。每组重复设置3个复孔。
1.3 miR-214表达质粒构建根据miR-214前体在GenBank中的序列,设计PCR引物,引物序列为:Forward:5'-CTG TTA CGC AAA TTA TCC ATG TT-3',Reverse:5'-AAT GGG TTT TAT TAT ATT TCA TA -3'(引入HindⅢ和XhoⅠ 酶切位点),目的片段亚克隆到pCDNA3.1(+)上,经测序和Real-time PCR验证。
1.4 MTT法取对数生长期的A549细胞,0.25%胰酶消化细胞,用含有10%新生牛血清的RPMI 1640完全培养液终止消化,调整细胞密度为2×105个/ml,制备单细胞悬液。各取500μl接种于24孔板中,待细胞融合度达80%时,进行转染,每组设3个平行复孔。细胞转染24h后,用1ml培养液悬浮细胞,稀释5倍后接种于96孔板(每组设6个重复),分别于接种后24、48、72h和96h,每孔加入20μl MTT(5mg/ml),继续培养4h后,弃上清液,加入DMSO100μl/孔,振荡处理溶解结晶紫,在酶联免疫检测仪570nm处测吸光度(OD)值。
1.5 Transwell小室将A549细胞培养于12孔板,在细胞融合度达80%时进行转染。细胞转染6h后更换为完全培养液, 继续培养18h,然后用0.25%的胰酶消化细胞,加入2ml完全培养液终止消化,离心后用Opti-MEM调整细胞密度为3×105个/ml的单细胞悬液。取100μl单细胞悬液移至上室内,下室中加入600μl含10%新生牛血清的 RPMI 1640培养液,置于37℃、CO2体积分数为5%培养箱内培养48h,每组设3个平行复孔。取出小室,移走上室内的培养液,用灭菌的棉棒将上室内的细胞轻轻刮掉,置于0.1%结晶紫染色液中染色30min,取出小室,在蒸馏水中将其漂洗3次。倒置显微镜下观察通过小室基膜的细胞并计数。
1.6 统计学方法应用SPSS13.0统计学软件进行统计学分析。采用t检验进行两样本间比较,P<0.05为差异有统计学意义。
2 结果
2.1 成功构建miR-214 真核表达质粒重 组 质 粒pcDNA 3.1(+)-miR-214经HindⅢ和XhoⅠ双酶切后,电泳结果显示得到2个片段,分别为534bp的miR-214和5405bp的线性pcDNA3.1(+)载体 ,结果与理论值相符合(见图1)。
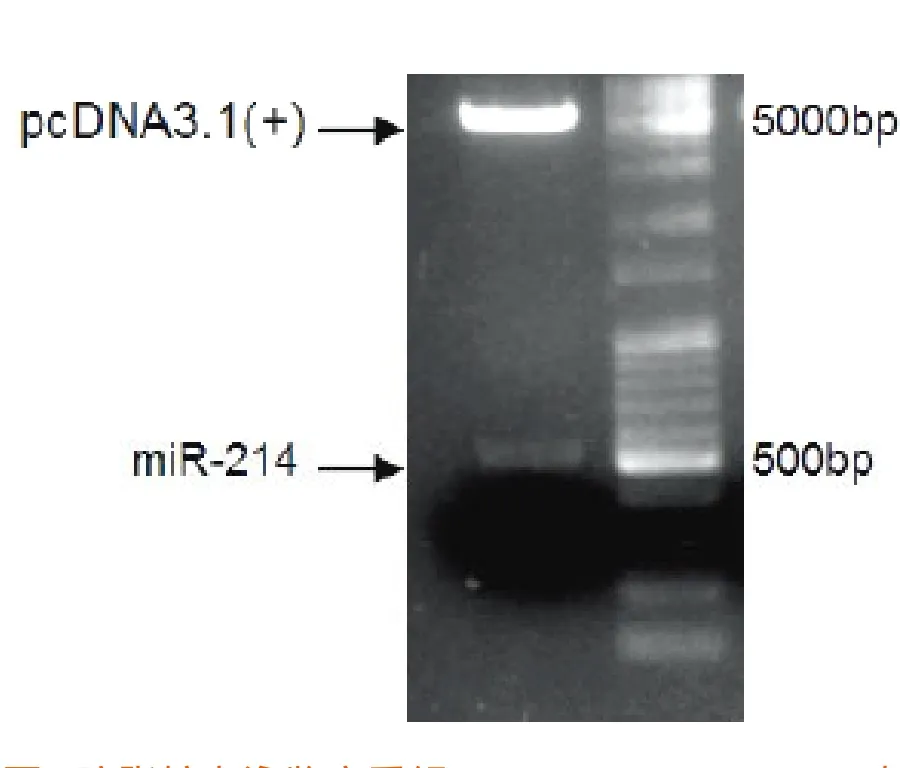
图1 琼脂糖电泳鉴定重组pcDNA3.1(+)-miR-214真核表达载体

图2 Real-time PCR法鉴定miR-214表达
2.2 pcDNA3.1(+)-miR-214转染A549细胞后miR-214过表达Real-time PCR检测结果显示pcDNA3.1(+)-miR-214转 染 组,与 pcDNA3.1(+)空载体转染组和空白对照组相比,pcDNA3.1(+)-miR-214 转染组 中miR-214的mRNA的表达量明显增加 (P<0.01),见图2。表明构建获得的重组表达载体pcDNA3.1(+)-miR-214能够在人A549细胞中高水平地表达miR-214。
2.3 miR-214对A549细胞增殖能力的影响MTT法检测结果提示,在24h、48h、72h和96h时,转染pcDNA3.1(+)-miR-214重组质粒组细胞的增殖速度明显的低于pcDNA3.1(+)空载体组和空白对照组(blank control),差异有统计学意义(P<0.05),见图3。
2.4 MiR-214对A549细胞侵袭能力的影响通过transwell小室比较A549细胞在转染pcDNA3.1(+)-miR-214后细胞侵袭能力的改变,结果显示,转染重组质粒pcDNA3.1(+)-miR-214组穿膜细胞数为(57.67±7.02)个/视野,而pcDNA3.1(+) 空载体组和空白对照组穿膜细胞数分别为(182±15.4)个/视野和(178±24.97)个/视野(见图4),转染重组质粒pcDNA3.1(+)-miR-214组 与 pcDNA3.1(+)空载体组和空白对照组相比,穿膜细胞数明显减少,差异具有统计学意义(P<0.05)。以上结果表明,miR-214能够抑制A549细胞的侵袭能力。

图3 MTT法检测细胞增殖能力


图4 Transwell小室检测A549细胞侵袭能力(×200),*P<0.05
3. 讨论
肺癌是我国发病率和死亡率增长最快的恶性肿瘤,转移和复发是患者死亡的主要原因。近年的研究表明,microRNA与多种肿瘤的发生、发展和远处转移密切相关;在多种肿瘤的发生过程中起到癌基因和抑癌的作用。研究报道miR-214肝癌、宫颈癌和乳腺癌中低表达,miR-214可以抑制乳腺癌的侵袭和转移[6-9]。然而,迄今为止miR-214在肺癌中的作用未见报道。
本研究首先构建了pcDNA3.1(+)-miR-214重组质粒,该方法能够较好地模拟体内miRNAs成熟的过程;该载体在多克隆位点上游有CMV启动子,依赖于polymeraseⅡ,有较强的活性,是真核过表达最常用的启动子,具有较强的转录活性,能够使插入的目的基因稳定表达;Amp+和neo+抗性基因便于进行构建和G418筛选,建立稳定表达的细胞系[14]。与病毒载体[15]相比,其操作过程相对简便,一般的实验条件即可完成。
为了检测重组质粒转染A549细胞后是否能够高表达miR-214,本研究首先通过real-time PCR检测A549细胞转染重组质粒pcDNA3.1(+)-miR-214、空载体pcDNA3.1(+)和空白对照组中miR-214表达。结果显示转染pcDNA3.1(+)-miR-214后A549细胞内miR-214过表达。
我们进一步研究了miR-214在肺癌A549细胞中的功能。研究发现miR-214可明显影响A549细胞的增殖能力,这种增殖能力的改变是否引起细胞周期的改变,是否对肿瘤细胞的进程起到抑制作用,将有待进一步深入研究。本研究还发现,miR-214过表达能够明显抑制A549细胞的侵袭能力,这可能是由于miR-214的过表达引起细胞内肿瘤转移相关基因表达水平改变所致。目前研究认为,以上这些生物学功能的改变多是miR-214引起其靶基因的改变所致;本课题组将在下一步的研究中进一步探讨。总之,本研究结果表明,miR-214具有抑制A549细胞的增殖和侵袭能力改变,是肺癌生物治疗中的一个可能的候选靶点。
[1] Hiyoshi Y,Kamohara H,Karashima R,et al.MicroRNA-21 regulates the proliferation and invasion in esophageal squamous cell carcinoma[J].Clin Cancer Res,2009,15(6):1915-1922.
[2] Bartel DP.MicroRNAs:genomics,biogenesis,mechanism and function[J].Cell,2004,16(2):281-297.
[3] Agrawal R,Tran U,Wessely O.The miR-30 miRNA family regulates Xenopus pronephros development and targets the transcription factor Xlim1/Lhx1[J].Development,2009,136(23):3927-3936.
[4] Venugopal SK,Jiang J,Kim TH,et al.Liver fibrosis causes downregulation of miRNA-150 and miRNA-194 in hepatic stellate cells and their overexpression causes decreased stellate cell activation[J].Physiol Gastrointest Liver Physiol,2010,298(1):G101-106.
[5] Osada H,Takahashi T.MicroRNAs in biological processes and carcinogenesis[J].Carcinogenesis,2007,28(1):2-12.
[6] C.C.Wong,C.M.Wong,E.K.Tung,et al.The microRNA miR-139 suppresses metastasis and progression of hepatocellular carcinoma by down-regulating Rho-kinase 2[J].Gastroenterolo gy,2011,140(1):322–331.
[7] Wang Y,Lee AT,Ma JZ,et al.Profiling microRNA expression in hepatocellular carcinoma reveals microRNA-224 up-regulation and apoptosis inhibitor-5 as a microRNA-224-specific target[J].J Biol Chem,2008,283 (19):13205–13215.
[8] Yang Z,Chen S,Luan X,et al.MicroRNA-214 is aberrantly expressed in cervical cancers and inhibits the growth of HeLa cells[J].IUBMB Life,2009,61(11):1075–1082.
[9] Derfoul A,Juan AH,Difilippantonio MJ,et al.Decreased microRNA-214 levels in breast cancer cells coincides with increased cell proliferation,invasion and accumulation of the Polycomb Ezh2 methyltransferase[J].Carcinogenesis,2011,32 (11):1607–1614.
[10] SCHRATT GM,TUEBING F,NIGH EA,et al.A brainspecific microRNA regulates dendritic spine development[J].Nature,2006,439(7074):283-289.
[11] HUANG Q,GUMIREDDY K,SCHRIER M,et al.The microRNAs miR-373 and miR-520c promote tumour invasion and metastasis[J].Nat Cell Biol,2008,10(2):202-210.
