Mir-181 a通过靶向c-fos基因抑制肺癌细胞迁移
2012-07-26林述琨温吉海王耀鹏
林述琨 温吉海 王耀鹏
1.大连普兰店市中心医院病理科;2.普兰店市中心医院肺外科
MicroRNA(miRNAs)是一类在生物体内普遍存在的单链非编码蛋白质小分子RNA,研究表明,它们可以特异性识别靶基因mRNA的3’UTR并与之结合,引起靶mRNAs发生降解或翻译受到抑制[1,2]。近年来研究发现,miRNA在多种人类肿瘤的发生、发展中起癌基因或抑癌基因的作用[3,4]。Chen等[5]研究表明,miR-181a可以作用于凋亡相关Bcl-2蛋白,增加胶质瘤细胞U87MG对放疗的敏感性;同时也有研究表明,miR-181在EpCAM(+)AFP(+)的肝癌中的表达水平明显的升高,且与预后不良相关[6]。MiR-181在肺癌中的研究目前尚未见报道。本研究通过transwell小室、生物信息学预测及双荧光素酶报告基因等方法,探讨miR-181a对肺癌细胞迁移的影响及其调控机制。
1 材料和方法
1.1 细胞培养和转染 人肺腺癌细胞株A549,用含有10%新生牛血清,100U/ml的青霉素和100U/ml的链霉素的DMEM培养液在37℃、5%CO2饱和湿度条件下培养。当细胞生长至对数生长期后,按照lipo2000(Invitrogen公司)说明书的方法进行转染。细胞转染48h后提取细胞总RNA和蛋白进行后续相关实验。
1.2 Real-time PCR 用Trizol(Invitrogen公司)提取细胞总RNA后反转录为cDNA(Takara)。miR-181a的反转录引物为5′-GTC GTA TCC AGT GCA GGG TCC GAG GTA TTC GCA CTG GAT ACG ACA CTC ACC-3′;real-time PCR引物序列:上游引物5′- GCC GAA ACA TTC AAC GCT CTC -3′,下游引物5′-CAG TGC AGG GTC CGA GGT -3′。以U6为内参,反转录引物序列为5′-GTC GTA TCC AGT GCA GGG TCC GAG GTA TTC GCA CTG GAT ACG ACA AAA TAT GGA AC-3′;real-time PCR引物序列:上游引物5′-TGC GGG TGC TCC GCT TCG GCA GC-3′,下游引物5′-CAG TGC AGG GTC CGA GGT-3′。使用SYBR Green(Takara)染料法进行反应,95℃预变性10min,95℃变性5s,60℃退火34s,74℃荧光检测3s,共40个循环。以2–ΔΔCt值比较两者之间的差异。每组重复设置3个复孔。
1.3 双荧光素酶报告基因检测 应用生物信息学预测软件对 miR-181a 进行靶基因预测,选c-fos为候选靶基因,以基因组DNA为模版,扩增包括miR-181a 结合位点在内的c-fos 3'UTR区,克隆到 pMir-Report报告基因载体的(Ambion公司)HindⅢ和 SpeI 酶切位点之间,重组载体命名为pMIR-c-fos。对pMIR-c-fos重组质粒“种子区”进行定点突变,突变后的质粒命名为pMIR-c-fos-Mut。所有构建的表达质粒均经双酶切和测序鉴定。A549细胞在24 孔板中培养,细胞融合度为80 %左右时进行转染,转染分组为:miR-181a mimic+pMIR-c-fos组、miR-181a nc+pMIR-cfos、miR-181a mimic+pMIR-c-fos-Mut组和miR-181a nc+pMIR-c-fos-mut,每组设3 个复孔。转染后继续培养48 h,加入裂解液(100μl/孔),离心并收集上清至96孔板中,每孔中加入40μl萤火虫荧光素酶底物,混匀10s 后检测荧光强度;然后再加入40μl海肾荧光素酶底物,混匀 10 s 后检测荧光强度。将萤火虫荧光素强度值/海肾荧光素强度值进行标准化校正。
1.4 Western blot 检测c-fos蛋白表达水平 用RIPA细胞裂解液(含有0.1% 的PMSF)冰上裂解细胞20min,收集于1.5mL EP 管中,离心后上清液转移至无菌EP管中,BCA法测定蛋白浓度。取等量蛋白在SDS-PAGE中电泳,转移到PVDF 膜上;5% 脱脂奶粉4℃过夜封闭,用c-fos的兔抗人单克隆一抗(1:1000)室温下孵育2h(cell signal),再用过氧化物酶标记的羊抗兔二抗(1:5000)室温下孵育2h,以β-actin 为内参,用Image J软件分析蛋白条带总灰度值,检测表达差异。
1.5 Transwell小室检测细胞迁移能力 将A549细胞培养于12孔板,在细胞融合度达80%时进行转染。细胞转染6h后更换为完全培养液, 继续培养18h,然后用0.25% 的胰酶消化细胞,加入2ml完全培养液终止消化,离心后用Opti-MEM调整细胞密度为3×105个/mL的单细胞悬液。取100μl单细胞悬液移至上室内,下室中加入600μl含10%新生牛血清的 RPMI 1640培养液,置于37 ℃、CO2体积分数为5%培养箱内培养16 h,每组设3个平行复孔。取出小室,移走上室内的培养液,用灭菌的棉棒将上室内的细胞轻轻刮掉,置于0.1%结晶紫染色液中染色30 min,取出小室,在蒸馏水中将其漂洗3次。倒置显微镜下观察通过小室基膜的细胞并计数。
1.6 统计学方法 应用SPSS 13.0统计学软件进行统计学分析。采用t检验进行两样本间比较,P<0.05为差异有统计学意义。
2 结果
2.1 Real-time检测miR-181a表达 Real-time PCR检测结果显示miR-181a mimic 转染组(mi),与空白对照组(nc)相比,mi组中miR-181a的mRNA的表达量明显增加(P<0.01,见图1),表明转染miR-181a mimic后A549细胞中miR-181a表达明显增加。

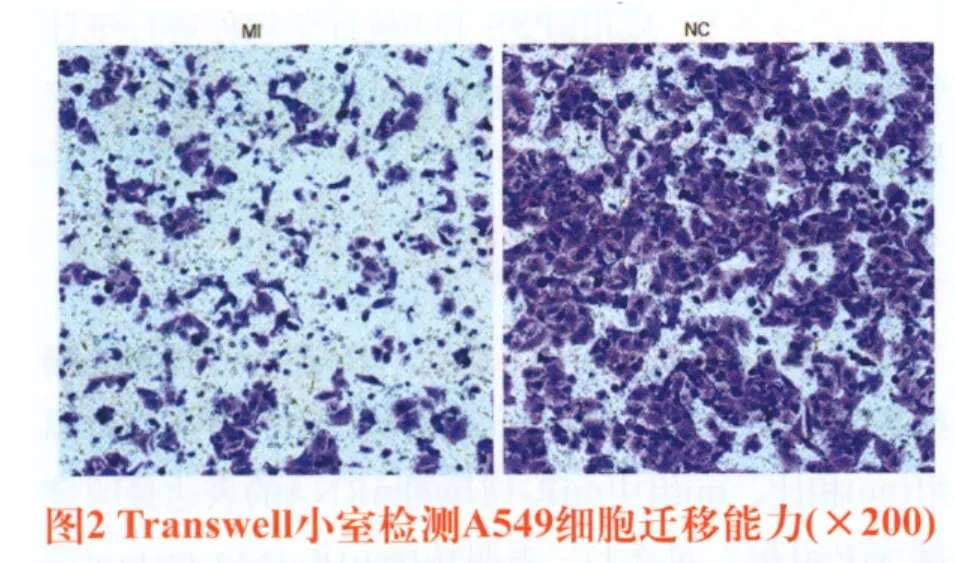
2.2 MiR-181a对A549细胞迁移能力的影响 Transwell小室检测A549细胞在转染miR-181a mimic后细胞迁移能力的改变,结果显示,转染miR-181a mimic组(MI)穿膜细胞数为291.6±17.02个/视野,而空白对照组(NC)穿膜细胞数分别为191±13.1个/视野(见图2),转染miR-181a mimic组与空白对照组相比,穿膜细胞数明显减少,差异具有统计学意义(P<0.05)。以上结果表明miR-181a能够抑制A549细胞的迁移能力。
2.3 生物信息学预测c-fos是miR-181a的靶基因靶基因应用生物信息学预测软件 TargetScan对miR-181a的靶基因进行预测,分析显示在c-fos的3'UTR 区有7 个碱基与c-fos的“种子区”完全互补配对(见图3),因此生物信息学预测认为c-fos可能是miR-181a的靶基因。


2.4 双荧光素酶报告基因分析miR-181a对c-fos的调控作用 将miR-181a mimic和融合c-fos 3'UTR 的表达质粒pMIR-c-fos共转染A549 细胞后荧光素酶活性表达受到明显的抑制,与转染miR-181a nc和融合基因c-fos 3'UTR 的表达质粒pMIR-c-fos组相比差异有统计学意义(P<0.05);转染miR-181a mimic和融合c-fos 3'UTR“种 子 区 ”突 变 的 表 达 质 粒pMIR-c-fos-Mut 共转染A549细胞后荧光素酶活性没有受到抑制,与对照组转染空载体pCDNA3.1和融合基因c-fos 3'UTR 的表达质粒的荧光素酶活性比较差异无统计学意义(见图4)。结果表明,miR-181a能够对c-fos 3'UTR 区起到抑制性的调控作用。
2.5 Western blot检测miR-181a抑制c-fos蛋白表达miR-181a mimic转染组(mi)中c-fos蛋白表达与空白对照组(mock)和乱序转染组(nc)中c-fos蛋白表达差异明显,c-fos在miR-181a mimic转染组中表达明显下调(见图5)。结果表明,miR-181a能够在翻译水平上抑制c-fos蛋白表达。

3 讨论
肺癌是对人类生命威胁最大的恶性肿瘤之一。 早期研究表明在部分人类癌症发病机制中MicroRNA(miRNA)的改变可能参与调控。miRNA可以与多种靶基因结合在肿瘤发生发展过程中可起到癌基因或抑癌基因作用。本课题组前期通过芯片筛查肺癌组织和对应的癌旁组织中差异表达的miRNAs时发现,miR-181a 在癌旁组织中表达明显高于肿瘤组织。提示miR-181a可能作为抑癌基因参与肺癌的发生。
MiR-181a基因定位于人9号染色体上,成熟序列长为23 nt,是由92 nt茎环结构前体剪切、加工而成[7]。目前尚无miR-181a与肺癌转移关系的研究报道。通常采用化学合成小分子的miRNAs 或 构 建 miRNA表达载体进行miRNA功能研究[8,9]。本研究通过化学合成的miR-181a mimic进行后续实验。
我们首先通过real-time PCR方法检测了A549细胞转染化学合成的miR-181a mimic后能够高表达miR-181a,为正常表达水平的24.7倍。同时体外功能实验表明miR-181a能够抑制肺癌A549细胞的迁移。
为了探究miR-181a调控肺癌细胞迁移的分子机制,我们通过生物信息学软件预测c-fos可能是miR-181a的靶基因,通过双荧光素酶报告基因证实了miR-181a对c-fos的3'UTR 区具有作用的基础上,进一步在A549细胞中通过Western blot 方法证实了miR-181a 对c-fos的表达具有抑制作用。已有研究表明c-fos的表达与肺癌的发生、转移相关[10,11],我们认为miR-181a可能通过抑制c-fos表达调控肺癌细胞转移。本研究为进一步探究miR-181a在肺癌中的作用提供了思路和治疗的靶点。
[1]ZHANG H,LI Y,LAI M.The microRNA network and tumor metastasis[J].Oncogene,2010,29(7):937-948.
[2]OCANA OH,NIETO MA.A new regulatory loop in cancer-cell invasion[J].EMBO Rep,2008,9(6):521-522.
[3]SANTARPIA L,NICOLOSO M,CALIN G A.MicroRNAs:a complex regulatory network drives the acquisition of malignant cell phenotype[J].Endocr Relat Cancer,2010,17(1):F51-75.
[4]VOORHOEVE PM.MicroRNAs:Oncogenes,tumor suppressors or master regulators of cancer heterogeneity?[J].Biochim Biophys Acta,2010,1805(1):72-86.
[5]CHEN G,ZHU W,SHI D,et al.MicroRNA-181a sensitizes human malignant glioma U87MG cells to radiation by targeting Bcl-2[J].Oncol Rep,2010,23(4):997-1003.
[6]JI J,YAMASHITA T,BUDHU A,et al.Identification of microRNA-181 by genome-wide screening as a critical player in EpCAM-positive hepatic cancer stem cells[J].Hepatology 2009,50(2):472-480.
[7]MATSUSHIMA K,ISOMOTO H,KOHNO S,et al.MicroRNAs and esophageal squamous cell carcinoma[J].Digestion,2010,82(3):138-144.
[8]LI T,LI D,SHA J,et al.MicroRNA-21 directly targets MARCKS and promotes apoptosis resistance and invasion in prostate cancer cells[J].Biochem Biophys Res Commun,2009,383(3):280-285.
[9]GEBESHUBER CA,ZATLOUKAL K,MARTINEZ J.miR-29a suppresses tristetraprolin,which is a regulator of epithelial polarity and metastasis[J].EMBO Rep,2009,10(4):400-405.
[10]Wang CC,Tsai MF,Dai TH,et al.Synergistic activation of the tumor suppressor,HLJ1,by the transcription factors YY1 and activator protein 1[J].Cancer Res,2007,67(10):4816-4826.
[11]Han S,Ritzenthaler JD,Sitaraman SV,et al.Fibronectin increases matrix metalloproteinase 9 expression through activation of c-Fos via extracellular-regulated kinase and phosphatidylinositol 3-kinase pathways in human lung carcinoma cells[J].J Biol Chem,2011,286(28):25416.
