应用siRNA干扰下调CDX2表达以增强人胃癌SGC-7901细胞对5-Fu的敏感性
2012-11-26金雅磊叶旭军
金雅磊 徐 理 李 春 叶旭军 袁 胜 王 桦 夏 冰
1.武汉大学中南医院综合科;2.湖北省军区武昌珞咖山离职干部休养所
我国胃癌发病率高,其死亡率又占各种恶性肿瘤之首位[1]。胃癌早期诊断率较低,进展期和中晚期胃癌手术年生存率低,因此临床上的化疗对胃癌的治疗具有重要意义[2]。5-氟尿嘧啶(5-Fu)是目前临床上最常用的化疗药物之一,但长期应用后容易出现耐受现象。多药耐药(MDR)是胃癌化疗失败的重要原因之一[3]。
Caudal type no-meobx transcription factor 2(CDX2)是最近发现的特异性核转录因子,在正常生物发育过程中,CDX2对消化道的发育起着关键的作用[4]。近年来研究发现,CDX2基因过表达是胃癌[5-7]发生发展中的关键因素之一,提示该基因可作为一个候选的肿瘤转移抑制基因。最近研究发现过度表达的CDX2通过增强启动子区域的活性促进MDR1的大量表达[8],从而产生化疗药物的耐药性。因此我们推测降低胃癌细胞中的CDX2表达也许可以增强胃癌细胞对5-Fu的药物敏感性。本研究拟通过检测CDX2基因沉默能否增强胃癌细胞5-Fu化疗敏感性,从而为胃癌的化疗开辟新途径。
1 材料和方法
1.1 材料
1.1.1 主要试剂 RPMI-1640粉剂(美国Gibco BRL公司)、胎牛血清(杭州四季青生物工程材料有限公司)、Triton-X-100(Biorad公司)、鼠抗人CDX2单克隆抗体购自美国BIOGenex公司,5-Fu购自江苏豪森药业公司,针对CDX2基因的siRNA和阴性对照siRNA均为为上海吉玛制药技术有限公合成,其中阴性对照siRNA为对CDX2基因无干扰作用的双链RNA,四甲基偶氮唑蓝(MTT)购自美国Sigma公司。其余均为国产分析纯试剂。
1.1.2 细胞株 人胃癌细胞SGC-7901由武汉大学培养中心提供,用含有100 mg/L胎牛血清、100 ku/L青霉素和100 mg/L链霉素的RPM1640培养基,在37℃、饱和湿度及50 ml/L CO2的细胞培养箱内传代培养。
1.2 方法
1.2.1 试验分组 实验分为5组:空白对照组、脂质体组、5-Fu组、siRNA组和5-Fu+siRNA联合组;每组设5个复孔。
1.2.2 细胞转染
1.2.2.1 寡核苷酸序列 针对人类CDX2基因mRNA序列中位点(NCBI GenBank,基因编号:NM-001265),利用 “siRNA Target Finder Tool”(Genscript公司)设计软件,靶向CDX2基因siRNA寡核苷酸由上海生工公司化学合成,寡核苷酸序列见表1。
1.2.2.2 操作过程 用T4DNA连接酶将双链寡核苷酸与Psilencer2.1线性载体定向连接后转化大肠杆菌DH5а,植入固体LB培养液。挑选氨苄青霉素抗性菌落并扩增培养。将1×105个SGC-7901细胞接种于6孔板,其融合达90% 时分别用Psilencer2.1阳性重组子和对照阴性重组子进行转染。转染48 h后按1∶10稀释传代并换用选择培养液(600 mg/L,G418)继续培养14 d,然后将出现的细胞克隆在培养瓶中扩增培养并传代建系,分别命名为SGC-7901/Silence(+)和SGC-7901/Silence(-)细胞。

表1 寡核苷酸序列
1.2.3 Western blot方法检测 CDX2基因蛋白表达 收集各组细胞,洗涤、裂解液后低温离心5分钟,取上清,Forlin酚法测蛋白浓度。进行12.5%Tris一甘氨酸SDS聚丙烯酰胺凝胶和5%的积层胶电泳、转膜、封闭。分别加入一抗兔抗人CDX2及β-actin多克隆抗体,4℃孵育过夜,碱性磷酸酶标记羊抗兔IgG孵育2h,四唑硝基蓝(NBT)/5-溴-4-氯-3-吲哚基-磷酸盐(BCIP)显色。一抗及二抗浓度均为l:1 000,用图像分析系统测定各条带的灰度值,并用Image J图像分析软件分析。以β-actin为内参,表示CDX2蛋白的相对表达强度。
1.2.4 免疫荧光显微镜检测细胞凋亡形态 我们使用免疫荧光显微镜对筛选出的表达CDX2 shRNA和Nonsilence shRNA的SGC-7901细胞进行检测。
1.2.5 MTT法检测细胞增殖抑制率 按同前实验分组,各组设5个复孔,分别收集转染前和转染后的细胞,按每孔1×104个细胞接种于96孔培养板,细胞贴壁后,根据分组加入所需试剂及药物。72 h后,每孔加入10μl的MTI',继续培养4h,弃上清,加150μl的二甲基亚砜(DMSO)室温振荡10 min后570nm波长处测定光密度值(D570)。细胞抑制率(%)=(1-D570处理组/D570对照组)×100%。
1.2.6 统计学方法 采用SPSS 11.0软件完成,比较两组之间数值的差异用t检验,多组之间则用方差分析。P<0.05为差异具有统计学意义。
2 结果
2.1免疫荧光显微镜检测细胞凋亡形态图1显示,CDX2 knockdown组较non-silence组的细胞的绿色荧光平均强度明显减弱。
2.2 转染CDX2siRNA的SGC-7901对5-Fu敏感性的影响。 MTT法检测发现后三组(包括单用5-Fu组、转染siRNA组和5-Fu+转染siRNA联合组)对SGC-7901细胞的增殖有明显抑制作用,其中5-Fu+转染siRNA联合组抑制率最高,后三组与空白对照组比较差异具有统计学意义P<0.05,见表2。

图1 免疫荧光显微镜检测表达不同siRNA的SGC-7901细胞表面CDX2蛋白的表达水平。

表2 CDX2 siRNA对SGC-7901细胞增殖的抑制作用(n=5,x±s,%)
2.3 CDX2蛋白的表达Wstern Blot法检测显示,5-Fu组、转染组和联合组CDX2蛋白的表达均下调,明显低于其余各组(P<0.05),见表3。
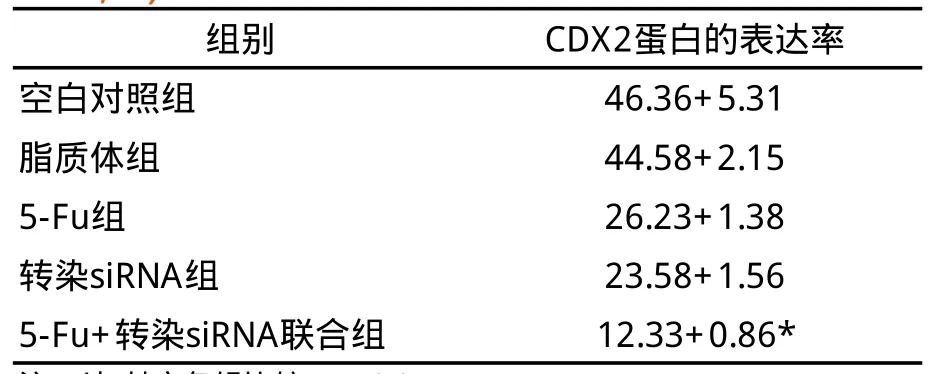
表3 各组SGC-7901细胞中CDX2蛋白的表达(n=5,x±s,%)

图2 各组CDX2蛋白表达(Western-blot ECL图像)
3 讨论
我国胃癌发病率高,其死亡率居各种恶性肿瘤之首[1],目前在胃癌患者的治疗中,许多患者由于主、客观原因失去了手术的机会。胃癌的化疗常需联合应用多种药物以提高疗效,然而对化疗药物产生耐药性的患者逐年增多,且化疗药物对人体正常组织的不良反应较大,这些情况依然是导致胃癌患者化疗失败的主要原因[2]。因此,为解决这些难题,研究对胃癌细胞更有选择性的新型治疗方法已成为当务之急。siRNA应用于抑制胃癌细胞不仅能提供一种经济、快捷、高效的抑制基因表达的技术手段,而且有可能在基因功能测定和基因治疗等方面开辟一条新思路,因此包括动物医学在内的诸多领域的应用也有非常广阔的前景。
CDX2是一种新发现的特异性的核转录因子,是尾型同源框基因家族中的一员[4];是最近发现的特异性核转录因子。最早由Mlodzik于果蝇中分离成功,发现与Parahox家族呈高度的同源性[1]。近年来人类的染色体研究表明,CDXZ基因全长22~23kb,位于染色体的13q12-13,由3个外显子和2个内含子构成;与之对应的CDX2蛋白包含311个单氨基酸,通过螺旋一环一螺旋的方式结合于DNA的相应区域,以转录因子的形式调节DNA的表达。近年来,CDX2基因与胃癌的关系已逐步得以阐明。Camilo V[5]报道在胃腺癌细胞CDX2 mRNA和蛋白的表达均显著升高。Peleteiro B等[6]对270例胃癌研究后发现,80.0%的胃癌组织表现不同程度的CDX2阳性表达。研究发现,CDX2基因过表达与胃癌生长、转移生物行为的研究有关,通过CDX2基因沉默可以抑制胃癌生长[7]。我们的研究通过将CDX2特异性siRNA转染入SGC-7901细胞中,发现转染siRNA组和5-Fu+转染siRNA联合组中的CDX2蛋白表达减少,SGC-7901细胞的增殖也有明显抑制。我们的试验从蛋白水平验证转染CDX2 siRNA的干扰效果;也提示转染CDX2 siRNA联合5-Fu可以降低胃癌细胞的耐药性,提高化疗效果,从而为临床治疗胃癌提供了新思路。
[1] Yu H,Wang Y,Ge X,et al.Depression and survival in Chinese patients with gastric cancer:a prospective study[J].Asian Pac J Cancer Prev,2012,13 (1):391-394.
[2] Rivera F,Vega-Villegas ME,López-Brea MF.Chemotherapy of advanced gastric cancer[J].Cancer Treat Rev,2007,33(4):315-324.
[3] Zhang D,Fan D.Multidrug resistance in gastric cancer:recent research advances and ongoing therapeutic challenges[J].Expert Rev Anticancer Ther,2007,7(10):1369-1378.
[4] Drummond F,Putt W,Fox M,et al.Cloning and chromosome assignment of the human CDX2 gene[J].Ann Hum Genet,1997,61(Pt 5):393-400.
[5] Camilo V,Barros R,Sousa S,et al.Helicobacter pylori and the BMP pathway regulate CDX2 and SOX2 expression in gastric cells[J].Carcinogenes is,2012,33(10):1985-1992.
[6] Peleteiro B,Lunet N,Wen X,et al.Association between environmental factors and CDX2 expression in gastric cancer patients[J].Eur J Cancer Prev,2012,21(5):423-431.
[7] Wang XT,Xie YB,Xiao Q.siRNA targeting of Cdx2 inhibits growth of human gastric cancer MGC-803 cells[J].World J Gastroenter ol,2012,18(16):1903-1914.
[8] Takakura Y,Hinoi T,Oue N,et al.CDX2 regulates multidrug resistance 1 gene expression in malignant intestinal epithelium[J].Cancer Res,2010,70(17):6767-6768.
