聚丙烯酰胺凝胶法制备纳米BeO粉体前驱体的热分解过程及结晶机理
2012-11-24王小锋王日初彭超群李婷婷
王小锋,王日初,彭超群,李婷婷,刘 兵
(1. 中南大学 材料科学与工程学院,长沙 410083;2. 中南大学 冶金科学与工程学院,长沙 410083)
聚丙烯酰胺凝胶法制备纳米BeO粉体前驱体的热分解过程及结晶机理
王小锋1,2,王日初1,彭超群1,李婷婷1,刘 兵1
(1. 中南大学 材料科学与工程学院,长沙 410083;2. 中南大学 冶金科学与工程学院,长沙 410083)
采用聚丙烯酰胺凝胶法制备纳米BeO粉体,通过TG-DSC、XRD和SEM等测试手段研究凝胶前驱体的热分解过程和所得粉体的性能,并借助负离子配位多面体生长基元理论分析热分解过程中纳米BeO的结晶机理。结果表明:随着温度的升高,凝胶前驱体内的有机凝胶逐渐分解,同时凝胶前驱体内的硫酸铍盐脱除结晶水;当温度达到600 ℃左右时,有机凝胶完全分解,得到纳米级的无水硫酸铍;继续升高温度,纳米级的无水硫酸铍分解得到纳米BeO;热分解过程中,纳米硫酸铍通过生长基元Be(SO4)6-断键形成纳米BeO,成核过程为受迫状态下的非均匀成核。
纳米BeO;聚丙烯酰胺凝胶法;热分解;结晶机理
BeO陶瓷是一种性能优异的陶瓷材料,具有高热导率、高熔点、高强度、高绝缘性、高的化学和热稳定性、低介电常数、低介质损耗以及良好的工艺适应性等特点。因此,BeO陶瓷已被广泛应用于特种冶金、真空电子技术、核技术、微电子与光电子技术领域,尤其被制成高导热元器件用于大功率IC、HIC(沉积薄膜微波混合集成电路) 、半导体器件、大功率微波、电真空器件、核动力中[1]。近年来,由于其组织等价性(Zeff=7.1)和高敏感性,BeO陶瓷还被用作医疗领域的放射测量窗口材料[2-5]。虽然BeO陶瓷广泛应用于许多领域,但因BeO熔点高达(2 570±20) ℃[1],采用普通粉体制备BeO陶瓷时,其烧结温度很高,所以较难获得高纯高致密、性能优异的BeO陶瓷材料。众所周知,采用纳米粉体制备陶瓷材料,不仅能降低烧结温度,而且还有利于提高陶瓷材料的性能。因此,有必要对纳米BeO粉体的制备进行研究。
目前,制备纳米粉体的方法有很多种,如沉积法[6]、水热法[7-8]、燃烧合成法[9]和溶胶-凝胶法[10-11]等。其中,溶胶-凝胶法是运用得最为广泛的一种方法[12]。聚丙烯酰胺凝胶法是一种简单、方便、廉价的新的溶胶-凝胶方法[12-14]。该方法利用高分子化学中的溶液聚合过程及聚合产生的三维网络结构高分子,将溶液中的离子分离、包裹和固定,从而制备合成纳米粉体。与其他方法相比,该方法还具有合成温度低和省时等优点[13-14]。1989年,为改进溶胶-凝胶方法—Pechini 法,DOUY等[15]提出了聚丙烯酰胺凝胶法,并采用该方法成功制备了 2SiO2-3Al2O3(莫来石)、LaAIO3和YBa2Cu3O7-x3种超细粉体。随后,该方法引起了研究者的广泛关注。近年来已被用于多种纳米粉体的制备,如 ZnO[16]、α-Al2O3[13-14]、Zr2O3[12]以及复合氧化物粉体YVO4:Eu[17]和Zr0.84Y0.16O1.92[18]等。虽然聚丙烯酰胺凝胶法已被广泛用于制备各种超细或纳米粉体,但尚未见系统研究凝胶前驱体(含盐的干凝胶)热分解过程的报道。
本文作者采用聚丙烯酰胺凝胶法制备纳米 BeO粉体,通过TG、XRD和SEM等测试手段研究凝胶前驱体的热分解过程,并借助负离子配位多面体生长基元理论分析热分解过程中纳米BeO的结晶机理。
1 实验
实验原料为硫酸铍(BeSO4·4H2O,分析纯);丙烯酰胺(AM,C2H3CONH2,分析纯);N,N′-亚甲基双丙烯酰胺(MBAM,(C2H3CONH2)2CH2,分析纯);过硫酸铵(APS,(NH4)2S2O8,分析纯);去离子水(H2O,工业纯)。聚丙烯酰胺凝胶法制备粉体的流程如下:精确称取APS配制浓度为10%(质量分数)的溶液,待用。称取BeSO4·4H2O配成浓度为1.5 mol/L溶液。往盐溶液中分别加入一定量的单体 AM 和交联剂MBAM(AM与MBAM质量比为20∶1),经搅拌均匀直至溶液透明。再将0.5 mL已配制的引发剂APS溶液加入其中,并进行水浴加热,待温度升至60 ℃后,该溶液转变为凝胶。为了保证有机单体反应充分,继续保持恒温1 h。将所得凝胶前驱体放入真空干燥箱内,在80 ℃条件下干燥48 h,除去水分,得到凝胶前驱体(含盐的干凝胶)。分别在600、700、800、900和1 000℃温度下煅烧凝胶前驱体2 h,得到5种白色粉体样品。为了防止有机物在升温过程中发生碳化,控制升温速率为5 ℃/min。
前驱体的热分解过程采用热分析仪(TG-DSC,STA 449C,NETZSCH)在升温速率为5 ℃/min、空气气氛的条件下分析;产物的物相分析采用日本理学D/Max2550VB+型 X 射线衍射仪(XRD)进行定性分析;粉体的形貌和粒径采用 Sirion-2000型场发射扫描电子显微镜(FE-SEM)观察,并运用能谱仪(EDS)分析产物的成分。
2 结果与讨论
2.1 凝胶前驱体的热分解
为便于比较,采用热分析仪分别研究了聚丙烯酰胺纯凝胶和硫酸铍盐的热分解过程。图1所示为聚丙烯酰胺纯凝胶的热分析结果。由图1可知,纯凝胶的热分解是一个多步反应过程,且在600 ℃以上完全分解。250 ℃时,纯凝胶的质量损失达到16%,原因是凝胶内的自由水和吸附水被除去。空气中高分子有机物的热分解为氧化过程,属于放热反应,因此,DSC曲线分别在384和513 ℃时出现两个很强的放热峰。该两处温度分别对应于聚丙烯酰胺凝胶支链和主链的先后断裂[12]。
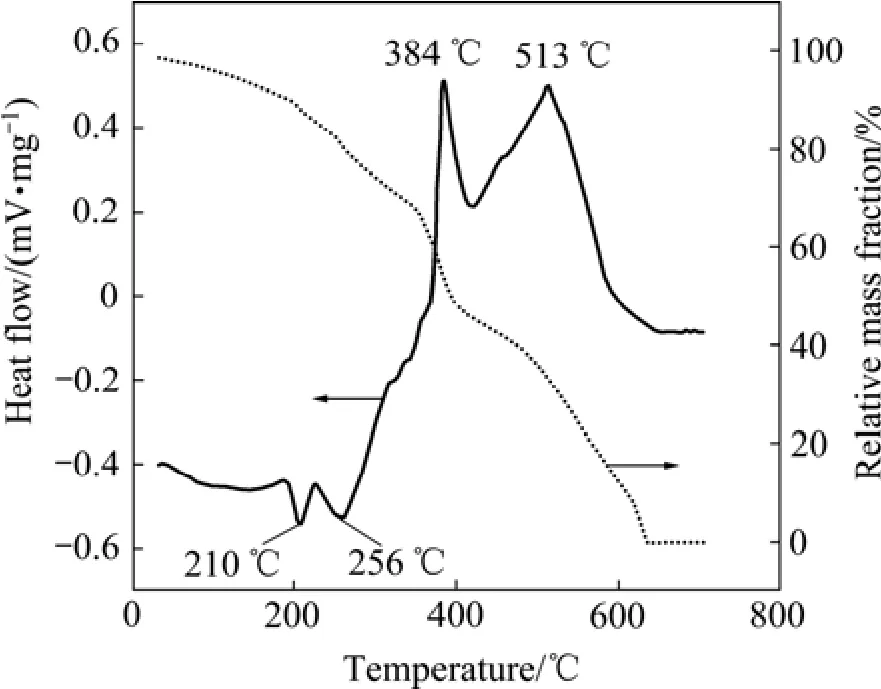
图1 聚丙烯酰胺纯凝胶的DSC和TG曲线Fig. 1 DSC and TG curves of pure polyacrylamide gel (5℃/min in air)
图 2所示为硫酸铍的热分析曲线。DSC曲线在120和201 ℃均出现两个明显的吸热峰,同时TG曲线在 100~300 ℃之间有两个台阶,表明 BeSO4·4H2O在此温度范围内出现两步脱水反应,其对应的反应式如下:

在300~690 ℃之间,质量基本无变化,说明无水硫酸盐以稳定的形式存在。当温度达到690 ℃后,TG曲线开始下降,813 ℃时DSC曲线出现很强的吸热峰,表明硫酸盐发生分解并释放出气体 SO3。无水硫酸铍热分解反应式为

当温度超过867 ℃后,质量不再发生变化,表明硫酸盐已分解完全,产物为BeO。可见,直接煅烧硫酸盐获得纯BeO粉体的煅烧温度须高于867 ℃,即热分解完全温度为867 ℃。这与DOLLIMORE等[19]的研究结果基本一致。
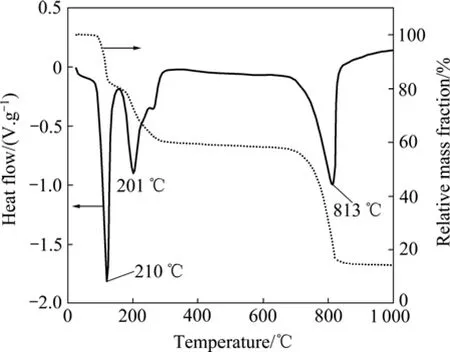
图2 硫酸铍盐的热分析DSC和TG曲线Fig. 2 DSC and TG curves of beryllium sulfate (5 ℃/min in air)
图3所示为凝胶前驱体的热分析曲线。与聚丙烯酰胺纯凝胶和硫酸铍盐的热分解比较,凝胶前驱体的热分解要复杂得多。300 ℃时,凝胶前驱体的质量损失达到26%左右,表明在此温度下凝胶前驱体内的水分被除去后,硫酸盐发生两步脱水反应。比较图1和图3可知,384和513 ℃时出现的两个放热峰几乎消失。这说明凝胶前驱体还存在与放热反应相反的吸热反应,两种反应的相互作用使得原本应该出现的放热峰没有明显出现。而硫酸铍的分解为吸热反应,所以在这两个温度时,很可能硫酸铍已经开始发生分解。比较图2和3可知,在300~690 ℃之间,凝胶前驱体的质量持续下降,进一步证实硫酸铍在此温度范围内确实发生分解。这也表明凝胶前驱体内的凝胶对硫酸铍的分解产生很大影响,在很大程度上改变了硫酸铍开始热分解的温度。由图2和3还可知,硫酸铍的完全热分解温度(质量恒定时)也下降较大。因为聚丙烯氨酰胺凝胶在600 ℃左右已分解完全(见图1),所以凝胶前驱体中的完全热分解温度即为硫酸铍的完全热分解温度。凝胶前驱体中硫酸铍的完全热分解温度为690 ℃,较原来的温度867 ℃降低约177 ℃。
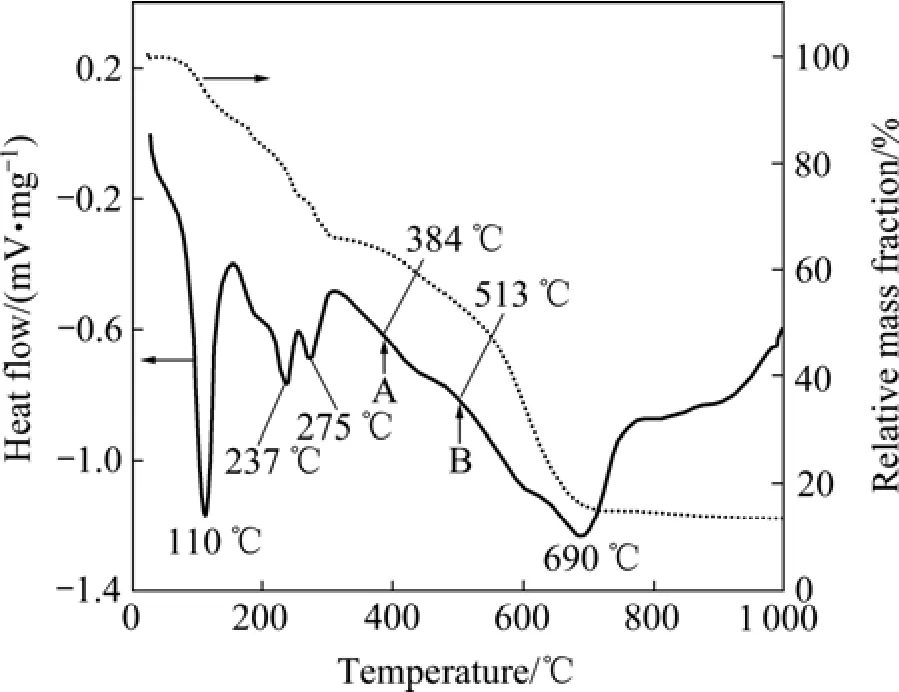
图3 凝胶前驱体的热分析DSC和TG曲线Fig. 3 DSC and TG curves of precursor gel (5 ℃/min in air)
图4所示为在600 ℃下煅烧凝胶前驱体2 h所得粉体的扫描电镜和X射线分析结果。可见,所得粉体为纳米级的BeSO4粉,且含有少量的纳米BeO粉。粉体粒度均匀、细小,平均粒径约为15.13 nm(见图4(a))。EDS分析证实了XRD的结果。此外,EDS分析结构中C的存在表明,所得粉体还含有高分子有机物,这是凝胶前驱体中聚丙烯酰胺凝胶分解不完全残留的。
采用聚丙烯酰胺凝胶法制备粉体时,溶液中的离子被自由基聚合形成的三维结构高分子网络包裹、阻隔,并在随后的干燥和煅烧过程中形成纳米级的硫酸盐。与普通的盐比较,纳米硫酸盐的比表面积很大,比表面能也相应地更高,因此其热分解激活能大幅度下降,热分解温度降低。升高煅烧温度,凝胶前驱体内水分首先被除去,同时硫酸盐的结晶水也被脱除;随后,在较低温度下(300 ℃),纳米级的硫酸盐就开始分解,在较高温度下(690 ℃),硫酸盐全部分解为氧化物粉体。与此同时,三维网络结构高分子也发生热分解,且当温度高于600 ℃时才分解完全,因此它能阻碍纳米硫酸盐的靠拢,防止产生的氧化物粉体的团聚,所以得到的粉体十分细小。
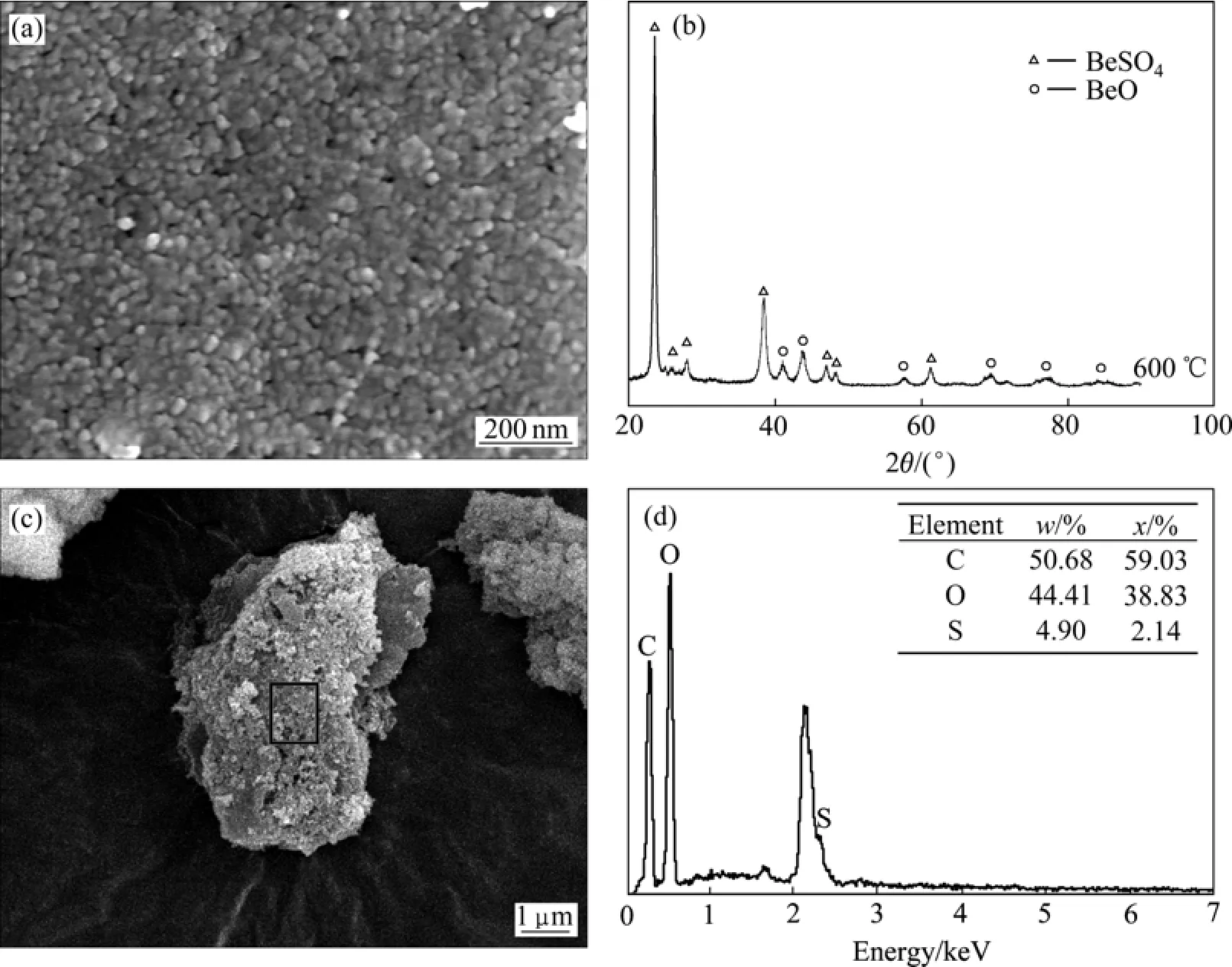
图4 600 ℃下煅烧凝胶前驱体2 h所得纳米硫酸铍的SEM像、XRD谱及EDS谱Fig. 4 SEM image, XRD pattern and EDS pattern of nanoscale BeSO4 from precursor gel calcined under 600 ℃ for 2 h: (a), (c)SEM images; (b) XRD pattern; (d) EDS pattern
2.2 纳米BeO粉体的性能
将凝胶前驱体分别在700、800、900和1 000 ℃等不同温度下煅烧2 h,得到白色粉末样品。图5所示为所得粉体的 XRD谱。图中各特征峰的位置均与α-BeO的标准谱(JPCDS, No.35—0818)完全一致,并且衍射图谱的面网间距d值与六方钎锌矿结构的α-BeO完全相符,说明各样品中均无杂质相存在,为六方晶系的氧化铍。对比图5中各衍射图谱可知,随煅烧温度的升高,各特征峰的峰强增大,峰宽减小即衍射峰趋于尖锐,表明晶粒尺寸增加,氧化铍晶格越趋完整。BeO粉体的SEM像如图6所示。当煅烧温度为700 ℃时,所得粉体为球形,且粒度细小、均匀,约18.53 nm。升高煅烧温度,纳米BeO粉体仍为球形,但发生长大,粒度增加。当煅烧温度为1 000 ℃时,纳米BeO粉体长大更明显,且出现部分六方柱状粉体,表明六方晶系的氧化铍发生极性生长。图7所示为不同煅烧温度下所得纳米BeO粉体晶粒度的变化曲线。从图7可以看出,随煅烧温度的升高,所制备的纳米BeO粉体晶粒度逐渐增大,且当温度高于 900℃后,晶粒度急剧增加。
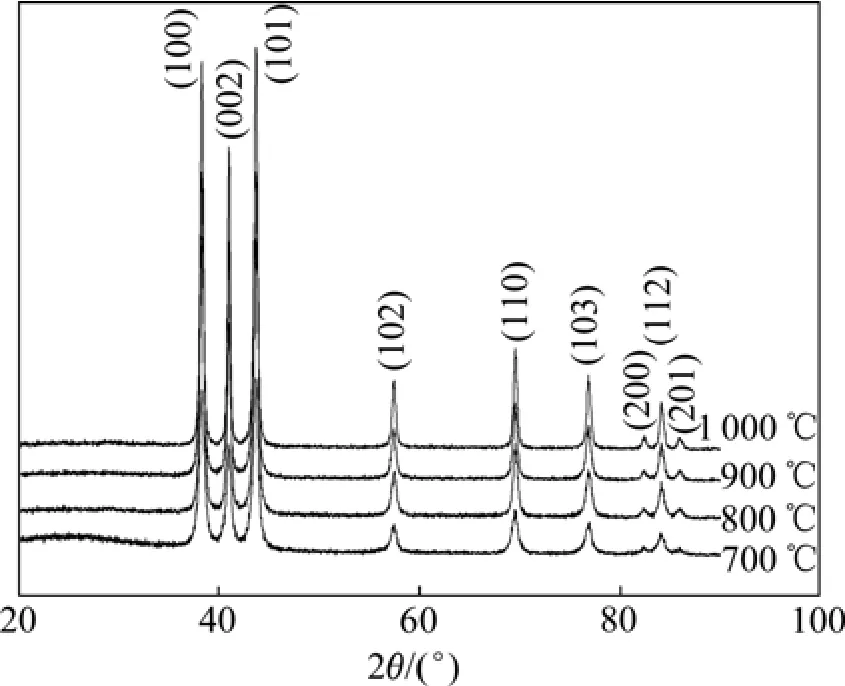
图5 在不同煅烧温度下煅烧凝胶前驱体所得纳米氧化铍的XRD谱Fig. 5 XRD patterns of BeO nanopowders from precursor gels at different calcination temperatures
2.3 氧化铍纳米晶的结晶机理
上述讨论表明,采用聚丙烯酰胺凝胶法制备粉体时,煅烧凝胶前驱体获得纳米硫酸盐,其随后发生热分解反应得到纳米BeO粉体。热分解反应属于固相反应,其机理十分复杂,尚无很合适的理论来解释。近年来,仲维卓等[20-26]提出负离子配位多面体生长基元理论,并解释了水热条件下 ZnO[23-24]、ZnS[25]、和的形成机理。本文作者尝试将该理论用于解释热分解条件下晶体的形成机理,从而解释热分解过程中BeO纳米晶的结晶机理。
BeSO4为四方晶系晶体,属于空间群I-4。晶体中有两种配位结构,一种是[SO4]2-,另一种是[Be-O4]6-。根据负离子配位多面体基元理论和式(3)的反应可以认为,形成纳米BeO的生长基元为四面体。四面体相互联结,四面体之间由 S—O4四边形构成硫酸铍,加热分解形成BeO(式(3))。由式(3)还可知,BeO纳米晶通过纳米硫酸铍的热分解形成,为固相反应,因此BeSO4晶粒为受迫状态下的析晶,所得BeO纳米晶为球形。从能量的角度考虑,BeSO4为分解形成 BeO晶核最可能发生在晶体点阵的点缺陷、线缺陷(位错等)、面缺陷(表面和界面等)和杂质等结构不规整的位置上。因此,热分解的形核过程为一个非均匀形核过程。在点阵不对称或杂质处,离子畸形排列,相互联结的四面体在达到热分解温度时,结构中的化学键容易发生断裂,生成气体SO3→SO3↑)放出,并得到BeO粉体。根据负离子多面体理论,剩余的离子组成的四面体恰好为BeO的生长基元。

图6 在不同煅烧温度下煅烧凝胶前驱体所得纳米氧化铍的SEM像Fig. 6 SEM images of BeO nanopowders from precursor gels at different calcination temperatures: (a) 700 ℃; (b) 800 ℃; (c) 900℃; (d) 1 000 ℃
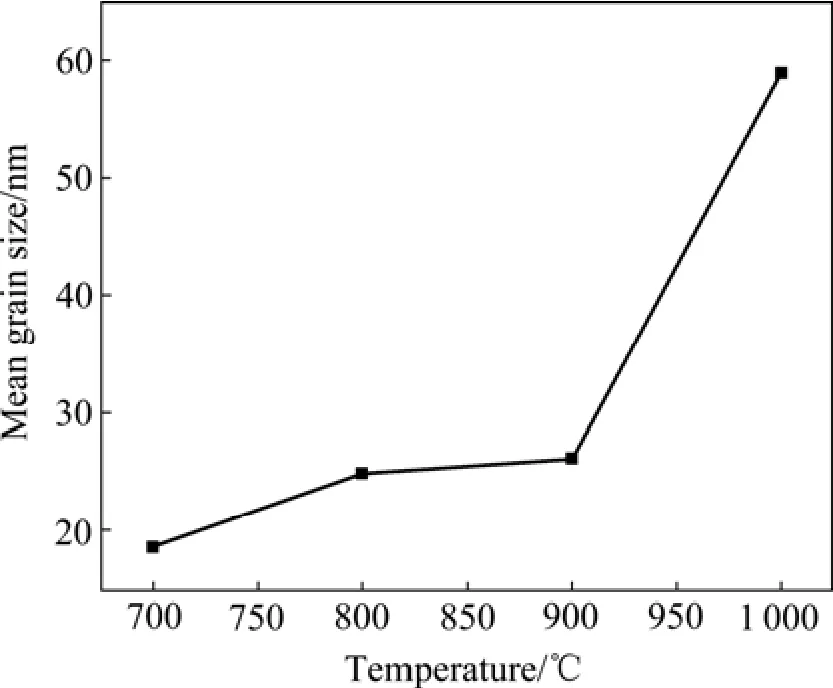
图7 不同热分解温度下BeO晶粒度的变化曲线Fig. 7 Changing curve of mean grain size of BeO at different calcination temperatures
3 结论
1) 采用聚丙烯酰胺凝胶法制备粉体时,具有三维网络结构的聚丙烯酰胺凝胶将溶液中的离子包裹、阻隔,干燥后得到含纳米硫酸盐的凝胶前驱体。
2) 随煅烧温度的升高,凝胶前驱体内水分首先被除去,同时硫酸盐的结晶水也被脱除;继续升高温度,纳米硫酸盐在较低温度下(300 ℃)就开始分解,在较高温度下(690 ℃)完全分解为氧化物粉体,该完全分解温度比普通硫酸盐的分解温度低约177 ℃。
3) 三维网络结构高分子与硫酸盐同时发生热分解,且当温度高于600 ℃时才分解完全,因此它能阻碍纳米硫酸盐的靠拢,防止产生的氧化物粉体的团聚,制备得到纳米BeO粉体。
4) 热分解过程中,纳米硫酸铍通过生长基元Be(SO4)6-断键形成纳米BeO,成核过程为受迫状态下的非均匀成核。
REFERENCES
[1] 高陇桥. 氧化铍陶瓷[M]. 北京: 冶金工业出版社, 2006.
GAO Long-qiao. BeO ceramic[M]. Beijing: Metallurgical Industry Press, 2006.
[2] SOMMER M, JAHN A, HENNIGER J. Beryllium oxide as optically stimulated luminescence dosimeter[J]. Radiation Measurements, 2008, 43(2/6): 353-356.
[3] SOMMER M, FREUDENBERG R, HENNIGER J. New aspects of a BeO-based optically stimulated luminescence dosimeter[J].Radiation Measurements, 2007, 42(4/5): 617-620.
[4] SOMMER M, HENNIGER J. Investigation of a BeO-based optically stimulation luminescence dosimeter[J]. Radiation Protection Dosimetry, 2006, 119(1/4): 394-397.
[5] SCARPA G. The dosimetric use of beryllium oxide as a thermoluminescent material: A preliminary study[J]. Physics in Medicine and Biology, 1970, 15(4): 667-672.
[6] IBARGUEN C A, MOSQUERA A, PARRA R, CASTRO M S,RODRÍGUEA-PÁEA J E. Synthesis of SnO2nanoparticles through the controlled precipitation route[J]. Materials Chemistry and Physics, 2007, 101(2/3): 433-440.
[7] PU Yuan, TAO Xia, ZHAI Jing, CHEN Jian-feng. Hydrothermal synthesis and magnetic properties of Co0.2Cu0.03Fe2.77O4nanoparticles[J]. Materials Research Bulletin, 2010, 45(5):616-620.
[8] CASTRO A L, NUNES M R, CARVALHO A P, COSTA F M,FLORĚNCIO M H. Synthesis of anatase TiO2nanoparticles with high temperature stability and photocatalytic activity[J]. Solid State Sciences, 2008, 10(5): 602-606.
[9] PUROHIT R D, SAHA S, TYAGI A K. Combustion synthesis of nanocrystalline ZrO2powder: XRD, Raman spectroscopy and TEM studies[J]. Materials Science and Engineering B, 2006,130(1/3): 57-60.
[10] LIVAGE J, HENRY M, SANCHEZ C. Sol-gel chemistry of transition metal oxides[J]. Progress in Solid State Chemistry,1998, 18(4): 259-342.
[11] LEE Byong-taek, HAN Jae-kil, SAITO Fumio. Microstructure of sol-gel synthesized Al2O3-ZrO2(Y2O3) nano-composites studied by transmission electron microscopy[J]. Materials Letters, 2005,59(2/3): 355-360.
[12] TAHMASEBPOUR M, BABALUO A A, RAZAVI AGHJEH M K. Synthesis of zirconia nanopowders from various zirconium salts via polyacrylamide gel method[J]. Journal of the European Ceramic Society, 2008, 28(4): 773-778.
[13] WANG Hong-zhi, GAO Lian, LI Wei-qun, LI Qiang.Preparation of nanoscale α-Al2O3by the polyacrylamide gel method[J]. NanoStructured Materials, 1999, 11(8): 1263-1267.
[14] TAHMASEBPOUR M, BABALUO A A, SHAFIEI S,PIPELZADEH E. Studies on the synthesis of α-Al2O3nanopowders by the polyacrylamide gel method[J]. Powder Technology, 2009, 191(1/2): 91-97.
[15] DOUY A, ODIER P. The polyacrylamide gel: A novel route to ceramic and glassy oxide powders[J]. Materials Research Bulletin, 1989, 24(9): 1119-1126.
[16] 邵忠宝, 李国荣. 高分子网络凝胶法制备纳米 ZnO粉料[J].材料研究学报, 2001, 15(6): 681-685.
SHAO Zhong-bao, LI Guo-rong. Prepararion of nanometer-sized zinc oxide powders by polyacrylamide gel method[J]. Chinese Journal of Materials Research, 2001, 15(6): 681-685.
[17] ZHANG Hong-wu, FU Xiao-yan, NIU Shu-yun, SUN Gong-quan, XIN Qin. Low temperature synthesis of nanocrystalline YVO4:Eu via polyacrylamide gel method[J].Journal of Solid State Chemistry, 2004, 177(8): 2649-2654.
[18] TARANCÓN A, DEZANNEAU G, ARBIOL J, PEIRO F,MORANTE J R. Synthesis of nanocrystalline materials for SOFC applications by acrylamide polymerization[J]. Journal of Power Sources, 2003, 118(1/2): 256-264.
[19] DOLLIMORE D, KONIECZAY J L. The thermal decomposition of beryllium oxalate and related materials[J].Thermochimica Acta, 1998, 318(1/2): 155-163.
[20] 仲维卓, 华素坤, 施尔畏. 极性晶体的结构与形貌[J]. 人工晶体学报, 1991, 20(1): 82-88.
ZHONG Wei-zhuo, HUA Su-kun, SHI Er-wei. Structure and morphology of polar crystals[J]. Journal of Synthetic Crystals,1991, 20(1): 82-88.
[21] 施尔畏, 仲维卓, 华素坤, 元如林, 王步国, 夏长泰, 李汶军.关于负离子配位多面体生长基元模型[J]. 中国科学: E辑,1998, 28(1): 37-45.
SHI Er-wei, ZHONG Wei-zhuo, HUA Su-kun, YUAN Ru-lin,WANG Bu-guo, XIA Chang-tai, LI Wen-jun. On anion coordination polyhedron growth unit theory mode[J]. Science in China: Series E, 1998, 28(1): 37-45.
[22] 李汶军, 施尔畏, 仲维卓, 殷之文. 负离子配位多面体生长基元的理论模型与晶粒形貌[J]. 人工晶体学报, 1999, 28(2):117-125.
LI Wen-jun, SHI Er-wei, ZHONG Wei-zhuo, YIN Zhi-wen.Anion coordination polyhedron growth unit theory mode and crystal morphology[J]. Journal of Synthetic Crystals, 1999, 28(2):117-125.
[23] 王步国, 仲维卓, 施尔畏, 夏长泰, 李文军, 华素坤, 殷之文.ZnO 晶体的极性生长习性与双晶的形成机理[J]. 人工晶体学报, 1997, 26(5): 102-107.
WANG Bu-guo, ZHONG Wei-zhuo, SHI Er-wei, XIA Chang-tai,LI Wen-jun, HUA Su-kun, YIN Zhi-wen. Polar growth and twinning mechanisms of ZnO crystals under hydrothermal conditions[J]. Journal of Synthetic Crystals, 1997, 26(5):
102-107.
[24] LI Wen-jun, SHI Er-wei, ZHONG Wei-zhuo, YIN Zhi-wen.Growth mechanism and growth habit of oxide crystals[J].Journal of Crystal Growth, 1999, 203(1): 186-196.
[25] 仲维卓, 王步国, 施尔畏, 华素坤. 水热条件下ZnS晶体的极性生长机制与双晶的形成[J]. 人工晶体学报, 1998, 27(1): 1-7.
ZHONG Wei-zhuo, WANG Bu-guo, SHI Er-wei, HUA Su-kun.Polar growth and twinning mechanisms of ZnS(sphalerite)crystals under hydrothermal conditions[J]. Journal of Synthetic Crystals, 1998, 27(1): 1-7.
[26] LI Wen-jun, SHI Er-wei, YIN Zhi-wen. Growth habit of rutile and α-Al2O3crystals[J]. Journal of Crystal Growth, 2000,208(1/4): 546-554.
Thermal decomposition of precursor gel and crystalline mechanism of BeO nanopowders synthesized by polyacrylamide gel method
WANG Xiao-feng, WANG Ri-chu, PENG Chao-qun, LI Ting-ting, LIU Bing
(1. School of Materials Science and Engineering, Central South University, Changsha 410083, China;2.School of Metallurgical Science and Engineering, Central South University, Changsha 410083, China)
The BeO nanopowders were synthesized by the polyacrylamide gel method. The thermal decomposition process of precious gel and the properties of the obtained powder were investigated by TG-DSC, XRD and SEM, and the crystalline mechanism of nano-BeO in the thermal decomposition process was indicated by growth units model theory of anion coordination polyhedron. The results show that the organic gel in the precious gel is disintegrated gradually, and meanwhile the crystal water of the beryllium sulfate salt in precious gel is removed with the increase of temperature;when the temperature is about 600 ℃, the organic gel is disintegrated completely and nano-BeSO4is obtained; BeO nanopowders are achieved under higher temperature. During the thermal decomposition of BeSO4processes, the chemical bonds of its growth units Be(SO4)6-break down and nano-BeO forms, and the process of crystal nucleus formation is heterogeneous nucleation under the forced condition.
nano-BeO; polyacrylamide gel method; thermal decomposition; crystalline mechanism
TF123
A
1004-0609(2012)08-2295-07
国家民口配套科研项目(MKTP-03-182);中南大学博士后基金资助项目(2012)
2011-07-10;
2012-05-02
彭超群,教授,博士;电话:0731-88877197;E-mail: pcq2005@163.com
(编辑 龙怀中)
