氯霉素化学发光酶联免疫检测方法的建立
2012-11-23何方洋冯月君岳新荣韩京朋
何方洋,冯月君,吴 鹏,冯 静,岳新荣,韩京朋
(北京勤邦生物技术有限公司,北京 102206)
氯霉素(Chloramphenicol,CAP)是20世纪中叶从委内瑞拉链丝菌中提取制得的一类廉价高效的广谱抗生素[1-2],对革兰氏阳性和阴性细菌都有很好的抑制作用,因此一度被广泛应用于农牧业中[3]。但是动物源性食品中的氯霉素药物残留随着食物链被人体长期摄入,可引发各种危害和多种疾病。轻者破坏人体内正常菌群的平衡状态,菌群失调,使人体产生耐药菌珠,给以后患病使用抗生素治疗带来不良影响;氯霉素过敏体质的人会出现过敏反应,危及健康[4]。严重时可干扰骨髓细胞蛋白质的合成,并抑制幼稚细胞DNA合成,导致粒细胞减少,引发再生障碍性贫血、溶血、紫瘫等恶性疾病[5]。氯霉素残留问题对人类健康构成巨大的潜在威胁,已引起国际组织和世界上许多国家的高度重视[6],欧美等发达国家均在法规中对CAP残留限量标准作出了严格的规定[7]。我国农业部2001年公告第24号文件规定,在马肝、鸡肉等中氯霉素的残留限量为不得检出,要求其检测限量为1 ng/g;2002年公告第235号文件进一步要求,氯霉素及其盐、酯在所有食品动物的所有可食组织中不得检出[8]。
为适应更高的检测标准,检测技术水平必须相应的提高,因此氯霉素检测技术一直是近十年来国内外专家学者研究的热门项目之一[9]。氯霉素的检测方法分为物理化学法和免疫化学法,前者有液相色谱法(LC)、高效液相色谱法(HPLC)、质谱法(MS)等,后者主要是酶免法(ELISA),检测的灵敏度均达到ppb(μg/kg)级别[10-11]。当前主流的检测方法是液相色谱法——我国行业标准所使用的方法以及ELISA。近几年,国内外学者又研发出液相色谱串联质谱法(LC-MS/MS)、液相色谱电喷雾电离质谱法(LC-EITMS)、微生物分析等物理检测新方法[12],同时对ELISA方法的应用也有了进一步研究。
化学发光分析法是一种有效的微量和痕量分析法[13],与放射免疫分析(RIA)和酶免疫分析(ELA)相比,RIA和ELA检测时间一般为75~120 min,化学发光方法检测时间一般为18 min,灵敏度与RIA属于同一检测水平,检测限可达10-12~10-20mol[14-15]。兽药残留中的化学发光免疫分析,不仅具有免疫反应的特异性,而且具有化学发光分析的高灵敏性,如果能将两项技术有效的结合起来,那么将会开启一项十分有发展前景的分析监测技术。建立稳定的化学发光酶免疫分析方法,是进行化学发光试剂盒的研制的基础,同时对于严把食品安全的检验环节有重要的意义。
1 材料
1.1 仪器与设备 电子天平2000SBL(美国Setra);磁力搅拌器90-2(上海振荣科学仪器有限公司);微量移液器,单道 20~200 μL、100~1000 μL,多道50 ~300 μL(美国Thermo);氮吹仪DSY-Ⅲ(北京金科精华苑科技有限公司);QL-901漩涡混合器(海门市其林贝尔仪器制造有限公司);低速离心机Anke TDL-40B(上海安亭科学仪器有限公司 );CentroLB960微孔板式发光仪(德国Berthold);Opti-plateTM化学发光板(Perkin Elmer);生化培养箱DHP-600(天津市中环实验电炉有限公司)。
1.2 试剂 氯霉素及其类似物标准品(德国Dr.Ehrenstorfe公司);牛血清白蛋白 BSA、卵清蛋白OVA(Sigma公司);盐酸、Pd/C催化剂、二甲基甲酰胺(DMF)、三丁胺、氯甲酸异丁酯、人糖化白蛋白(GA)(国药集团化学试剂有限公司);辣根过氧化物酶 (美国Jackson公司);弗氏完全佐剂、弗氏不完全佐剂(北京望尔生物技术有限公司);鲁米诺发光底物液(Hyclone Pierce);其他有关化学试剂均为分析纯。
2 方法
2.1 抗原的合成
2.1.1 免疫原的合成 将氯霉素溶于甲醇中,加入5%的Pd/C催化剂,通入氢气,保持一定压力,室温反应2 h,过滤除去Pd/C,蒸干溶剂得到淡黄色黏稠液体,即得氯霉素半抗原。将上述得到的目标物在0~5℃下,用盐酸调pH值为1~2,搅拌下滴加0.1~1 mol/L的NaNO2溶液,使淀粉碘化钾试纸变蓝,再滴加0.1~1 mol/L尿素溶液,使淀粉碘化钾试纸变浅蓝,再加0.1~1 mol/L的NaOH溶液调pH值为7~9,得到清液,作为溶液A备用。量取溶液A 21.8 mL加入DMF 3 mL中,4℃预冷10 min,加入三丁胺,混匀;并加入氯甲酸异丁酯,4℃搅拌20 min。称取71.5 mg BSA溶于50%的DMF 10 mL中,4℃预冷。用1 mol/L NaOH调BSA的pH至8。将配制好的溶液A迅速加入BSA中,4℃搅拌反应4 h。取氯霉素半抗原30 mg用1.5 mL水溶解;取50%的GA 10 μL加入前述半抗原溶解液中,室温下搅拌反应18 h;取BSA 100 mg用1.5 mL水稀释后加入前述半抗原溶解液中;反应过夜后加入24 mg NaBH4反应3 h;用三蒸水透析48 h,即得免疫原[16]。
2.1.2 包被原的合成 按2.1.1步骤反应,取氯霉素半抗原30 mg,OVA 100 mg,合成CAP-OVA,供包被用。
2.2 单克隆抗体的制备 用上述制备出的免疫原(CAP-BSA)按150 μg/只,以生理盐水溶解免疫复合物与弗氏完全佐剂等体积混匀,颈背部皮下注射免疫6~8周龄Balb/c雌鼠,初次免疫后第7、14、28天以免疫复合物与弗氏不完全佐剂等体积混匀,各追加免疫1次,融合前3 d以免疫复合物100 μg/只,不加弗氏佐剂再追加免疫1次。按常规方法进行,取免疫小鼠的脾细胞与处于对数生长期的小鼠骨髓瘤细胞(SP2/0)混合,然后在45 s内缓慢加入预热的融合剂(PEG4000)进行融合,用HAT培养基悬浮均匀,再加入适量的饲养细胞,培养于96孔培养板,37℃ 5%CO2培养箱中培养,5 d后用HT培养基半换液,9 d时候进行全换液,得到杂交瘤细胞,将2~3次亚克隆建株后的杂交瘤细胞扩大培养,收集上清液用间接ELISA测定效价,冻存;并取8~10周龄Balb/c小鼠腹腔注射液体石蜡0.5 mL/只,7~10 d后腹腔注射杂交瘤细胞1×106~2×106/只,7~10 d后抽取小鼠腹水,离心取上清,测定效价,并冻存备用[17]。
2.3 酶标单克隆抗体制备 称取5 mg辣根过氧化物酶溶于0.5 mL去离子水中,加入新鲜配制的0.06 mol/L NaIO4水溶液0.5 mL,混匀置冰箱30 min,取出加入0.16 mol/L乙二醇水溶液0.5 mL,于室温放置30 min后加入含5 mg纯化单克隆抗体的水溶液1 mL,混匀并装透析袋对0.05 mol/L pH 9.5碳酸缓冲液缓慢搅拌透析6 h使之结合,吸出后加NaBH4溶液0.2 mL,置冰箱2 h。将上述结合物混合液加入等体积饱和硫酸铵,冰箱放30 min后离心,将所得沉淀物溶于少许0.02 mol/L pH 7.4 PBS中,并对之透析过夜,次日再离心除去不溶物,即得酶-抗体结合物,用0.02 mol/L pH 7.4 PBS加至5 mL进行测定后冷冻干燥保存。
2.4 氯霉素化学发光检测方法的建立[18]
2.4.1 酶标板的制备 用包被缓冲液将氯霉素包被原稀释成10 μg/mL,每孔加入 100 μL,37 ℃温育2 h,倾去包被液,然后在每孔中加入150 μL封闭液,37℃温育2 h,倾去孔内液体,用稀释20倍的浓缩洗涤液洗涤1次,拍干。
2.4.2 确定抗原抗体最佳稀释比例 采用方阵滴定法确定包被原与单克隆抗体的最佳工作浓度。将包被抗原按 160.0、80.0、40.0、20.0、10.0、5.0、2.5、1.25 μg/mL的系列稀释度包被酶标板,将酶标氯霉素单克隆抗体按 1 ∶1000、1 ∶2000、1 ∶4000、1 ∶8000、1 ∶16000、1 ∶32000、1 ∶64000、1 ∶128000、1∶512000的倍数进行稀释,用方阵法确定抗原抗体的最佳稀释比例。
2.4.3 氯霉素化学发光酶联免疫方法标准抑制曲线的绘制 向用氯霉素偶联包被原包被的酶标板微孔中加入浓度分别为 0、20.0、60.0、180.0、540.0和1620.0 pg/mL的氯霉素标准品溶液各50 μL,再加入酶标氯霉素单克隆抗体工作液50 μL,轻轻振荡混匀,用盖板膜封板,25℃恒温箱中反应15 min,倒出孔中液体,重复洗板5次,拍干。每孔加入化学发光显色液100 μL,轻轻振荡混匀,3 min后用微孔板式发光仪测定每个孔的发光强度。每个浓度的标准品溶液的发光强度平均值(RLU)除以第一个标准品溶液(0标准品)的发光强度值(RLU0)再乘以100%,得到百分发光强度值,以氯霉素标准品浓度(pg/mL)的半对数值(lgC)为横坐标,百分发光强度值为纵坐标,绘制标准曲线图。
2.4.4 检测与其他药物的交叉反应率 用于抗体交叉反应性研究的药物均为与氯霉素结构或者功能相似的药物。按试剂盒程序操作,但加入的竞争物分别为不同的氯霉素类似物,制作抑制曲线,根据线性方程计算各竞争物50%抑制浓度(IC50)。交叉反应率(CR%)即为抗体对氯霉素的IC50与抗体对竞争物的IC50之比的百分数,按下式进行计算:

2.4.5 猪肉中氯霉素残留检测 称取(3.0±0.05)g去除脂肪的均质样本至50 mL聚苯乙烯离心管中,加入6 mL乙酸乙酯,用振荡器振荡10 min,4000 r/min,室温(20 ~25 ℃)离心 10 min;移取4 mL上层有机相(约相当于2 g的样本)至10 mL干净玻璃试管中,于50~60℃水浴氮气流下吹干;加入1 mL正己烷,用涡旋仪涡动30 s,再加1 mL磷酸盐缓冲液,用涡旋仪涡动1 min转入2 mL离心管中,4000 r/min,室温(20~25℃)离心15 min;除去上层有机相,取下层50 mL用于分析。
2.4.6 最低检测限、回收率及精密度 取20份空白样品,按照2.4.5项步骤处理后所建立的ELISA方法进行检测。通过标准曲线计算对应的浓度。以20份空白样品对应的样品浓度平均值加上3倍标准差作为样本检测的最低检测限。
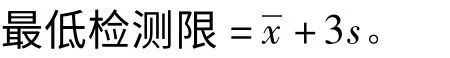
另取氯霉素标准品分别对猪肉样品按照10、20 pg/g进行添加回收试验。分别抽取3个批次试剂盒进行检测,每个浓度做6个重复,每个样品2个平行,计算准确度及精密度。
3 结果
3.1 包被抗原及HRP-CAP单抗最佳稀释倍数经方阵滴定法确定包被抗原浓度为10 μg/mL,HRP-CAP单抗稀释倍数为1∶16000时,试验效果较理想(R2=0.9948、IC50=59.911 pg/mL),因此,确定抗原包被浓度为10 μg/mL,HRP-CAP单抗的稀释倍数为1∶16000。
3.2 竞争反应时间优化 按上述实验方法加入标准品和标记抗体后测定室温下反应10、15、20以及25 min后加入发光溶液,测定0标准品的发光值,结果表明在反应15 min时发光值最大(图1),因此本试剂盒选取反应时间为15 min。
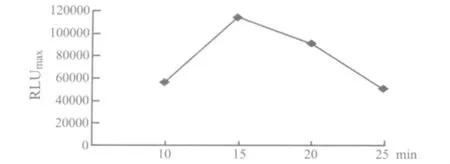
图1 反应时间与发光强度的关系
3.3 标准工作曲线 氯霉素化学发光酶联免疫检测试剂盒的标准工作曲线见图2,IC50值为59.911 pg/mL,线性范围为20~1620 pg/mL。

图2 氯霉素试剂盒标准工作曲线
3.4 试剂盒特异性 氯霉素单克隆抗体对其类似物的交叉反应率见表1。可以看出,该单克隆抗体对其他几种类似物的交叉反应率均较低,其对氯霉素具有较好的特异性。
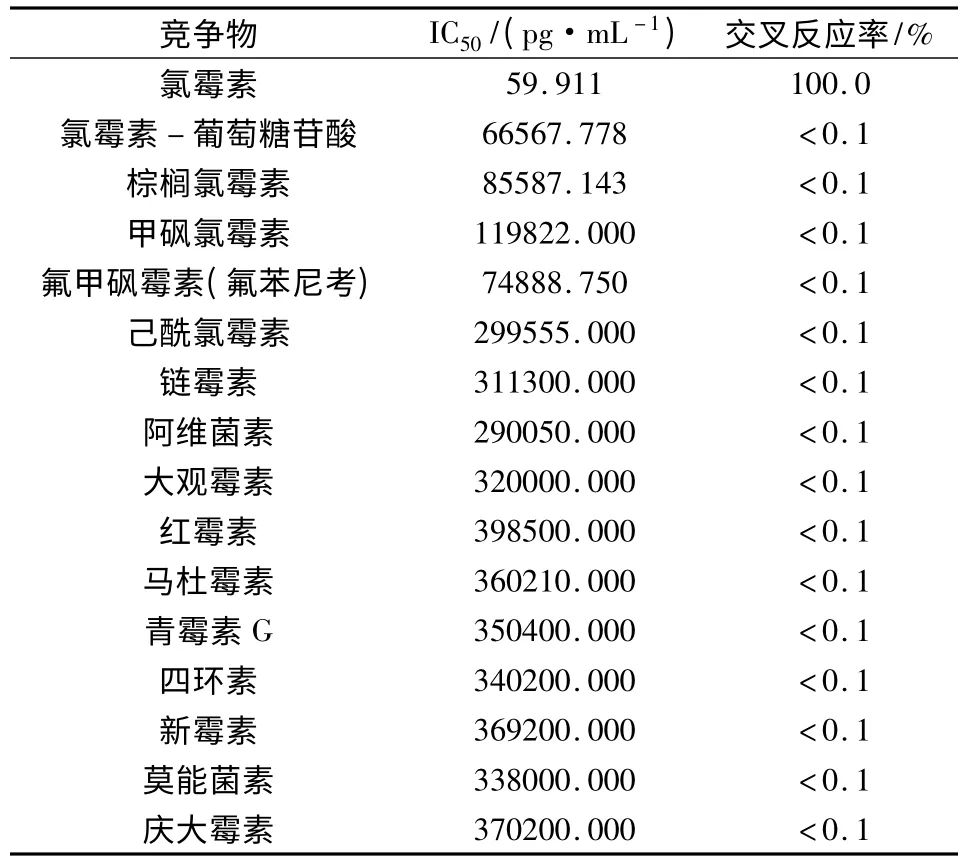
表1 氯霉素试剂盒特异性试验
3.5 最低检测限 对20份空白猪肉样本进行检测,测定结果的平均值加上3倍标准差为该方法对实际样本的最低检测限,结果见表2。由表得出空白猪肉样品平均值为2.65 pg/g,标准差为2.20,最低检测限为9.3 pg/g。

表2 该方法对猪肉的最低检测限 pg/g
3.6 准确度与精密度 ELISA法的准确度以回收率表示,精密度以变异系数来表示。取猪肉样本分别添加氯霉素标准品至10、20 pg/g,对样本进行添加回收试验,分别计算准确度和精密度,检测结果见表3。
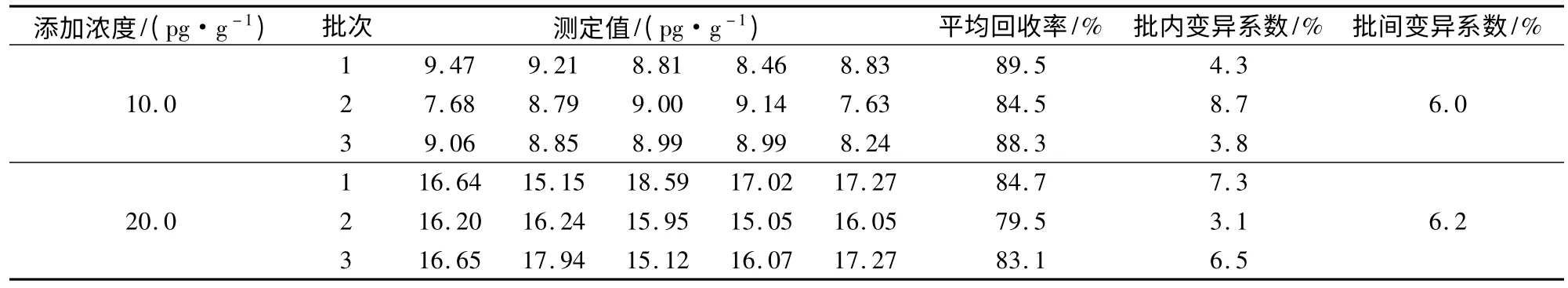
表3 准确度和精密度试验结果
4 结论
由于氯霉素是小分子物质,没有免疫原性,所以必须连接到大分子载体上产生特异性免疫应答[19-20],本试验将氯霉素分别与牛血清白蛋白和卵清蛋白偶联,合成免疫原和包被原[21-24]。本研究根据间接竞争反应原理建立快速检测CAP的一步式化学发光酶联免疫法,经进一步优化,其最佳反应条件为:抗原包被浓度为10 μg/mL,包被温度为37℃,反应2 h,HRP-CAP单抗最佳稀释倍数为 1 ∶16000,竞争反应15 min,洗涤液为 pH 7.4、含0.05%吐温-20的PBST溶液。本研究所制备的单克隆抗体对氯霉素具有很高的特异性(IC50=59.911 pg/mL),并且对氯霉素抑制标准曲线线性良好,对其他氯霉素类似物的交叉反应率较低,该试剂盒的线性范围为20~1620 pg/mL,灵敏度为20 pg/mL,最低检测限为10 pg/mL,样本添加回收率在 76.3% ~94.7%之间,批内变异系数在3.1% ~8.7%之间,批间变异系数在6.0% ~6.2%之间,完全能够满足对于氯霉素残留检测的要求。
2002年1月,美国食品与药品管理局(FDA)公布了禁止在进口动物源性食品中使用氯霉素;欧盟的进口食品卫生标准规定“氯霉素含量标准为不得检出。”我国农业部也于2002年12月明文规定在所有动物的食品中不得检出含有CAP及其盐、酯等。其“不得检出”的含义是氯霉素含量在1 ppb以下,即含量在十亿分之一(ppb)级以下;德国部分州的特殊检测标准为0.2 ppb。本试验方法的各项指标均能满足检测要求。经检验,比常规ELISA的检测效果更好,且可缩短反应时间约60 min。可见,以一步式化学发光酶联免疫法检测动物组织中的CAP残留更符合快速检测的要求,实现了对CAP残留的简便、快速、精确检测。
[1]郝俊虎,王仙琴,闫永利,等.氯霉素残留对出口畜产品的危害[J].饲料研究,2005,(5):3.
[2]马 玲,关忠谊,吴健敏,等.氯霉素残留一步式化学发光酶免疫法的建立[J].南方农业学报,2011,42(2):205-208.
[3]陈 鹏,罗晓琴.氯霉素残留状况及检测方法[J].动物保健,2006,(10):41-42.
[4]王自良,赵 坤,张改平.氯霉素的毒性及其在动物性食品中的残留与检测[J].河南科技学院学报,2005,33(2):101-105.
[5]吴晓丰,杨鹭花.氯霉素残留的危害及其检测方法[J].动物医学进展,2004,25(3):41-43.
[6]刘智宏.酶标免疫测定法(EIA)在检测动物性食品中氯霉素残留的应用[J].中国兽药杂志,1995,29(2):47-48.
[7]Shakila R Jeya,Saravanakumar R,Aunto Princy Vyla S,et al.An improved microbial assay for the detection of chloramphenicol residues in shrimp tissues[J].Innovative Food Science & Emerging Technologies,2007,8(4):515-518.
[8]农业部.中华人民共和国农业部公告第235号[S].
[9]吴 皓,徐青轶.鱼类氯霉素残留检测方法的研究进展[J].水利渔业,2005,25(3):4-5.
[10]谢孟峡,刘 媛,邱月明,等.固相萃取-气相色谱质谱测定动物组织中氯霉素的残留量[J].分析化学,2005,33(1):1-4.
[11]蒋定国,文玉雪.高效液相色谱法测定牛奶中氯霉素残留量的研究[J].中国食品卫生杂志,2003,15(1):36-38.
[12]宋 杰,宋燕青,王勇鑫,等.微生物法在检测牛奶中氯霉素残留的应用[J].河北师范大学学报(自然科学版),2005,29(1):85-87.
[13]高 巍.国产化学发光法孕酮检测试剂盒的评价[J].中国实用医刊,2010,15:15.
[14]胥传来,彭池方,郝 凯,等.化学发光酶免疫方法检测克仑特罗残留[J].分析化学,2005,33(5):699-702.
[15]韩佩珍.化学发光免疫分析[J].国外医学:放射医学核医学分册,2000,24(5):196-201.
[16]肖 智,李培武,张 奇,等.高特异性黄曲霉毒素B1单克隆抗体的制备及特性研究[J].中国油料作物学报,2011,33(1):66-70.
[17]王 谦.抗链霉素单克隆抗体制备与ELISA方法的建立[D].北京:中国农业大学,2003.
[18]王寿利.盐酸克仑特罗单克隆抗体的制备及其间接ELISA检测方法的建立[D].江苏:扬州大学,2009.
[19]吴媛媛,包永明,王 龑,等.氯霉素全抗原的合成与鉴定[J].化学通报(印刷版),2005,68(6):6.
[20]高彬文,张素霞,沈建忠,等.化学发光酶联免疫法检测鱼虾中氯霉素残留[J].中国兽医杂志,2007,43(5):68-69.
[21]Xu Chuanlai,Peng Cifang,Hao Kai,et al.Chemiluminescence enzyme immunoassay(CLEIA)for the determination of chloramphenicol residues in aquatic tissues[J].Luminescence,2006,21(2):126-128.
[22]Ke Li,Liqiang Liu,Chunlai Xu,et al.Rapid determination of chloramphenicol residues in aquaculture tissues by immunochromatographic assay[J].Analytical Sciences,2007,23(11):1281-1284.
[23]石德时,周 斌.氯霉素间接竞争ELISA(ciELISA)检测方法的建立[J].中国预防兽医学报,2002,22(1):77-79.
[24]Cornelis van de Water,Nel Haagsma,Peter J S,et al.An enzymelinked immunosorbent assay for the determination of chloramphenicol using a monoclonal antibody application to residues in swine muscle tissue[J].European Food Research and Technology,1987,185(3):202-207.
