均匀设计法优选仙茅提取工艺的试验
2012-11-23蒲忠慧杜永华尹礼国罗明华
蒲忠慧,杜永华,魏 琴,尹礼国,张 萍,张 龙,罗明华
(1.绵阳师范学院生命科学与技术学院,四川 绵阳621000;
2.宜宾学院 发酵资源与应用四川省高校重点实验室,四川 宜宾644007;3.宜宾学院生命科学与食品工程学院,四川 宜宾644007)
仙茅为石蒜科植物(Curculigoorchioides Gaertn)的干燥根茎,味辛,性热,有毒;具有调节免疫、抗氧化、保肝、抗高血糖、补肾壮阳及抗骨质疏松、抗炎和适应原样等功效[1],可用于阳痿精冷,筋骨萎软,腰膝冷痹,阳痿冷泄等。研究表明,仙茅含有仙茅苷、苔黑酚葡萄糖苷等化学成分[2];仙茅苷对自由基具有明显的清除作用[3],还具有免疫调节[4]和抗骨质疏松[1]等作用。目前,对仙茅的研究主要集中在化学成分及药理活性方面,而对仙茅提取工艺的研究较少,聂诗明等[5]研究过仙茅水提液的提取工艺,对仙茅醇提物的工艺研究,罕见相关报道。因此,本试验采用均匀设计法,以仙茅醇提物中的仙茅苷提取率为指标,选取粒度、乙醇浓度、固液比、浸泡时间及回流时间5个因素,优选出仙茅最佳提取工艺,并对其结论进行了验证,为生产工艺的选择提供科学依据。
1 材料
1.1 药材 仙茅根,产地为四川,购自四川宜宾正源药业有限公司,由其鉴定为石蒜科植物仙茅(CurculigoorchioidesGaertn)的干燥根茎;仙茅苷标准品:购自中国生物制品检定所,生产批号:110771-200904,含量≥98%。
1.2 仪器与试剂 中草药粉碎机(天津市泰斯特仪器有限公司);旋转蒸发仪R502B(上海亚荣生化仪器厂);SW-CJ-IB型超净工作台(苏州净化设备有限公司);恒温水浴锅(巩义市英峪高科仪器厂);所有试剂均为分析纯。
2 方法与结果
2.1 仙茅苷含量的测定
2.1.1 供试液的制备 精密称取仙茅浸膏0.2g,加60mL蒸馏水,超声处理20min,冷至室温,过滤。滤液用乙酸乙酯萃取4次(30、20、15、15mL),合并4次萃取液,水浴蒸干,残渣用50mL甲醇超声溶解,冷至室温,过滤,滤液转至100mL容量瓶中,甲醇定容,摇匀即得。
2.1.2 标准液的制备 精密称取仙茅苷标准品5.0mg,加甲醇溶解后定容至100mL容量瓶中,摇匀即得50μg/mL的仙茅苷标准品溶液。
2.1.3 标准曲线的制备 精密吸取仙茅苷标准液2.0、4.0、6.0、8.0、10.0mL分别置于10mL量瓶中,加甲醇至刻度,摇匀,于282nm处测定吸收度[6],得吸光度和质量浓度回归方程为y=0.0105x-0.0045,R2=0.9996,结果表明,仙茅苷在10~50 μg/mL范围内与吸光度呈良好的线性关系。
2.1.4 精密度试验 精密吸取仙茅苷标准溶液5.0mL,置10mL量瓶中加甲醇至刻度,摇匀,连续测定6次吸光度,RSD为0.41%,结果表明该方法精密度良好。
2.1.5 稳定性试验 精密吸取供试液5.0mL,分别在不同时间测定吸光度,重复3次,取平均值,RSD为4.41%,结果表明该方法稳定性较好。
2.1.6 重复性试验 取同一批仙茅浸膏5份,各取0.2g,按上述供试液制备方法处理,测定吸光度,重复3次,RSD为2.44%,结果表明该方法重现性良好。
2.1.7 回收率试验 取已测得仙茅苷含量的仙茅浸膏5份,各0.2g,分别精密加入仙茅苷标准液10.0mL(500μg),按供试液制备方法处理,计算回收率,平均回收率为92.76,RSD为1.0%,结果表明该方法回收率良好。
2.2 均匀试验设计
2.2.1 均匀试验安排 参考 Fudx[7]等的提取方法,对粉碎粒度、乙醇浓度、固液比、浸泡时间及回流时间5个影响仙茅苷提取率的因素进行考察,选取5因素10水平表(见表1)进行均匀设计,将仙茅根粉碎过筛,取100g,按以下条件(见表2),安排试验。

水平 因素粒度(目)乙醇浓度(%)液固比(倍)浸泡时间(h) 回流时间(h)1 10~20 10 5 0.0 1.0 2 10~20 20 6 0.5 1.5 3 20~40 30 7 1.0 2.0 4 20~40 40 8 1.5 2.5 5 40~60 50 9 2.0 3.5 6 40~60 60 10 2.5 4.0 7 60~80 70 11 3.5 4.5 8 60~80 80 12 4.0 5.0 9 80~100 90 13 4.5 5.5 10 80~100 100 14 5.0 6.0

试验号 因素χ1 χ2 χ3 χ4 χ5 1 1 3 4 5 9 2 2 6 8 10 7 3 3 9 1 4 5 4 4 1 5 9 3 5 5 4 9 3 1 6 6 7 2 8 10 7 7 10 6 2 8 8 8 2 10 7 6 9 9 5 3 1 4 10 10 8 7 6 2
2.2.2 均匀设计试验结果
2.2.2.1 样品含量测定结果 采用均匀设计试验安排的仙茅浸膏的提取结果及仙茅苷提取率结果见表3,由表3可知,试验条件5仙茅浸膏得率和仙茅苷提取率最高,其提取工艺为:粒度40~60目,乙醇浓度40%,液固比13倍,浸泡时间1h,回流时间1h。
2.2.2.2 均匀设计试验结果 采用 Uniform Design Version 3.00对均匀设计试验结果进行后退回归分析,在显著水平α=0.10时,第一次回归方程为y=0.830 1-0.005 1x1+0.000 7x2+0.030 9x3-0.067 0 x4-0.071 8x5,复相关系数:R=0.931 7;决定系数:R2=0.868 1;F检验值(5.267)>F临界值(4.051)回归方程显著,剩余标准差s=0.106 62,显著性检验变量分析见表4。各自变量对仙茅苷的贡献(偏回归平方和)顺序为粒度(0.119 7)>回流时间(0.100 9)>浸泡时间(0.078 1)>液固比(0.058 2)>乙醇浓度(0.003 3)。其中,药材粒度、液固比、浸泡时间和提取时间对仙茅苷提取率有显著影响,而乙醇浓度对仙茅苷提取影响不明显。这是因为仙茅苷是水溶性物质,在乙醇中溶解度不高,在用乙醇对仙茅根粉进行提取时,水溶性杂质相对增高且不便于与待测试成分分离,对仙茅苷提取影响不明显。
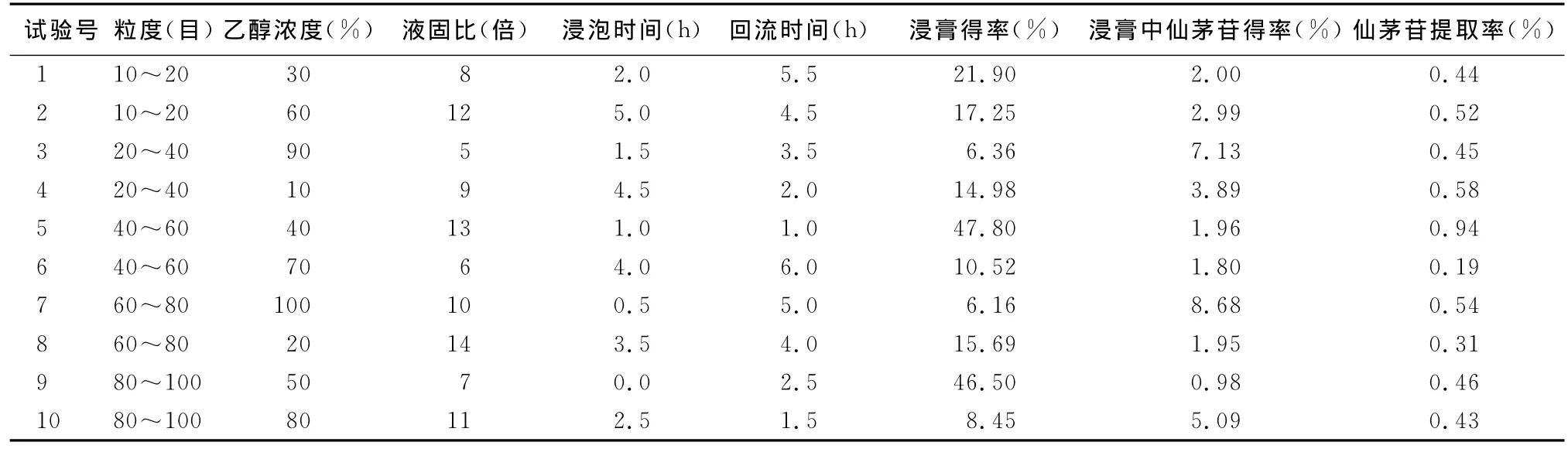
表3 仙茅含量测定结果
2.3 验证试验 按照仙茅苷提取的优化条件进行验证试验。根据回归方程进行优化预测:粒度10~20目,液固比13倍,浸泡时间0h,回流时间1h。按上述条件进行验证,结果显示,煎煮液的仙茅苷含量为0.98%,在预测范围内(1.14%±0.199),表明该优化条件是可行的。

表4 变量分析
3 分析与讨论
3.1 本试验采用紫外分光光度法测定仙茅中仙茅苷含量结果显示,仙茅苷含量(0.94%)与黄灿华等[6]用紫外分光光度法测得的仙茅苷含量(1.03%)相近,而比聂诗明等[5]采用正交试验法优选仙茅煎煮工艺得到的最高仙茅苷含量(50.78mg/100g)高。究其原因,一方面可能是醇提法比水煎煮法更易提取出仙茅中仙茅苷,另一方面也可能是由于提取过程中样品处理方式以及含量测定方法的不同而引起的差异。聂诗明等仙茅将提取液经大孔树脂纯化后再采用高效液相色谱法测定仙茅苷的含量,而本试验所得样品只经过乙酸乙酯萃取纯化处理,可能在处理过程中仙茅苷的损失较少。文献报道[8-9],高效液相色谱法测定仙茅中仙茅苷的含量均在0.1%~0.5%左右,均低于本试验测定的结果,其原因可能是含量测定方法的差异对仙茅苷含量测定结果影响较大。可见仙茅苷含量测定方法的选择是很重要的。
3.2 稳定性试验结果表明,样品溶液在9h以内测定的吸光度值无明显变化,放置22.5h后测得的吸光度有所减少,RSD值偏大(4.41)。这可能是因为仙茅苷受到外界环境中的氧、水分等因素的影响,发生了化学结构的改变,而引起吸光度的变化。因此,供试液应及时进行相关试验,对提取出来的仙茅浸膏、仙茅苷标准品也应及时保存在4℃的冰箱内,这样可保证样品及标准品中仙茅苷的稳定性。
3.3 本试验通过均匀设计法考察仙茅的最佳提取工艺,结果表明,试验条件5仙茅浸膏得率和仙茅苷提取率最高,其提取工艺为:粒度:40~60目,乙醇浓度40%,液固比13倍,浸泡时间1h,回流时间1h。经过后退回归处理结果表明,对仙茅提取结果影响大小依次液固比、粒度、回流时间、浸泡时间,而乙醇浓度对其无影响。对剔除不显著因素乙醇浓度后采用网格尝试优化法[10]对重要的四个因素(粒度、液固比、浸泡时间、回流时间)进行优化,得到最优提取工艺为:粒度10~20目,液固比13倍,浸泡时间0h,回流时间1h,仙茅苷提取率的实测值(0.98%)在预测范围内(1.14%±0.199),表明该工艺条件可行,比较经济,且对提取设备条件要求低,适于工业化生产。另外,通过回归方程找到最优化条件,预测性强,是优化中草药提取工艺的有效方法。
[1]曹大鹏.仙茅抗骨质疏松化学成分及品质评价研究[D].长春:吉林农业大学,2008.
[2]徐俊平,董亲颐.仙茅化学成分的研究及仙茅甙、苔黑酚葡萄糖甙的分离鉴定[J].中草药.1986,17(16):8.
[3]吴琼,程小卫,雷光青,等.仙茅苷对自由基的清除作用[J].中国现代应用药学杂志,2007,24(1):6-9.
[4]Kubo M,Namba K,Nagatnoto N,etal.A new phenolic glucoside,Curculigoside from rhizomes of Curculigo orchioides[J].Planta Medica,1983,47:52-55.
[5]聂诗明,张丽萍,卢水珍,等.正交试验法优选仙茅提取工艺的研究[J].中成药,2002,24(9):665-667.
[6]黄灿华,吴美香,曾卫阳,等.紫外分光光度法测定仙茅中仙茅苷的含量[J].中国药师,2001,3(4):220-221.
[7]Fu d x,Lei G Q,Cheng X W,etal.Curculigoside C,a New Phenolic Glucoside fromRhizomes of Curculigo orchioides[J].Acta Botanica Sinica.2004,4(5):621-24.
[8]刘振丽,宋志前,孙明杰,等.不同地区仙茅中仙茅苷含量测定及酒炙后仙茅苷含量变化[J].中成药,2007,29(3):397-398.
[9]唐正平,李秀兰,周晓非,等.高效液相色谱法测定仙茅超微饮片中仙茅苷的含量[J].湖南中医杂志,2002,18(4):52.
[10]夏念凌.最优化问题的计算机实用算法[M].北京:电力出版社,1990:196.
