CYP17基因单核苷酸多态与子宫内膜异位症和子宫腺肌病易感性的关系
2012-11-23薛素萍曲银娥
张 峰,薛素萍,曲银娥*
(1.河北大学卫生职业技术学院,河北 保定071000;2.河北联合大学基础医学院)
子宫内膜异位症(endometriosis,EMs)是指内膜组织出现在子宫体以外的部位,一般仅见于生育年龄妇女;子宫腺肌病(Adenomyosis,Ad)是指子宫内膜腺体和基质侵入子宫肌层,多发生于40岁以上的经产妇。EMs和Ad均为雌激素依赖性疾病,临床上常可并存,但发病机制及组织学发生不尽相同[1]。细胞色素P45017c羟化酶/17、20裂解酶由CYP17基因编码,是雌激素代谢的关键酶,在一定程度上决定体内雌激素水平。CYP17基因5'非编码区翻译起始点-34bp处T-C单核苷酸多态与前列腺癌[2]和子宫内膜癌[3]等疾病遗传易感性有关,与内异症的关系目前尚存在争议[4,5]。本文应用PCR-RFLP技术,检测了内异症、腺肌病和健康女性CYP17基因-34bp处T-C单核苷酸多态,旨在探讨CYP17基因单核苷酸多态与内异症和腺肌病风险的相关性。
1 材料与方法
1.1 研究对象
选择2007年3月-2009年2月保定市第三医院剖腹或腹腔镜手术的61例子宫内膜异位症患者(内异症组)和59例子宫腺肌病患者(腺肌病组),所有病例均经病理确诊;选择同期在此院体检的健康女性65例为对照组。3组年龄分别为29.47±2.3岁、32.15±1.9岁、30.9±3.2岁,组间比较差异无统计学意义(P>0.05)。所有研究对象无血缘关系,月经周期规律,无其他内外科及内分泌疾病,排除家族性遗传疾病如糖尿病、高血压等疾病,术前三个月无服用激素类药物及免疫抑制类药物。
1.2 主要试剂和仪器
限制性内切酶MspA1I、dNTP和TaqDNA聚合酶为美国Promega公司产品,PCR扩增试剂盒购自加拿大Sangon公司,CYP17引物由北京赛百盛公司合成,凝胶电泳成像系统为FUJI FILM公司产品。
1.3 实验方法
1.3.1 基因组DNA提取 清晨空腹采集5ml静脉血,柠檬酸钠抗凝,蛋白酶K消化-苯酚法提取外周血基因组DNA,-70℃保存。
1.3.2 引物设计与合成 根据Genebank查询的基因序列,用Primer 5软件,设计1对特异性引物,由北京赛百盛公司合成。
上游:5′-CATTCGCACTCTGGAGTC-3′
下游:5′-AGGCTCTTGGGGTACTTG-3′
片段大小为419bp
1.3.3 PCR扩增体系及程序 25μl反应体系:10×PCR buffer 2.5μl、去离子水17.3μl、上下游引物各5μl(20μM)、dNTPs 2μl、Taq聚合酶0.2μl(5U/μl)、模板 DNA 2μl(20ng/μl)。反应程序:94℃预变性5min,94℃变性1min,57℃退火1 min,72℃延伸1min,共35个循环,末次循环后,72℃延伸5min,4℃保存。
1.3.4 酶切鉴定基因型 PCR产物经限制性内切酶MspA1I于37℃酶切过夜,20μl酶切体系:10×NE buffer 2μl、双蒸水12.3μl、PCR产物5μl、100×BSA 0.2μl、MspA1I0.5μl(10U/μl)。取10μl酶切产物经2%琼脂糖凝胶电泳,EB染色,确定基因型。随机选择CYP17 3种基因型PCR产物,送北京赛百盛公司测序验证基因型。等位基因频率=(2×纯合子数+杂合子数)/(2×受检人群)。
1.4 统计学分析
应用SPSS16.0软件进行统计学处理,基因型和等位基因频率采用基因直接计数法计算,χ2检验比较各组间基因型及等位基因频率差异,非条件Logistic回归计算比值比(OR)及95%可信区间(CI),确定基因型与内异症和腺肌病发生的关联强度。
2 结果
2.1 CYP17基因MspA1I酶切后基因型检测结果
PCR产物及酶切产物经2%琼脂糖凝胶电泳,紫外灯下观察结果,可见CYP17基因扩增片段为419bp;CYP17基因-34bp处的T-C碱基置换后,产生一个能被内切酶MspA1I识别的位点,因此PCR产物经MspA1I酶切后,可产生3种基因型:野生纯和型(A1A1)无 MspA1I酶切位点,仅有419bp 1个片段;突变纯和型(A2A2)含有1个酶切位点,被切割为295bp、124bp 2个片段;杂合型(A1A2)被切割为419bp、295bp和124bp 3个片段(图1)。随机选择CYP17 3种基因型PCR产物进行测序验证,显示碱基改变与酶切结果相吻合。
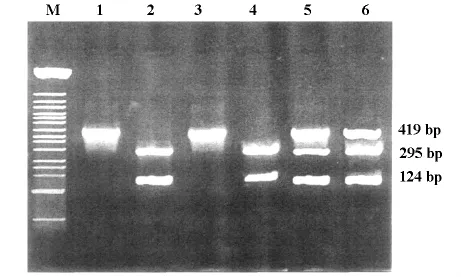
图1 CYP17基因型图谱
2.2 CYP17基因单核苷酸多态与内异症和腺肌病的关系
内异症组和腺肌病组A1A1基因型频率及A1等位基因频率均高于对照组,差异均有统计学意义;内异症组与腺肌病组之间差异均无统计学意义(表1、表2)。3组基因频率分布均符合 Hardy-Weinberg遗传平衡定律。
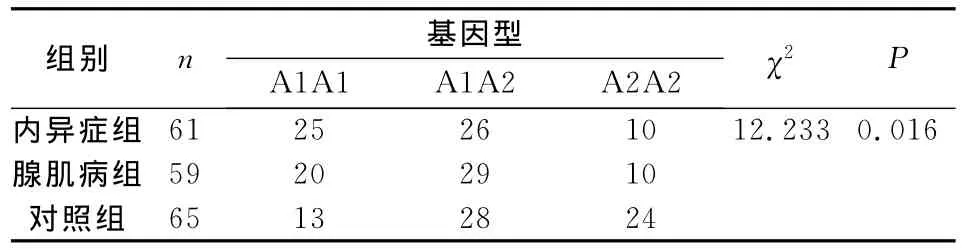
表1 3组CYP17基因型频率比较(例数)
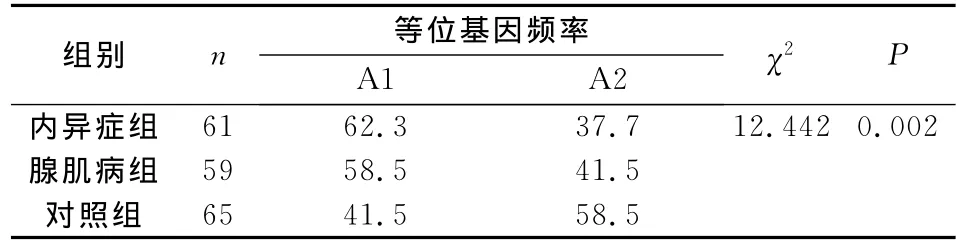
表2 3组CYP17等位基因频率比较 (%)
2.3 CYP17各基因型的相对危险度分析
非条件Logistic回归结果表明:A1A1和A1A2基因型的个体发生内异症的相对危险度(OR)分别是A2A2型个体的4.615倍和3.467倍,发生腺肌病的相对危险度分别是A2A2型个体的3.692倍和3.867倍,差异均有统计学意义(P<0.05),提示A1A1、A1A2基因型可能增加内异症和腺肌病发生的危险性,CYP17基因T-C单核苷酸多态与内异症和腺肌病风险有关(表3)。
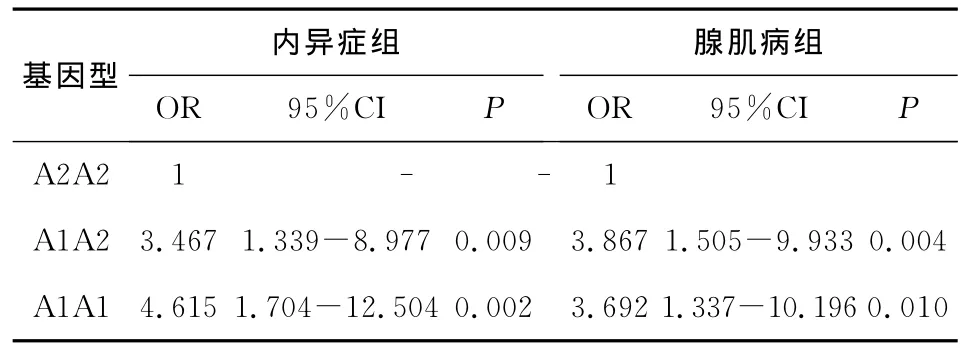
表3 CYP17 3种基因型相对危险度分析
3 讨论
细胞色素P450c17α羟化酶/17、20裂解酶是雌激素合成代谢的关键酶之一,也是雌激素合成过程中的限速酶,介导类固醇17α羟化酶和17、20裂解酶活性,参与胆固醇前体向雄激素、雌激素或孕激素以及盐皮质激素或糖皮质激素的转化,由CYP17基因编码。CYP17基因5′非编码区翻译起始点-34bp处有1个T-C单核苷酸突变,由于T-C的替换产生了限制性内切酶MspA1I的酶切位点,产生Al和A2两种等位基因,当等位基因A2存在时,理论上可以增加基因的转录效率,提高酶的活性,促进雄激素合成增多[6]。
研究中发现,A1A1、A1A2和A2A2基因型频率及A1等位基因频率在腺肌病组和内异症组之间差异无统计学意义,提示腺肌病和内异症在CYP17基因T-C单核苷酸多态方面具有相似的发病机制;危险度分析显示A1A1和A1A2基因型个体发生内异症的相对危险度分别是A2A2型个体的4.615倍和3.467倍,发生腺肌病的相对危险度分别是A2A2型个体的3.692倍和3.867倍,表明A1等位基因为内异症的高危险因素,A1A1和A1A2基因型为内异症和腺肌病的易感基因型。Hsieh等[4]发现CYP17基因的A1纯合子等位基因增加内异症的危险性,李维麟等[7]发现携带A1等位基因的妇女患内异症的风险可能更高,与我们的结论一致。Aban等[8-10]和 Garmer等[11]分别在对子宫内膜癌和卵巢癌的研究中得到相似结论,而王晓莉[12]等发现CYP17基因启动子区T-C多态与成都地区子宫肌瘤发病风险无相关性。CYP17基因多态性增加内异症易感性的机制目前仍不清楚,推测可能由于CYP17基因5′端启动子-34bp处的T-C点突变上调了CYP17基因表达,进而造成雄激素合成增多;同时,可能A1等位基因结合、代谢循环中的雌激素能力较低[13],因此,A1A1和 A1A2基因型个体雌激素水平较高,发生内异症和腺肌病的危险增加,与临床上绝经后内异症和腺肌病病灶逐渐萎缩一致。
由于CYP17基因多态性具有明显的地域和种族差异,且所选择的内异症和腺肌症患者的临床分期、月经周期等不同,加之基因间的相互作用,不同的研究可能得出不同的结论,尚需在不同人群中扩大样本量进一步研究。
[1]乐 杰.妇产科学[M].第6版.北京:人民卫生出版社,2005.354-361.
[2]Wright JL,Kwon EM,Lin DW,et al.CYP17polymorphisms and prostate cancer outcomes[J].Prostate,2010,70(10):1094.
[3]J Gao,YB Xiang,WH Xu,et al,A case-control study on genetic polymorphism of CYP17MspA(1)I and its association with endometrial cancer risk[J].Zhonghua Zhong Liu Za Zhi,2007,29(4):266.
[4]Hsieh YY,Chang CC,Tsai FJ,et al.Estrogen receptor alpha dinucleotide repeat and cytochrome P450c17alpha gene polymorphisms are associated with susceptibility to endometriosis[J].Fertil Steril,2005,83(3):567.
[5]Juo S.H,Wang T.N,Lee J.N,et al.CYP17,CYP1A1and COMT polymorphisms and the risk of adenomyosis and endometriosis in Taiwanese women[J].Human Reproduction,2006,21(6):1498.
[6]Kitawaki J,Kado N,Ishihara H,et al.Endometriosis:the pathophysiology as an estrogen-dependent disease[J].Steroid Biochem Mole Biol,2003,83:149.
[7]李维麟.CYP17单核苷酸多态性的研究进展[J].国际生殖健康/计划生育杂志,2009,28(2):118.
[8]Aban M,Arslan M,Tok E,et al.CYP17genetic polymorphism in patients with endometrial hyperplasia and cancer[J].Int J Gynecol Cancer,2006,16(1):448.
[9]刘 洁,杨兴升.雌激素代谢基因CYP17和COMT单核苷酸多态与子宫内膜腺癌风险的关系[J].山东大学学报(医学版),2007,45(1):18.
[10]Berstein LM,Imyanitov EN,Kovalevskij AJ,et al.CYP17and CYP19genetic polymorphisms in endometrial cancer:association with intratumoral aromatase activity[J].Cancer Letters,2004,207(2):191.
[11]Gamer EI,Erika EE,Berkowitz RS,et al.Polymorphisms of theestrogen metabolizing genes CYP17and catechol O methyltransferase and risk of epithelial ovarian cancer[J].Cancer Res,2002,61(1):3058.
[12]王晓莉,曾 静,王 璟,等.雌激素代谢酶CYP17、CYP1A2基因多态性与子宫肌瘤易感性的关系[J].中国妇幼保健,2011,26(27):4201.
[13]Roberta MC,Heather SFe,Malcolm C,et al.Risk of Endometrial Cancer and Estrogen Replacement Therapy History by CYP17Genotype1[J].Cancer Res,2001,61(2),848.
