前裂长管茧蜂寄生行为对桔小实蝇幼虫生理指标的影响
2012-11-22范一霖龙秀珍李敦松
范一霖,罗 丽,曾 玲*,龙秀珍,李敦松
(1.华南农业大学资源环境学院,广州510630;2.广东省农业科学院植物保护研究所,广州510640)
桔小实蝇Bactrocera dorsalis(Hendel)可为害杨桃、香蕉、柑桔、番石榴等多种水果、蔬菜及野生植物 (Christenson and Foote,1960;Allwood and Drew,1997),食性杂、寄主广泛,对我国的果蔬生产构成巨大威胁 (梁广勤等,2008)。桔小实蝇的寄生性天敌种类较多,近年来,许多学者致力于桔小实蝇寄生性天敌的研究与利用工作,有关研究报道了桔小实蝇的一种寄生蜂-切割潜蝇茧蜂Psyttlia incise(Silvestri),并研究了该蜂对桔小实蝇的功能反应 (季清娥,2004;梁光红等,2006);也有学者研究了昆虫病原线虫对桔小实蝇的控制作用 (林进添等,2005)。
前裂长管茧蜂Diachasminorpha longicaudata(Ashmead)属膜翅目Hymenoptera,姬蜂总科Ichneumonidea,茧蜂科Bracoindae,对实蝇类害虫有很好的控制作用,是利用较为成功的一种。国外对于前裂长管茧蜂的研究工作主要集中于室外释放、田间种群建立并联合其它防治手段进行害虫综合控制 (Wong,1991;Renato et al.,1997)。该蜂由卵、幼虫、蛹及成虫四个阶段构成,以桔小实蝇为寄主时,约经过20 d完成世代发育 (邵屯,2008)。
寄生蜂的寄生作用可以引起寄主各方面生理状况的改变,主要体现在营养代谢、生长发育和免疫等多个方面,也会影响到寄主的生殖系统和神经系统。但尚未有对前裂长管茧蜂寄生寄主桔小实蝇后,引起的寄主各生理指标变化的报道。本文以桔小实蝇-前裂长管茧蜂为研究对象,明确两个问题:一是在桔小实蝇生长发育过程中,不同血细胞类型浓度的变化和血淋巴中蛋白质种类的变化,二是被前裂长管茧蜂寄生后,桔小实蝇幼虫血细胞类型、浓度的变化,血淋巴中蛋白质种类和浓度的变化,以及寄生行为对幼虫发育历期、质量的影响,为利用前裂长管茧蜂控制桔小实蝇提供更好的理论依据。
1 材料与方法
1.1 供试虫源
前裂长管茧蜂于2004年8月从泰国农业部生物防治研究所引进,在华南农业大学生态实验室繁育起稳定的种群。成蜂于养虫笼中饲养,饲以清水以及30%的蜂蜜水补充营养。桔小实蝇采自广州市杨桃公园的落果中,饲养条件为温度25℃(±5),相对湿度70%(±5),使其在室内成功化蛹并羽化后置于养虫笼内,以蒸馏水和人工饲料繁殖3代以上。实验选取同日同批大小基本一致的桔小实蝇幼虫。
1.2 幼虫血淋巴中血细胞浓度和比例的测定
将处于2龄末3龄初的桔小实蝇幼虫以近1∶1的比例置于前裂长管茧蜂养虫笼中,寄生6 h后取出,在体视镜下观测。被寄生的幼虫体表有明显的棕褐色的产卵孔,化蛹后其蛹壳上的产卵孔仍然清晰可见 (图1、图2),筛选出被寄生的桔小实蝇幼虫。

挑选未寄生桔小实蝇2龄、3龄、蛹前期的幼虫为一组进行实验,挑选寄生和未寄生的桔小实蝇幼虫为另外一组进行实验。75%的酒精清洗体表,再用pH=7.4的PBS冲洗3次,滤纸擦干,取幼虫的血淋巴。分别提取各处理幼虫血淋巴10μL,加入10μL的抗凝缓冲剂和20μL的PBS,混合均匀。将细胞计数板置于显微镜下,采用5点取样法,观察3次,取平均值。根据公式计算:血细胞浓度=80个小方格的总数/80×4×106×稀释倍数/mL(郭军英,2009)。
分别取各处理幼虫的血淋巴各10μL,加入10μL的抗凝剂和10μL的PBS,混匀,盖上盖玻片,置于显微镜下,采取5点取样法观察每种细胞的数目,计算出比例。共10个处理,取平均值。
1.3 SDS-PAGE测定幼虫血淋巴中蛋白质种类
用聚丙烯酰胺凝胶电泳法测定蛋白质的种类。取桔小实蝇5日、6日、7日和8日的幼虫为一组进行实验。另挑选寄生行为发生4 h、8 h、24 h和48 h后的被寄生和未被寄生的桔小实蝇幼虫为另一组进行实验。分别取桔小实蝇血淋巴10μL,用Ringer's生理盐水稀释成40μL的蛋白质样品,加入10μL 5×蛋白上样缓冲液,轻轻震荡使其充分混合。100℃下加热5~10 min,离心1 min。取10μL Marker,加入合适的样品孔中,其余样品操作同上。本实验采用的Marker分子量为118、90、50、36、27、20 kDa。浓缩胶采用80V电压,至分离胶时采用120V电压。考马斯亮蓝染色后脱色直至清晰地条带显现出来,Bio凝胶成像仪进行拍照。
1.4 幼虫血淋巴蛋白质浓度的测定
采用考马斯亮蓝法测定幼虫血淋巴蛋白质浓度。在体视镜下挑选出寄生过的幼虫,将寄生过的桔小实蝇幼虫重新置入饲料中饲养,4 h、8 h、20 h、24 h、32 h、48 h后分别提取血淋巴,收集于1.5 mL的离心管中。取同批未寄生的幼虫血淋巴,作为对照,以10000 r/min的速度离心,取上清液,置于-40℃下保存。取6支具塞试管,按表1所示加入不同量的溶液,放置10 min后,于595 nm处测其吸光值,重复3次,取其平均值,绘制出标准曲线。
取若干具塞试管,在试管分别中加入5 mL考马斯亮蓝G-250,再加入1 mL稀释1000倍的寄生和未寄生的桔小实蝇幼虫血淋巴,以空白试剂为对照。在室温下反应5~10 min。使用紫外可见分光光度计在595 nm的条件下测出吸光度值,重复3次,取平均值。根据标准曲线计算得出蛋白浓度。

表1 Braford检测法标准曲线配制Table 1 The formulation of standard graph using Braford
1.5 寄生行为对桔小实蝇幼虫发育历期、体重的影响
选用桔小实蝇4日龄的幼虫,以1∶1的比例放入装有羽化2 d~3 d的前裂长管茧蜂笼中,寄生6 h后取出。分别挑选出30头寄生及未寄生的幼虫,单头饲养。观测其外观、发育历期以及体重的变化。每处理3个重复。
1.6 数据分析
试验数据采用SPSS 14.0软件进行统计分析,使用Excel进行绘图。电泳图用Quantity软件进行图像分析。
2 结果与分析
2.1 不同日龄桔小实蝇幼虫血淋巴中血细胞的浓度、比例差异和蛋白种类差异
桔小实蝇的幼虫血淋巴中存在3种不同类型的血细胞:第1类细胞的细胞膜平滑,显微镜下细胞质细胞核清晰,称之为A类细胞。第2类细胞的细胞膜表面不平滑,有伸出的伪足,称之为B类细胞。第3类细胞的细胞膜表面平滑,但内部物质凝为一团,称之为C类细胞 (C类细胞在幼虫血淋巴中的数量非常少,故在本实验中忽略不计)。
对不同龄期桔小实蝇幼虫血细胞的研究,结果表明,桔小实蝇幼虫血细胞浓度约为15~40×106个/mL,随着虫龄的增加,血细胞的浓度呈上升趋势,从2龄的16.53×106个/mL、3龄的30.14×106个/mL,升至蛹前期的 35.94×106个/mL。在3个发育阶段中,A类 (无伪足)细胞的浓度均显著低于B类 (有伪足)细胞。A类细胞浓度呈现先下降后再上升的趋势,但各个龄期的差异不显著,分别为3.13×106个/mL、2.87×106个/mL、4.87×106个/mL;B类细胞浓度则呈现一直上升趋势,从2龄幼虫的13.4×106个/mL显著升高至 3龄时期的 27.27×106个/mL,再升至蛹前期的31.07×106个/mL,后者差异不显著 (图3)。

在2龄、3龄以及蛹前期的桔小实蝇幼虫血淋巴中,A类 (无伪足)细胞所占的比例比B类(有伪足)细胞的低。3个时期的A类细胞所占的比例分别为22.59%、11.75%、14.41%,即先显著下降后略微上升;B类细胞所占的比例在3个时期分别为77.41%、88.25%、85.59%,呈现先显著上升后略微下降的趋势 (图4)。
经SDS-PAGE,发现桔小实蝇幼虫血淋巴的蛋白条带为12条,在16 kDa~156 kDa的范围内,但是主要的蛋白条带集中在35 kDa~56 kDa的范围内。7日龄和8日龄幼虫血淋巴的拖尾现象相对比较严重,且分子量为43 kDa的蛋白条带较其他几日龄明显,没有明显的特异蛋白出现 (图5)。

图5 不同日龄桔小实蝇幼虫血淋巴蛋白电泳图Fig.5 SDS-PAGE analysis of the protein in the hemolymph among different instars
2.2 寄生行为对幼虫血淋巴中血细胞浓度、比例的影响
实验结果表明,被前裂长管茧蜂寄生后,桔小实蝇血淋巴中A类和B类血细胞浓度均有所下降,但均无显著差异。A类细胞浓度由3.13×106个/mL下降至2.93×106个/mL,B类细胞由28.47×106个/mL下降至18.27×106个/mL(图6)。寄生行为发生后,桔小实蝇血淋巴中的A类血细胞在所有血细胞中所占比例上升,由19.68%上升至28.37%。相应的B类血细胞的所占的比例则下降,由80.32%下降至71.63%,均无显著差异 (图7)。
对细胞形态和大小的观测表明,寄生和未寄生的桔小实蝇幼虫血淋巴中不同类型血细胞基本相同,没有显著的变化。
2.3 寄生行为对桔小实蝇幼虫血淋巴蛋白种类的影响
SDS-PAGE分析结果表明桔小实蝇幼虫的血淋巴蛋白条带有12条,分子量范围为16 kDa~156 kDa,有6条带集中在33 kDa~56 kDa的范围内。寄生和未寄生的蛋白条带差异并不明显,在第3条泳带上出现一条分子量为44.7 kDa的蛋白。这条蛋白在寄生后8 h和未寄生的幼虫血淋巴中均有发现,但是在24 h开始逐步减淡,48 h已经完全消失 (图8)。

图8 被前裂长管茧蜂寄生的和正常桔小实蝇幼虫血淋巴SDS-PAGE图谱的变化Fig.8 SDS-PAGE analysis of the protein in the hemolymph between normal and parasitized B.dorsalis
2.4 前裂长管茧蜂的寄生行为对桔小实蝇幼虫血淋巴蛋白浓度的影响
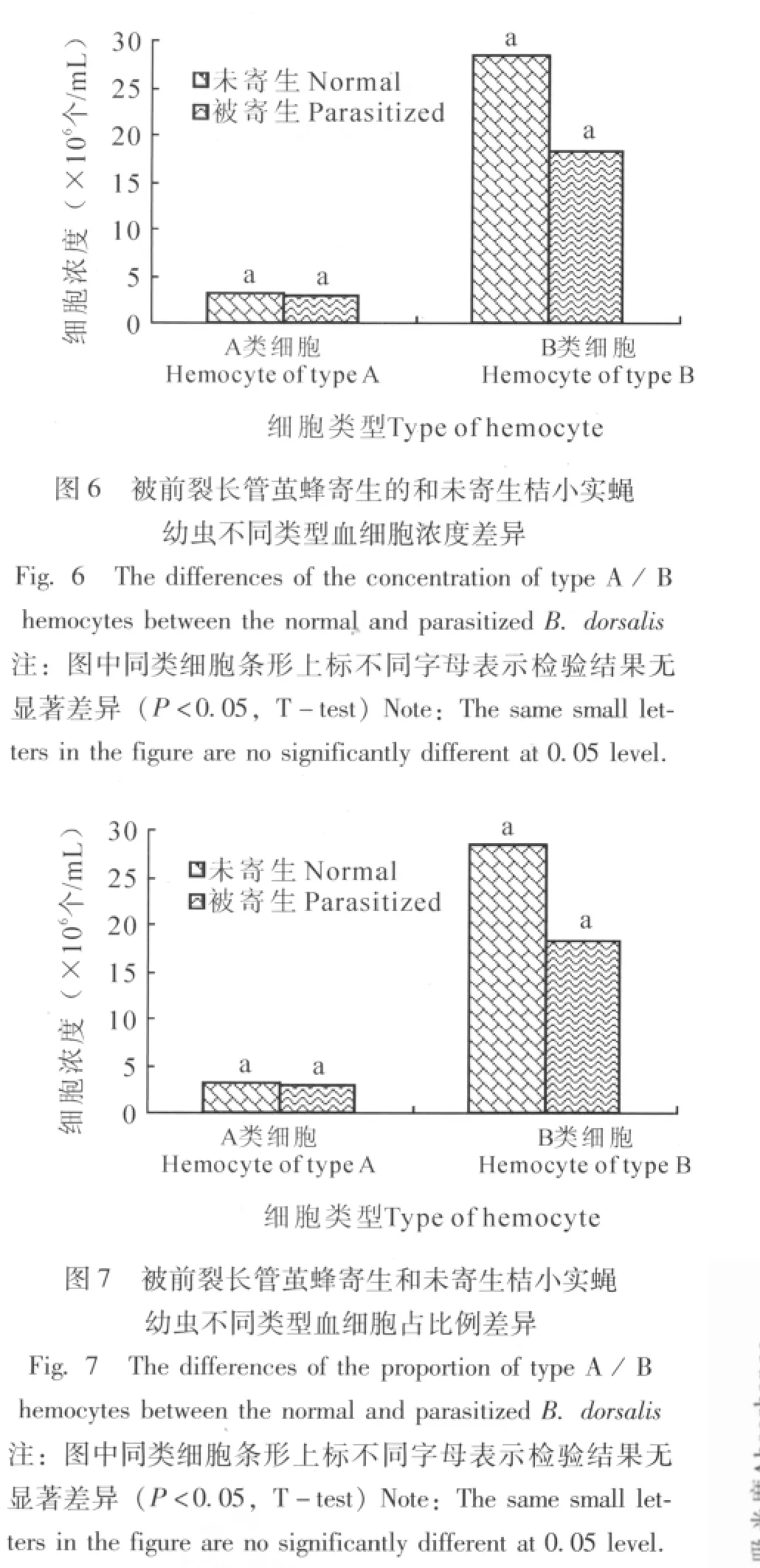
以1.4测出的吸光度值为纵坐标,蛋白浓度为横坐标,绘出标准曲线 (图9)。得到线性回归方程式 Y=0.0005X+0.0103,相关系数 r2=0.9902,表明蛋白质在200μg/mL~1000μg/mL范围内线性关系良好,符合郎伯-比尔 (Lamber-Beer)定律。
图9 蛋白标准曲线Fig.9 The stardard graph
对寄生桔小实蝇幼虫血淋巴中蛋白质的研究结果表明,寄生行为发生4 h后的桔小实蝇血淋巴蛋白质浓度比未寄生的明显降低,且差异显著,此后两者的血淋巴浓度变化趋势相似;22 h后,血淋巴蛋白浓度开始上升,至化蛹前期,蛋白浓度再次下降 (图10)。

图10 被前裂长管茧蜂寄生的和正常桔小实蝇幼虫血淋巴蛋白浓度随时间的变化Fig.10 The protein concentration of normal and parasitized B.dorsalis
2.5 寄生行为对桔小实蝇幼虫化蛹率、发育历期和体重的影响
实验结果表明,被寄生过的桔小实蝇幼虫体表比未寄生的更有通透感和膨胀感,表面更加光滑。寄生行为发生后,桔小实蝇幼虫的发育历期延长,从8 d延长至9~11 d(图11)。
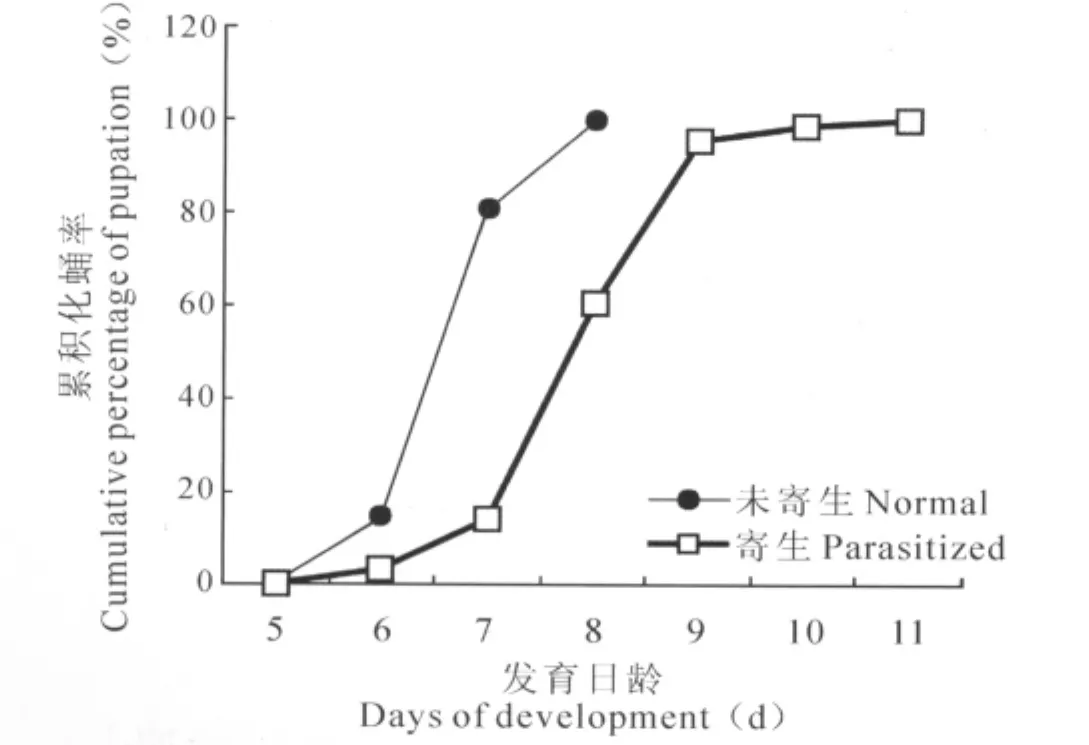
图11 被前裂长管茧蜂寄生的和未寄生桔小实蝇幼虫随发育时间的累积化蛹率Fig.11 The difference of pupation rate between the normal and parasitized B.dorsalis
寄生行为发生后,4、5、6日龄的桔小实蝇幼虫体重差异不明显,均呈逐步上升趋势;自第7 d起,未寄生的桔小实蝇幼虫体重开始下降,而被寄生的桔小实蝇幼虫体重则继续呈现增长趋势直至化蛹 (图12)。

图12 被前裂长管茧蜂寄生和未寄生桔小实蝇幼虫随发育天数的质量变化Fig.12 The difference of weight changes between the normal and parasitized B.dorsalis
3 结论与讨论
血细胞与昆虫的免疫反应有十分紧密的关系,其数量的多少在一定程度上反映了昆虫的免疫能力。在实验过程中发现,2龄时期的桔小实蝇幼虫血细胞浓度最低。而据已有的研究表明,前裂长管茧蜂偏好寄生2龄末3龄初的幼虫 (邵屯等,2008),据此推测前裂长管茧蜂可挑选寄主在生理上已经发育成熟,同时血细胞浓度相对较低的时期进行寄生,以此来尽量避免寄主血细胞的包囊。
血细胞是寄主识别和包囊外源物最重要的因子之一,寄生作用会影响到血细胞的数量和组成。菜粉蝶绒茧蜂Cotesia glomeratus寄生寄主后,引起寄主血细胞总数的升高 (Strand and Pech,1995),而索诺齿唇姬蜂Campoletis sonorensis寄生寄主后,却引起寄主血细胞数量的降低 (Davies,1987)。前裂长管茧蜂寄生后的桔小实蝇幼虫的血细胞在形态和行为上虽没有明显变化,但在浓度和各类型细胞所占比例上均有变化,尤其是B类细胞。这些结果表明寄生行为导致具有伪足的B类细胞浓度大量下降,在一定程度上抑制了寄主血细胞的延展能力。
寄生作用能够影响寄主蛋白质的代谢过程,调节蛋白浓度的高低,从而使其朝着有利于寄生蜂发育的方向变化,甚至会引起寄主血淋巴蛋白种类的变化。寄生行为发生初期,寄主体内血淋巴蛋白浓度的下降,此时蜂卵刚刚发育,无法正常取食,因此直接从寄主的血淋巴中摄取营养物质来满足自身的生长。在寄生22 h后,血淋巴的蛋白浓度开始高于未寄生的幼虫蛋白浓度,寄生蜂自主调节寄主的营养流向,为寄生蜂后期的发育累积更多的蛋白,以提供能量。已有的研究表明,前裂长管茧蜂卵在产出24 h之后,渐渐膨大,近48 h基本完成胚胎的发育。产出32~48 h这段时间,是桔小实蝇由卵孵化为幼虫的关键时期(邵屯,2008)。这与我们的研究成果是一致的,在32~48 h期间,血淋巴蛋白质的浓度快速下降,这说明寄生蜂的生长消耗了大量的营养物质。在寄生后8 h时血淋巴中出现了一条分子量为44.72 kDa的蛋白条带,这个条带在图5中没有被检测出来,因为前者中取血淋巴的相隔周期为1 d,比此实验长,且这条带含量微小,在短时间内消失,因此没有在试验2.1中检测出来。虽然曾出现新的蛋白,但是这在寄生和未寄生的虫体中都有存在,据此推测这条带和桔小实蝇自身的生长发育相关,而与寄生和不寄生无关。
寄生作用可以影响寄主的生长发育、历期变化以及营养代谢的变化 (Beckage and Gelman,2004)。前裂长管茧蜂寄生过的桔小实蝇幼虫发育历期延长,幼虫的质量也呈现逐渐上升趋势。这可能是因为寄生作用促进了寄主营养物质的消化和寄生蜂对营养物质的吸收,使其在寄主体内快速成长。
前裂长管茧蜂寄生桔小实蝇幼虫后,引起了寄主各方面的变化,但是这些变化究竟是何种原因引起的,寄主的不同类型的血细胞在免疫反应中各发挥何种作用,都有待于进一步的研究。
References)
Allwood AJ,Drew RAI,1997.Management of fruit flies in Pacific.ACIAR Proceedings,76:264 -267.
Bautista RC,Harris EJ,1997.Effect of insectary rearing on host preference and oviposition behavior of the fruit fly parasitoid Diachasmimorpha longicaudata.Entomologia Experientalis et Applicata,83(2):213-218.
Beckage NE,Gelman DB,2004.Wasp parasitoid disruption of host development:implications for new biologically based strategies for insect control.Annual Review of Entomology,49:290 -330.
Christenson LD,Foote RH,1960.Biology of fruit flies.Annual Review of Entomology,5:171-192.
Davies DH,1987.Changes in different haemocyte count and in vitrobehavior of plasmatocytes from host Heliothis virescens caused by Cardiochiles nigriceps polydnavirus.Insect Physiol.,33(3):143-153.
Guo JY,2009.The usable method and matters needing attention of blood counting ehamber.Education Equipment and Experiment,25(4):14[郭军英,2009.关于血球计数板的使用及注意事项.教学仪器与实验,25(4):14]
Ji QE,Dong CZ,Chen JH,2004.A new record species——Opius incise Silvestri(Hymenoptera:Braconidae)parasitzing on Bactrocera dorsalis(Hendel)in China.Entomotaxonomia,26(2):144 -145[季清娥,董存柱,陈家骅,2004.桔小实蝇寄生蜂一种新纪录——切割潜蝇茧蜂.昆虫分类学报,26(2):144-145]
Liang GH,Chen JJ,Huang JC,2006.The function response and distrubance response of larvae of Psyttalia incise(Silvestri)to Oriental Fruit Flies.Acta Agriculturae Universitatis Jiangxiensis,28(2):200-204.[梁光红,陈家骅,黄居昌,2006.切割潜蝇茧蜂对桔小实蝇功能反应研究.江西农业大学学报,28(2):200-204]
Liang GQ,Liang F,Zhao JP,2008.Overview of the study on fruit flies quarantine in China.Journal of Environmental Entomology,30(4):361-369.[梁广勤,梁帆,赵菊鹏等,2008.中国实蝇检疫研究概况.环境昆虫学报,30(4):361-369]
Lin JT,Zeng L,Liang GW,2005.Effect of entomopathogenic nematodes on the oriental fruit fly,Bactrocera(Bactrocera)dorsalis(Hendel).Acta Entomologica Sinica,48(5):90-95.[林进添,曾玲,梁广文,2005.病原线虫对桔小实蝇种群的控制作用.昆虫学报,48(5):90-95]
Shao T,Liu CY,Chen KW,2008.Ontogenesis of Diachasm imorpha longicaudata(Ashmead)(Hymenoptera Braconidae).Journal of Environmental Entomology,30(2):147-152.[邵屯,刘春燕,陈科伟,2008.前裂长管茧蜂个体发育研究.环境昆虫学报,30(2):147 -152]
Shao T,Liu CY,Chen KW,2008.Mass-rearing methods of Bactrocera dorsalis(Diptera:Tephritidae)and its larval-pupal parasitoid Diachasm imorpha longicaudata(Hymenoptera:Braconidae).Journal of Environmental Entomology,30(4):377-380.[邵屯,刘春燕,陈科伟,2008.桔小实蝇及其寄生性天敌——前裂长管茧蜂饲养方法.环境昆虫学报,30(4):377-380]
Strand MR,Pech LL,1995.Immunological basis for compatibility in parasitoid- host relationships.Annual of Review Entomology,40:31-56.
Wong TTY,Ramadan MM,McInnis DO,1991.Augmentative release of Diachasmimorpha tryoni(Hymenoptera:Bracoindae)to suppress a Mediterranean fruit fly population in Kula,Maui,Hawaii.Biological Control,1(1):2 -7.
