中国黄酒中香草醛的定性定量分析*
2012-11-21莫新良徐岩范文来
莫新良,徐岩,范文来
1(浙江工业职业技术学院黄酒学院,浙江绍兴,312000)2(江南大学酿酒科学与酶技术中心,酿造微生物与应用酶学实验室,江苏无锡,214122)
香草醛,又名香兰素,是香子兰花荚中的典型香气物质。因其具有令人愉悦的香荚兰豆香气,广泛应用于食品、饮料等领域中,常作为香料添加于糕点、清凉饮料及酒类等食品中起助香作用[1]。香草醛是橡木桶贮存的葡萄酒中的重要香气贡献物质,主要来源于植物中木质素的降解[2]。
目前香草醛的检测方法主要有液相色谱法[3-4]、气相色谱法[2]、分光光度法[5]、电化学法[6]等,这些方法的灵敏度较低且线性范围窄,对于样品中含量较低的香草醛无法检出。近年来有采用气-质联用(GC-MS)方法测定香草醛的报道[7],由于应用了质谱检测器,其定性方便、灵敏度较高,但因样品前处理操作较繁琐,未被广泛应用。因此有必要开发一种简便、快速、且灵敏度高的检测方法来分析样品中的微量香草醛。
黄酒是我国的一种传统发酵酒,由于其营养丰富且风味独特而深受人们喜爱,香气是构成黄酒风味的重要因素,决定着黄酒风味的典型性。国内对于黄酒中的挥发性香气成分已经进行了较全面深入的研究[8-9]。在已有研究中,研究者通过气相色谱闻香法(GC-O),发现香草醛是黄酒中的重要香气物质[8],但有关黄酒中香草醛的含量在文献中未见报道,因此无法根据浓度从香气活力值(OAV)的角度来证实其在黄酒中的重要性。本工作拟采用液-液微萃取结合气-质联用技术分析黄酒中香草醛的含量,用OAV法分析香草醛对黄酒的风味贡献,并对黄酒贮存过程中香草醛的变化规律进行分析,为黄酒中香草醛的形成和作用机理研究及高品质黄酒的开发和生产提供科学依据。
1 材料与方法
1.1 实验材料和仪器
分析样品为:浙江地区,市售黄酒分别命名为ZS-1、ZS-2、ZS-3、ZS-4,以及贮存 4年、5年、6年、9年、11年、12年、13年、14年的原酒;上海地区,市售黄酒分别命名为SS-1、SS-2,大罐新酒命名为SN-1、SN-2;江苏地区,市售黄酒分别命名为JS-1、JS-2,大罐新酒命名为JN-1、JN-2;北方地区市售黄酒分别命名为 BS-1,BS-2。
香草醛(99%,分析纯)和4-(4-甲氧苯基)-2-丁酮(98%,分析纯)购自Sigma-Aldrich(中国)公司;氯化钠分析纯、乙醚(分析纯),购自中国医药(集团)上海化学试剂公司;无水乙醇(色谱纯),美国TEDIA试剂公司。
水浴恒温摇床振荡器(SHA-2型,瑞华仪器),高速冷冻离心机 J-E,美国 Beckman公司;安捷伦气-质联用仪,Agilent 6890 GC-5973 mass selective detector(MSD);MPS2自动进样器,德国Gerstel公司。
1.2 实验方法
1.2.1 标准溶液的配制
准确称取一定量上述香草醛标准品配制到无水乙醇中,再取一定量加入到模拟黄酒中配制成系列浓度梯度的标准溶液,内标溶液为4-(4-甲氧苯基)-2-丁酮,用无水乙醇溶解,终浓度均为98.61 μg/L。模拟黄酒采用超纯水(Milli-Q系统,Millipore,Badford,MA,USA)配制,其中含有2.5 g/L乳酸,10%(V/V)乙醇,配制好的模拟酒将pH值调整到4.0。
1.2.2 样品的浓缩预处理
取15 mL黄酒样品于50 mL的离心管中,加4.5 g NaCl,加入内标4-(4-甲氧苯基)-2-丁酮,终浓度为98.61μg/L,用1 mL重蒸过的乙醚萃取,将其盖好后放置于振荡器上振摇,温度20℃,转速250 r/min,30 min;振荡摇匀萃取完成后,于4℃、8 000 r/min的条件下离心15 min,用0.2 mL的移液枪将上清有机相转移到1mL的小瓶中,取0.1 μL进行GC-MS分析。
1.2.3 GC-MS分析
GC条件:进样口和检测器温度均为温度250℃,载气He,流速2 mL/min;进样量1 μL,不分流进样;色谱分离柱为DB-FFAP(60 m×0.25 mm i.d.×0.25 μm,J&W Scientific);升温程序:100 ℃ 恒温 2 min,以10℃/min的速度升温至 230℃,保持 10 min。
MS条件:电子轰击(EI)电离源,电子能量70 eV;离子源温度230℃;质量扫描范围30~550 amu。
1.2.4 物质的定性与定量
定性方法:采用全扫描的方式(SCAN)获得TIC总离子流图对物质进行分析,未知物通过检出其谱图和NIST05a.L Database(Agilent Technologies Inc.)中标准谱图的比对,以及与该物质标准品的保留时间进行比较来确定。
定量方法:应用内标标准曲线法对香草醛进行定量分析[10-11]。以 4-(4-甲氧苯基)-2-丁酮为内标化合物,采用选择特征离子法(SIM)对化合物峰面积进行积分,经过GC-MS检测后利用待测物质和内标的相对峰面积比代入相对应的标准曲线方程计算出待测物质在黄酒中的含量。
1.2.5 香气活力值(OAV)
香气活力值是香气化合物的浓度与该香气化合物的(以10%乙醇溶液计)香气阈值浓度之比,用以表征某种香气化合物对香气贡献的大小。
2 结果与分析
2.1 萃取溶剂的选择
香草醛是一种极性较强的物质,根据“相似相容”原理,需用极性较强的溶剂来萃取,故本研究讨论了不同萃取溶剂:乙醚、二氯甲烷、乙醚∶二氯甲烷(体积比1∶1)对香草醛萃取效果的影响。发现3种萃取剂的效果相似,香草醛的加标回收率相近,均能满足微量成分的分析要求。而用二氯甲烷、乙醚∶二氯甲烷(体积比1∶1)对香草醛萃取时,一些色素被萃取出来,故选用乙醚作萃取剂。
2.2 特征离子和定量离子的选择及香草醛的定性分析
为消除其它杂质峰的干扰,采用选择特征离子的方法(SIM)对标准品和黄酒样品中的相应化合物进行扫描。图1是香草醛和内标4-(4-甲氧苯基)-2-丁酮的质谱图。由图1A可知,香草醛的碎片离子丰度最大峰 m/z为81,其次为109和123,m/z为152的是其分子离子峰。由图1B可知,内标4-(4-甲氧苯基)-2-丁酮的碎片离子丰度最大峰 m/z为121,其次为43,m/z为178的是其分子离子峰。依据选择离子的原则,本方法所选用的香草醛的特征离子 m/z为81、109 、123和152,其中定量离子为152,内标4-(4-甲氧苯基)-2-丁酮的特征离子m/z为121、178和43,定量离子为121。图2是标准溶液香草醛及内标4-(4-甲氧苯基)-2-丁酮的总离子流色谱图,其出峰时间分别在21.501 min和26.543 min左右。图3是黄酒样品经萃取、离心后香草醛的选择离子流(SIM)色谱图。
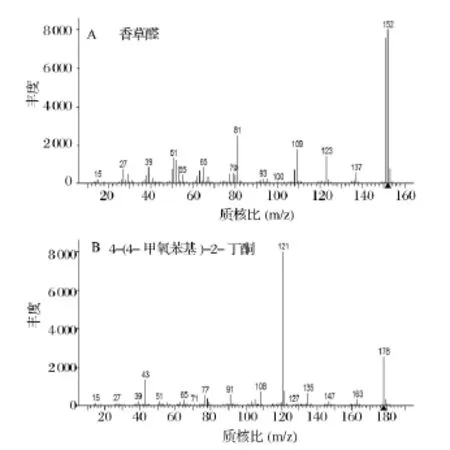
图1 标准溶液香草醛及内标4-(4-甲氧苯基)-2-丁酮的质谱图
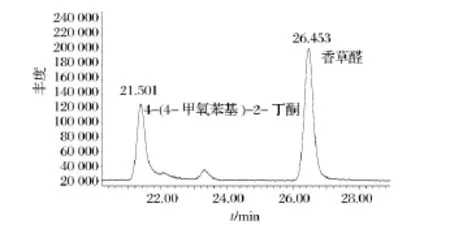
图2 标准溶液香草醛及内标4-(4-甲氧苯基)-2-丁酮的总离子流色谱图

图3 黄酒样品中香草醛的选择离子色谱图
2.3 黄酒中香草醛的定量依据
2.3.1 工作曲线、相关系数、线性范围、检出限与定量限
配制一系列浓度的香草醛标准溶液,对每个浓度水平进行6次重复测定,根据内标标准曲线法,做线性回归分析,结果见表1。方法的线性关系良好,相关性系数为0.999 7。以信噪比(S/N)为3时所对应的标准物浓度值为检出限,以信噪比为10时的浓度值为定量限(表1)。方法的检出限和定量限分别为7.68 μg/L和 23.05 μg/L,满足黄酒中香草醛的检测要求。
2.3.2 回收率和精密度
将不同浓度的香草醛标准样品加到模拟酒和实际样品溶液中,对每个浓度重复测定6次,得到相应的回收率和相对标准偏差(表2)。回收率范围在94.7% ~101.5%,相对标准偏差(RSD)均在10% 以内。能够满足微量成分的准确分析要求。

表1 线性回归方程、相关系数、线性范围、检出限与定量限
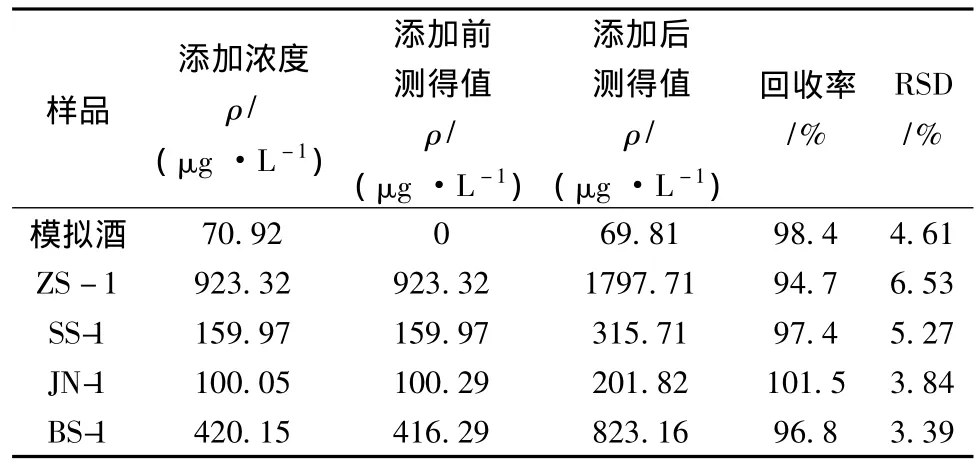
表2 不同样品的分析结果及在不同添加水平下香草醛的平均加标回收率和精密度(n=6)
2.4 黄酒中香草醛的定量分析
表3列出了不同地区不同品种黄酒中香草醛的含量情况。由表可以看出,不同黄酒之间香草醛的含量差异较明显。仔细分析发现,虽然各种黄酒之间存在差异,但是差异之间也有规律可循,即一般市售普通成品酒如ZS-1、ZS-2等中的香草醛的含量(含量在159.97 ~1 112.41 μg/L)均高于新酒如 SN-1、SN-2、等中香草醛的含量(含量在80.12~100.29 μg/L);浙江地区市售普通成品酒如ZS-1、ZS-2、ZS-3、ZS-4等中的香草醛的含量高于江苏、上海(高档酒如SS-3、SS-4、SS-5除外)及北方地区市售黄酒中的含量;更有趣的发现是市售高档成品酒如SS-3、SS-4、SS-5等中的香草醛的含量(含量均大于3 000 μg/L)均高于低档酒如市售普通成品酒SS-1、SS-2等中的香草醛的含量。由此不难推断香草醛这种香气物质在区分不同黄酒的风味差异中起到了非常重要的作用,并且可以推断贮存过程对香草醛在黄酒中含量的影响较大。
2.5 黄酒中香草醛的OAV分析
某种香气物质的绝对含量并不能反映它对黄酒整体香气的贡献,还需要结合它的香气阈值来分析。OAV是指香气化合物的浓度和该化合物香气阈值之比。通常来说,OAV >1.0的化合物会对整体香气有贡献,并且香气活性值大的化合物其香气贡献亦大[12]。查阅文献,香草醛在10% 的酒精溶液中香气阈值为 60 μg/L[13],根据香草醛的香气阈值和浓度之比计算出其在各黄酒中的OAV,结果见表3。由表3可知,在所检测的黄酒中,香草醛的OAV均大于1,因此其对该黄酒的整体香气都有贡献。其中,普通市售成品酒中的香草醛的OAV一般均大于5(SS-1列外),高档市售成品酒(SS-3、SS-4、SS-5)中香草醛的OAV均大于50。因此,从 OAV结果分析,香草醛是黄酒中重要的香气贡献物质。据文献报道在普通红葡萄酒中,香草醛的OAV在0.7 ~ 2.1[13],而本研究结果得到的黄酒中的香草醛的OAV在1.3~67.6,证明香草醛确实是黄酒中有重要贡献的香气化合物,这也是黄酒具有独特的风味而区别于其它饮料酒的重要因素之一。

表3 不同黄酒中香草醛的含量(μg/L)及香气活力值(OAV)
2.6 黄酒贮存过程中香草醛的变化
根据2.4中的分析,贮存过程对香草醛在黄酒中含量的影响较大。因此,考察了浙江地区贮存4年、5年、6年、9年、11年、12年、13年、14年的黄酒原酒中香草醛含量的变化情况,结果见图4。由图4可知,黄酒中香草醛的含量随着贮存时间延长而增加。这种结果和文献报道的啤酒和葡萄酒的储存过程中随着贮存时间延长香草醛的增加情况相类似[14-15]。在葡萄酒贮存中,香草醛主要来源于橡木桶中木质素的热降解[2],在啤酒贮存中香草醛直接源于4-乙烯基癒疮木酚的转化,前驱物质是粮谷类植物细胞壁的阿魏酸[14],而在黄酒贮存中香草醛的来源和形成机理则有待进一步的考察。
3 结论

图4 不同贮存时间的黄酒中香草醛含量的变化
采用液-液微萃取结合气相色谱-质谱联用技术能够快速、有效地分析黄酒中香草醛的含量,结果表明香草醛是区分不同黄酒风味差异的重要香气物质。在所研究的黄酒中香草醛浓度高于其阈值,从OAV角度判断香草醛对黄酒的风味有重要贡献,并发现黄酒在贮存过程中香草醛含量增加,但其在贮存过程中的形成机理及影响因素有待进一步研究。
[1]Priefert H,Rabenhorst J,Steinbüchel A.Biotechnological production of vanillin[J].Applied Biochemistry and Biotechnology,2001,56(3/4):296-314.
[2]Morales M L,Benitez B,Troncoso A M.Accelerated aging of wine vinegars with oak chips:evaluation of wood flavour compounds[J].Food Chemistry,2004,88(2):305-315.
[3]Rudnitskaya A,Rocha S M,Legin A,et al.Evaluation of the feasibility of the electronic tongue as a rapid analytical tool for wine age prediction and quantification of the organic acids and phenolic compounds.The case-study of Madeira wine[J].Analytica Chimica Acta,2010,662(1):82-89.
[4]Waliszewski K N,Pardio V T,Ovando S L.A simple and rapid HPLC technique for vanillin determination in alcohol extract[J].Food Chemistry,2006,101(3):1 059-1 062.
[5]张国文,倪永年.多元校正-光度法同时测定食品中的香兰素和乙基麦芽酚[J].分析科学学报,2005,21(1):20-23.
[6]Agüí L,López-Guzmán J E,González-Cortés A,et al.Analytical performance of cylindrical carbon fiber microelectrodes in low-permitivity organic solvents:determination of vanillin in ethyl acetate[J].Analytica Chimica Acta,1999,385(1-3):241-248.
[7]孙蕊,郑永杰,张榕.白酒中香草醛两种测定方法的研究[J].齐齐哈尔大学学报,2009,25(6):68-70.
[8]罗涛.清爽型黄酒香气特征及麦曲对其香气的影响[D].无锡:江南大学生物工程学院,2008.
[9]罗涛,范文来,徐岩,等.我国江浙沪黄酒中特征挥发性物质香气活力研究[J].中国酿造,2009,203(2):14-19.
[10]Mo xinliang,Xu yan,Fan wenlai.Characterization of aroma compounds in Chinese rice wine Qu by solvent-assisted flavor evaporation and headspace solid-phase microextraction[J].Journal of Agricultural and Food Chemistry,2010,58:2 462-2 469.
[11]Mo xinliang,Xu yan.Ferulic acid release and 4-vinylguaiacol formation during Chinese rice wine brewing and fermentation[J].Journal of the Institute of Brewing,2010,116(3):304-311.
[12]Grosch W.Evaluation of the key odorants of foods by dilution experiments,aroma modelsand omission[J].Chemical Senses,2001,26(5):533-545.
[13]Culleré L,Escudero A,Cacho J,et al.Gas chromatography-olfactometry and chemical quantitative study of the aroma of six premium quality Spanish aged red wines[J].Journal of Agricultural and Food Chemistry,2004,52(6):1 653-1 660.
[14]Vanbeneden N,Saison D,Delvaux F,et al.Decrease of 4-vinylguaiacol during beer aging and formation of apocynol and vanillin in beer[J].Journal of Agricultural and Food Chemistry,2008,56(24):11 983-11 988.
[15]Cerdan T G,Mozaz S R,Azpilicueta C A.Volatile composition of aged wine in used barrels of French oak and of American oak[J].Food Research International,2002,35(7):603-610.
