活性炭对丁酮的吸附动力学研究
2017-10-24刘石彩
黄 丽, 杨 华, 孙 康, 刘石彩
(中国林业科学研究院 林产化学工业研究所;生物质化学利用国家工程实验室;国家林业局 林产化学工程重点开放性实验室;江苏省 生物质能源与材料重点实验室, 江苏 南京 210042)
·研究报告——生物质材料·
活性炭对丁酮的吸附动力学研究
黄 丽, 杨 华, 孙 康, 刘石彩*
(中国林业科学研究院 林产化学工业研究所;生物质化学利用国家工程实验室;国家林业局 林产化学工程重点开放性实验室;江苏省 生物质能源与材料重点实验室, 江苏 南京 210042)
研究了2种活性炭(木质活性炭和煤质活性炭)对丁酮的吸附,重点考察了活性炭的吸附时间、吸附温度和丁酮载气流量对丁酮吸附的影响,并用准一级、准二级、Elovich和Bangham 4种动力学模型对活性炭在不同温度条件下对丁酮的吸附行为进行了动力学拟合,确定其动力学吸附模型。实验表明:不同的活性炭对丁酮的吸附过程不同;活性炭对丁酮的吸附是一个吸附和解吸同时存在的过程,当吸附速率和解吸速率相等时,该过程达到吸附平衡;随着吸附温度的升高,活性炭对丁酮的饱和吸附量逐渐降低,说明活性炭对丁酮的吸附过程为放热反应;丁酮载气流量对活性炭吸附丁酮达到饱和的时间以及吸附速率有影响,对AC-1的最终饱和吸附量影响显著,对AC-2的最终饱和吸附量没有显著影响。这2种活性炭吸附丁酮最适宜的吸附温度均为303 K,最佳的载气流量为400 mL/min。在不同温度下对活性炭吸附丁酮的过程进行动力学分析,发现Bangham方程计算得到的相关系数R2大于0.99,因此,活性炭对丁酮的吸附动力学方程符合Bangham动力学方程。
活性炭;丁酮;吸附动力学
活性炭是一种具有发达孔隙结构和巨大比表面积的含碳物质,能够有效吸附环境中的有害物[1],在日常生活中应用十分普遍。作为一种常见的吸附剂,活性炭在环保、化工等领域得到了广泛应用,特别是在工业废气的处理过程中,活性炭常被用于有机溶剂的回收[2]。目前,活性炭已经是人们日常生活和工业生产中不可或缺的重要吸附材料,对活性炭吸附方面的研究十分广泛且深入。丁酮作为一种常用的有机溶剂,应用非常广泛,主要用作工业生产中润滑油脱蜡剂、涂料、有机合成的原料等[3]。近年来,随着丁酮使用量的增多,其在工业尾气中所占的比例不断增大,对其回收再利用显现出较高的经济价值。目前,国内外对于酮类的吸附研究主要集中在对丙酮等酮类研究上[4],对于丁酮的吸附性能研究却不多。因此,本研究对2种不同性质的活性炭在不同吸附条件下对丁酮的吸附行为进行了研究,并对其吸附动力学进行深入的探究,以期从中找出活性炭吸附丁酮的规律,为工业应用中丁酮的吸附回收利用提供理论支持和技术指导,从而达到环境效益和经济效益的共赢局面。
1 实 验
1.1材料与仪器
木质活性炭和煤质活性炭为2种常见的商业活性炭,购于大潮林物产有限责任公司,基本参数如表1所示。

表1 活性炭样品的基本参数
丁酮(分析纯),高纯氮气(99.99 %),吸附管,流量计,恒温水浴锅,ASAP 2020全自动比表面积和孔隙测试仪等。
1.2测定方法
根据 GB/T 12496.5—1999的测定方法,仿照四氯化碳吸附率测定的实验装置,将丁酮发生器置于298 K的常温水浴器中,通过N2将丁酮发生器里的丁酮吹入已知质量的活性炭样品吸附管(吸附管放置在不同的温度下),并每隔5 min称量吸附管及炭样质量,直到质量不再增加为止,记录吸附管及炭样的质量随时间的变化,根据重量法分别计算不同吸附温度(293、303、313和323 K)、不同丁酮载气流量(300、400、450 和500 mL/min)等条件下活性炭对丁酮的吸附量,计算公式见式(1)。
qt=(mt-m2)/(m2-m1)
(1)
式中:qt—t时刻活性炭对丁酮的吸附量,g/g;m1—吸附管+塞子的质量,g;m2—吸附前吸附管+塞子+炭样的质量,g;mt—t时刻吸附管+塞子+炭样+丁酮的质量,g。
1.3吸附动力学方程
吸附动力学是描述吸附剂对吸附质吸附过程的重要手段,主要是用来反映吸附剂吸附溶质速率的快慢,通过动力学模型对活性炭吸附数据进行拟合,可以得到相关参数,从而深入探究其具体的吸附机理[5-6]。为了能够全面研究活性炭对丁酮的吸附动力学行为,找到最适合的吸附动力学模型,本研究选用了准一级、准二级、Elovich和Bangham 4种动力学模型,对不同吸附温度下的吸附数据进行origin非线性拟合。
1.3.1准一级动力学吸附模型 采用Lagergren方程[7]计算吸附速率:
dq/dt=k1(qe-qt)
(2)
对式(2)从t=0到t>0(q=0到q>0)进行积分,可以得到:
qt=qe-qee-k1t
(3)
式中:qe—平衡态吸附量,g/g;k1—准一级动态吸附速率常数,min-1。
1.3.2准二级动力学吸附模型 吸附速率计算式[8]为:
dq/dt=k2(qe-qt)2
(4)
对式(4)从t=0到t>0(q=0到q>0)进行积分,整理后可以得到:

(5)
式中:k2—准二级吸附速率常数,g/(g·min)。
1.3.3Elovich动力学方程模型 Elovich动力学方程[9]是20世纪30年代由Elovich提出的,认为吸附速率随着吸附剂表面吸附量的增加而呈指数下降,其简化的数学表达式为:
qt=(/βE)ln(αE/βE)+(/βE)lnt
(6)
式中:αE—初始吸附速率常数,g/(g·min);βE—脱附速率常数,g/g。
1.3.4Bangham动力学方程模型 Bangham方程[10]公式可以写成如下形式:
dq/dt=k(qe-qt)/tz
(7)
对式(7)从t=0到t>0(q=0到q>0)进行积分,整理后可以得到:
qt=qe-qe/ektz
(8)
式中:t—时间,h;z—常数;k—常数,min-2。
2 结果与讨论
2.1吸附条件对吸附的影响
2.1.1吸附时间 吸附时间是反映吸附剂性能的重要指标[11],在丁酮载气流量400 mL/min、吸附温度303 K的条件下,AC-1和AC-2对丁酮的吸附量随时间的变化曲线见图1。
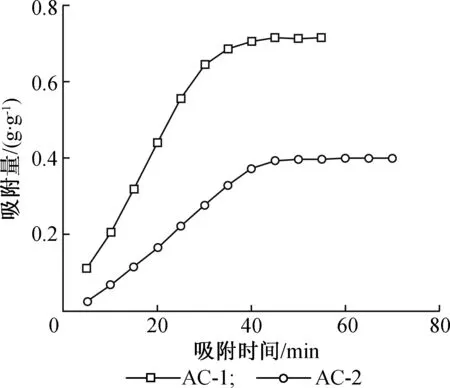
图1 吸附时间对AC-1和AC-2吸附丁酮的影响Fig. 1 Effect of time on the adsorption of butanone on AC-1 and AC-2
由图1可以看出,AC-1和AC-2吸附丁酮呈现相似的趋势。在吸附初期,都是随着吸附时间的延长,吸附量逐渐增多。但是,AC-1的曲线斜率较大,说明其吸附速率较AC-2的大。2种炭样均在45 min时基本达到吸附平衡。此时AC-1对丁酮的吸附量为 0.715 4 g/g,AC-2对丁酮的吸附量为 0.399 2 g/g。此后,丁酮的吸附值基本保持不变,说明2种炭样均已接近饱和状态。再继续吸附丁酮时,吸附量略有降低,说明活性炭对丁酮的吸附是一个吸附与解吸同时存在的过程[12]。
2.1.2吸附温度 在丁酮载气流量为400 mL/min的条件下,改变吸附温度(293、303、313、323 K),分别记录AC-1和AC-2对丁酮的吸附过程,结果如图2所示。
由图2可知,在不同的温度条件下,AC-1和AC-2对丁酮的吸附达到饱和的时间不同。在293 K时两者达到饱和吸附所需的时间均为最长,这是因为在293 K时,温度过低,丁酮分子的移动速率不如温度高时活跃。随着温度的升高,丁酮分子移动速率加快,达到饱和吸附的时间逐渐缩短。同时,由图可以看出,温度在293 K以上时活性炭对丁酮的饱和吸附量随着温度的升高呈现逐渐降低的趋势,说明温度与丁酮的饱和吸附量呈现负相关[13]。虽然温度升高加快了丁酮分子的移动速率,但也降低了活性炭的吸附速率,使得丁酮的饱和吸附量降低。这说明丁酮在活性炭上的吸附为放热过程。经分析,最合适的温度为303 K。

图2 吸附温度对活性炭吸附丁酮的影响Fig. 2 Effect of temperature on the adsorption of butanone on activated carbons
2.1.3丁酮载气流量 在吸附温度为303 K的条件下,改变丁酮的载气流量(300、400、450、500 mL/min),分别记录AC-1和AC-2对丁酮的吸附过程,活性炭的吸附过程随时间的变化如图3所示。

图3 载气流量对活性炭吸附丁酮的影响Fig. 3 Effect of carrier gas flow on the adsorption of butanone on activated carbons
由图3可以看出,AC-1和AC-2在不同载气流量下对丁酮的吸附曲线类似,两者都是在载气流量为500 mL/min 时曲线斜率最大。但是在不同的载气流量下,AC-1和AC-2对丁酮的吸附过程达到吸附饱和所需的时间不同。在图3(a)中,载气流量的不同对AC-1吸附丁酮达到饱和吸附量的时间影响非常明显。当载气流量为500 mL/min时,吸附速率最大,达到吸附平衡所需要的时间最短;当载气流量为400 mL/min时,AC-1对丁酮的饱和吸附量最大,为0.715 4 g/g。在图3(b)中,载气流量的不同使得AC-2吸附丁酮的过程中达到吸附饱和的时间不同,但对于最终的饱和吸附量影响却不明显[14]。不同载气流量条件下,AC-2对丁酮的饱和吸附量均维持在0.4 g/g左右。
2.2吸附动力学研究
载气流量为400 mL/min的条件下对活性炭吸附丁酮的动力学进行研究。选用准一级、准二级、Elovich和Bangham 4种动力学模型,对不同吸附温度下的数据进行origin非线性拟合,从而研究活性炭对丁酮的吸附动力学行为,找出最适合此吸附过程的动力学模型。具体的拟合结果如图4和图5所示,拟合所得的各模型参数计算结果如表2所示。
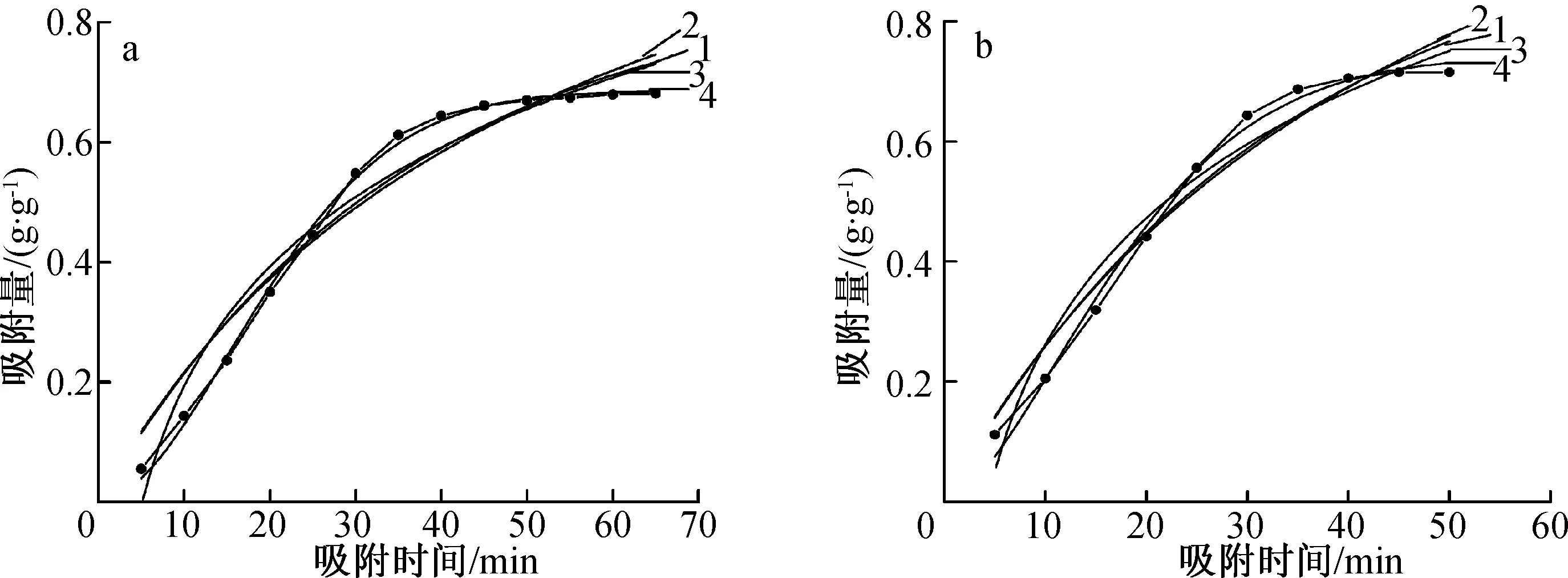

1. 准一级方程pseudo-first-order equation; 2. 准二级方程pseudo-second-order equation; 3. Elovich方程Elovich equation; 4. Bangham方程Bangham equation图4 不同温度下AC-1吸附丁酮的4种动力学方程拟合Fig. 4 Four kinetic plots for the adsorption of butanone on AC-1 at different temperatures


1. 准一级方程pseudo-first-order equation; 2. 准二级方程pseudo-second-order equation; 3. Elovich方程Elovich equation; 4. Bangham方程Bangham equation图5 不同温度下AC-2吸附丁酮的4种动力学方程拟合Fig. 5 Four kinetic plots for the adsorption of butanone on AC-2 at different temperatures
从图和表可以看出,与准一级方程、准二级方程和Elovich方程相比,Bangham方程曲线能够更好的拟合AC-1和AC-2对丁酮的吸附过程。在不同温度条件下,Bangham方程的相关系数均高于0.99。尽管用准一级方程、准二级方程和Elovich方程拟合的相关系数也比较高,但是这3个方程对吸附前期的拟合不如Bangham方程拟合的准确,并且通过Bangham方程计算得到的qe数值与实际实验得到的qe数值非常接近。以上计算结果表明,Bangham方程能够更好地描述AC-1和AC-2对丁酮的动力学吸附过程。

表2 不同温度下活性炭吸附丁酮的4种动力学方程拟合参数
3 结 论
通过研究2种市售活性炭即木质活性炭(AC-1)和煤质活性炭(AC-2)对丁酮的吸附过程,得出以下结论:活性炭对丁酮的吸附是一个吸附和解吸并存的过程。随着吸附时间的延长,活性炭对丁酮的吸附量逐渐增加;随着吸附温度的增大,活性炭对丁酮的饱和吸附量呈现逐渐降低的趋势;载气流量影响活性炭吸附丁酮过程中达到饱和吸附的时间,但是对AC-1的最终饱和吸附量影响显著,对AC-2影响不大。通过对AC-1和AC-2吸附丁酮的过程进行动力学分析发现Bangham方程对实验过程的拟合相关系数均大于0.99,并且用Bangham方程拟合出的饱和吸附量与实验测得的饱和吸附量十分接近。因此活性炭对丁酮的吸附动力学过程遵循Bangham动力学方程。
[1]潘碧云,李彦旭,王军,等. 活性炭吸附挥发性有机气体的影响因素[J]. 广东化工,2008,35(1):81>-83.
[2]杨华,刘石彩. 用活性炭回收挥发性有机溶剂的研究进展[J].生物质化学工程,2014,48(5):52>-58.
[3]王杨薇子,赵寿堂. 热解吸气相色谱法测定工作场所空气中低浓度丁酮的研究[J]. 安全,2013(4):5>-6.
[4]史丽红. 丙酮回收用活性炭吸附性能研究[D]. 南京:南京工业大学硕士学位论文,2014.
[5]KALAVATHY M H,KARTHIKEYAN T,RAJGOPAL S,et al. Kinetic and isotherm studies of Cu(II) adsorption onto H3PO4-activated rubber wood sawdust[J]. Journal of Colloid and Interface Science,2005(292):354>-362.
[6]郭昊,邓先伦,刘晓敏,等. 活性炭吸附正丁烷动力学性能研究[J]. 林产化学与工业,2013,33(4):101>-107.
[7]LAGERGREN S. About the theory of so-called adsorption of soluble substances[J]. Kungliga Svenska Vetenskapsakademiens Handlingar,1898,24(4):1>-39.
[8]HO Y S. Adsorption of heavy metals from waste streams by peat[D]. Birmingham: Ph.D. University of Birmingham,1995.
[9]CHIEN S H,CLAYTON W R. Application of Elovich equation to the kinetics of phosphate release and sorption in soils[J]. Soil Science Society of America Journal,1980,44(2):265>-268.
[10]WANG L,CAO B,WANG S D,et al. H2S catalytic oxidation on impregnated activated carbon: Experiment and modelling[J]. Chemical Engineering Journal,2006,118(3):133>-139.
[11]刘晓敏,邓先伦,王国栋,等. 活性炭对正丁烷的吸附动力学研究[J]. 功能材料,2012,43(4):476>-479,483.
[12]潘碧云,李彦旭,王军. 活性炭吸附挥发性有机气体的影响因素[J]. 广东化工,2008,35(1):81>-83.
[13]孙辉,薛文平,姜莉莉,等. 活性炭纤维吸附苯系物影响冈索的研究[J]. 环境科学与技术,2007,30(7):18>-19.
[14]陈秋燕,袁文辉,关建郁. 影响活性炭吸附苯系物条件的研究[J]. 华南理工大学学报,2000,28(10):117>-120.
Kinetics of Butanone Adsorption on Activated Carbon
HUANG Li, YANG Hua, SUN Kang, LIU Shicai
Two kinds of activated carbons(wooden activated carbon and coaly activated carbon) were used to study the butanone adsorption. The effects of adsorption time, adsorption temperature and the carrier gas flow of butanone on the adsorption performance were discussed. The adsorption kinetics at different temperatures were studied. Equilibrium data were analyzed by four kinetic models which were pseudo-first-order kinetic model, pseudo-second-order kinetic model, Elovich kinetic model and Bangham kinetic model, thus the kinetic model on the butanone adsorption was established. The results showed that the different kinds of activated carbons showed different adsorption performance. Meanwhile, the adsorption and desorption happened at the same time during the process of butanone adsorption on activated carbon. When the adsorption rate equaled the desorption rate, the equilibrium was established. The equilibrium adsorption amount of butanone decreased with the increase of temperature, which also indicated that the butanone adsorption on activated carbon was an exothermic reaction. The carrier gas flow influenced the adsorption time and rate, and the saturated adsorption amount of butanone of AC-1 was influenced and that of AC-2 was not. The optimal adsorption temperature was 303 K and the ideal carrier gas flow was 400 mL/min. It was also found that theR2of Bangham model was more than 0.99, therefore it could be concluded that the adsorption of butanone on activated carbon followed Bangham kinetic model.
activated carbon;butanone;adsorption kinetics
TQ35;TQ424
A
1673-5854(2017)05-0029-07
(Institute of Chemical Industry of Forest Products,CAF;National Engineering Lab. for Biomass Chemical Utilization; Key and Open Lab. of Forest Chemical Engineering,SFA;Key Lab. of Biomass Energy and Material,Jiangsu Province, Nanjing 210042, China)
10.3969/j.issn.1673-5854.2017.05.005
2016- 07-25
“十二五”国家科技支撑计划资助(2015BAD14B06);国家自然科学基金资助项目(31400510)
黄 丽(1991— ),女,湖北黄冈人,硕士生,主要从事生物质炭材料的制备及应用研究
*通讯作者:刘石彩,研究员,硕士生导师,主要从事生物质能源及活性炭研究;E-mail:lshiccai@sina.com。
