小麦秸秆同步糖化发酵制取燃料乙醇*
2012-11-21张伟李文赵继东林燕彭兆城王欣泽
张伟,李文,赵继东,林燕,彭兆城,王欣泽
1(上海交通大学环境科学与工程学院,上海,200240)2(长安大学环境科学与工程学院,陕西 西安,710064)3(大理州环境保护局,云南大理,671000)
生物质燃料,作为一种能够替代传统化石燃料的新兴能源,越来越受到世界各国的重视[1]。其中,燃料乙醇作为一种环境友好型的生物质燃料,具有燃烧值较高,燃烧后的产物主要为水和二氧化碳,无其他有害气体,所以更受青睐。相对于美国和巴西以玉米和甘蔗为主要原料的燃料乙醇生产方式反而可能导致的CO2排放量增加问题[2](达到生物质燃料温室气体总削减量的17~420倍[3]),利用农业废弃物,如秸秆类木质纤维素原料来生产生物质燃料,能快速、持续降低温室气体的排放,温室气体排放量减少达86%[4],且能避免与人争粮的问题,具有广阔的应用前景。
利用秸秆类木质纤维素来生产燃料乙醇主要包括以下3个步骤:预处理、纤维素酶水解、乙醇发酵[5]。同步糖化发酵(SSF)是将纤维素酶水解过程和乙醇发酵过程整合在一个反应器中同时进行,具有乙醇产率较高,反应速率较快,可降低产物(糖)对纤维素酶活性的抑制作用,且由于反应在同一反应器中进行,具有前期投资成本及运行费用较低等优点。尽管如此,此技术目前尚存在一些难题,如通常酿酒酵母的最佳温度为30~35℃,而纤维素酶水解的最佳温度为45~50℃[6],反应过程中秸秆的固体含量较低,难以提高等问题[7]。
目前提高秸秆SSF过程中乙醇发酵效率主要是利用耐高温酵母或通过温度变化,采用非等温发酵等来实现。Pessani等人以经过热水预处理的柳枝为原料,初始固体含量为8.0%(m/V),利用筛选出的耐热Kluyveromyces maxianus IMB3,在45℃同步糖化发酵168 h后,乙醇浓度达最大值,为22.5g/L[8]。Kang等人以经过氨纤维爆破的大麦秸秆为原料,初始固体含量为16%(m/V),利用耐热Kluyveromyces maxianus CHY1612,通过变化发酵温度:45℃发酵24 h,35℃发酵48 h,最终乙醇浓度可达34.3 g/L,较45℃发酵 72 h 提高了 12.1 g/L[5]。
以上研究考虑了温度对同步糖化发酵的影响,利用酵母对高温的耐受性,从而提高乙醇浓度和产率。然而,秸秆同步糖化发酵产乙醇的过程非常复杂,影响因素也较多,仅从温度方面进行研究和考察,效果还很有限。本文以小麦秸秆为原料,在已实现耐高温发酵性能的发酵系统中,系统研究并考察了温度、固体含量、纤维素酶投加量、酵母菌浓度,对最终SSF系统乙醇浓度及产率的影响,达到了纤维素酶水解和酵母发酵温度的协调,使得同步糖化发酵过程在高温、高固体含量的条件下仍能保持较高的乙醇产率,提高了原料的利用效率,缩短了反应所需的时间,同时也可降低后续乙醇蒸馏的成本。
1 材料与方法
1.1 材料与酶制剂
小麦秸秆:取自太湖周边农村,经1.0%NaOH预处理、105℃烘干、粉碎、过80目筛,待用。
预处理后的小麦秸秆中纤维素、半纤维素和木质素含量如表1所示。

表1 NaOH预处理小麦秸秆成分
纤维素酶:ATCC26921,购自Sigma公司,酶活性为82.22 FPU/mL。
1.2 菌种和培养基
酿酒酵母:S.cerevisiae BY4742,本实验室驯化后得到的耐高温高产菌株。
液体培养基:葡萄糖20 g/L,蛋白胨20 g/L,酵母粉10 g/L,121℃灭菌30 min。
1.3 酵母菌复活及扩培方法
1.3.1 酵母菌复苏
取保存于-80℃的酿酒酵母S.cerevisiae BY4742,于37℃恒温180 r/min振荡培养14~18 h,然后将培养后菌体混合液在4 000 r/min条件下离心5 min,弃上清液,加200 mL无菌水,混匀,离心,直至上清液澄清。
1.3.2 酵母菌扩培
在离心过后的菌体中加入50 mL无菌水,混匀,分别取0.5 mL接种于8个装有250 mL培养基的锥形瓶中,于37℃摇床恒温180 r/min振荡培养14~16 h。扩培的酵母菌在4 000 r/min条件下离心5 min,弃上清液,加200 mL无菌水,混匀,离心,直至上清液澄清。
1.4 秸秆同步糖化发酵操作
小麦秸秆同步糖化发酵过程中的影响因子及其水平设计如表2所示。所有同步糖化发酵实验均做3个平行样,每个样品总有效体积为10 mL,并通过柠檬酸-柠檬酸钠缓冲液控制pH为4.0,总发酵时间为120 h,每24 h取样,4 000 r/min离心10 min,取上清液,样品经0.45 μm滤膜过滤后于2 mL棕色样品瓶中4℃保存。
1.5 分析方法
1.5.1 成分分析方法
预处理小麦秸秆中纤维素、半纤维素、木质素含量的测定根据NREL标准方法[9]进行。
1.5.2 滤纸纤维素酶活测定
Sigma纤维素酶的滤纸纤维素酶活的测定根据IUPAC标准方法[10]。滤纸纤维素酶活力的单位为FPU/mL,1FPU定义为1min内,纤维素酶水解Whatman No.1滤纸所产生的葡萄糖量[11]。
1.5.3 还原糖和乙醇的测定
葡萄糖、木糖、乙醇浓度通过高效液相色谱(Shimadzu 10-AD,Kyoto,Japan)进行定量分析,检测器为示差折光检测器(RID-10A,Shimadzu,Kyoto,Japan)。色谱柱使用 Aminex HPX-87P column(Bio-Rad,USA),并带有保护柱。柱温为65℃,检测器温度为40℃,流动相为超纯水,流速为0.8 mL/min,注射体积为 20 μL。
1.5.4 计算公式
纤维素水解产生葡萄糖的化学方程式如公式(1)所示,理论上,100 g纤维素可产生111.1 g葡萄糖。葡萄糖发酵产乙醇的化学方程式如公式(2)所示。理论上,100 g葡萄糖产生51.1 g乙醇和48.9 g CO2。则100 g纤维素理论上产生56.8 g乙醇。预处理小麦秸秆中纤维素含量为58.84%,则100 g预处理小麦秸秆理论上最多能产生33.4 g乙醇。
本研究中定义乙醇产率(Y)为同步糖化发酵过程中,每克预处理小麦秸秆产生的乙醇量与理论产量的比值,如公式(3)所示。

2 结果与分析
2.1 温度对秸秆同步糖化发酵的影响
温度是同步糖化发酵最为重要的一个影响因素,纤维素酶和酵母菌最佳反应温度之间的差异也是影响同步糖化发酵应用最为重要的一个方面。图1为温度对同步糖化发酵过程中乙醇浓度和产率的影响,其中,温度设置为 35,37,38,40,42℃五个水平,所有样品均取自NaOH预处理小麦同步糖化发酵120 h后的发酵液。从图1可以看出,在35~38℃,随着温度的上升,乙醇浓度、产率逐步增加,但趋势逐渐减缓。38℃时乙醇产率达到最大值,为61.08%。温度的升高增强了纤维素酶活性,促进了酶解反应的进行;同时,酶解产生的葡萄糖能为酵母菌迅速利用,一方面减轻了葡萄糖对纤维素酶活性的反馈抑制,促进了酶解反应的进一步进行[12];另一方面,在酿酒酵母的耐受温度范围内,温度的提高能增强细胞中酶活性及维持细胞膜的高渗透性,有利于营养物的进入和乙醇、CO2的排出[13],从而提高了乙醇的浓度和产率。但随着温度的进一步升高,酵母菌的活性受到较大程度的抑制[14],超过耐受温度时,细胞生长速率下降,导致细胞蛋白、RNA、DNA及游离氨基酸都减少,同时,高温也会使细胞膜流动性下降,溶质和必需的营养物质难以进入细胞膜,使酵母呼吸活性明显下降,乙醇产率反而出现下降。Laluce等人利用基因改造S.cerevisiae 63M,优化同步糖化发酵实验,固定原料浓度为100 g/L,发酵温度为30~40℃,乙醇产率呈现先增高后减少的趋势[15]。在本研究中,秸秆同步糖化发酵的最佳温度为38℃,可实现61.08%的发酵效率。
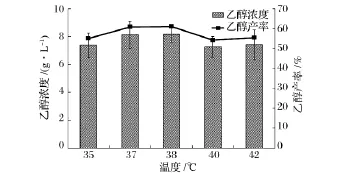
图1 温度对同步糖化发酵过程中乙醇浓度和乙醇产率的影响
2.2 固体含量对秸秆同步糖化发酵的影响
利用秸秆类木质纤维素原料同步糖化发酵生产乙醇,为了降低后续乙醇蒸馏回收成本,应尽可能提高发酵液中乙醇浓度,即应尽可能提高同步发酵过程中底物的固体含量[16]。图2为不同秸秆固体含量下同步糖化发酵120h后发酵液中乙醇浓度和产率。研究发现,固体含量的增加有助于提高乙醇浓度,固体含量为16%(w/v)时乙醇浓度达最大值,为29.06g/L,产率为54.38%。固体含量继续增加到20%(w/v)时,发酵液中乙醇浓度停止增加,并出现了下降。乙醇产率随着固体含量的增加而呈现逐渐下降的趋势。固体含量的提高增加了混匀难度,不利于纤维素酶与秸秆的充分接触;同时低水分的环境也不利于酵母菌的生长和代谢,从而降低了乙醇产率。
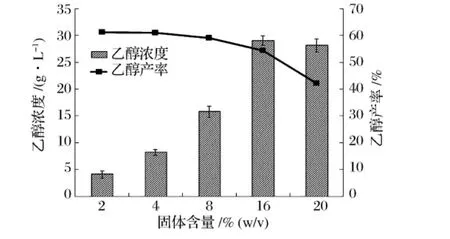
图2 固体含量对同步糖化发酵过程中乙醇浓度和产率的影响
有报道称,一个经济的同步糖化发酵工艺需要秸秆固体含量大于 15%(m/V)[17]。Tomás-Pejó等人研究了固体含量对同步糖化发酵过程中乙醇浓度的影响,初始固体含量设置为10%(m/V),同步糖化发酵12 h后,添加4%(m/V)底物,最终乙醇浓度达最大值,为 36.2 g/L[18]。
本研究中,秸秆固体含量为16%(m/V)时,最终乙醇浓度比固体含量为2%(m/V)时提高了24.97 g/L,且乙醇产率只下降了6.85%,因此,选取秸秆固体含量16%(m/V)为本研究中最佳的固体含量。
2.3 纤维素酶投加量对秸秆同步糖化发酵的影响
同步糖化发酵过程中,固体含量一定时,纤维素酶投加量越高,越有利于底物的转化,但是纤维素酶投加量的增大无疑将增大生产的成本[19]。因此,有必要研究纤维素酶投加量对秸秆同步发酵的影响,结果如图3所示。随着纤维素酶投加量的增加,乙醇浓度和产率均得到了提高。乙醇浓度和产率在纤维素酶投加量为35 FPU/g底物时基本达到最大值,为32.44 g/L和60.70%。
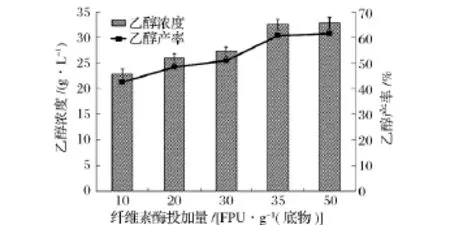
图3 纤维素酶投加量对同步糖化发酵过程中乙醇浓度和产率的影响
Zhao等人利用重组S.cerevisiae ZU-10以经过碱预处理过的玉米秸秆为底物,初始浓度为80 g/L,纤维素酶投加量为20 FPU/g底物,在33℃下进行同步糖化发酵实验,经过72 h后,乙醇浓度达到27.8 g/L[20]。本研究中,纤维素酶投加量为35 FPU/g秸秆时,秸秆中纤维素的有效部位已经被纤维素酶充分吸附,纤维素酶只有吸附于纤维素,水解反应才能进行。纤维素酶投加量为50 FPU/g秸秆时,多余的纤维素酶游离于混合体系中,无助于提高秸秆的水解效率,乙醇浓度和产率基本不变,只比35 FPU/g底物时增加了0.35 g/L和0.66%,故选取35 FPU/g底物作为最佳的纤维素酶投加量。
2.4 酵母菌浓度对秸秆同步糖化发酵的影响
酵母菌浓度对秸秆同步糖化发酵过程中乙醇浓度和产率的影响如图4所示。结果表明,酵母菌浓度的增加总体上有利于乙醇浓度和产率的提高,这是由于随着初始酵母菌浓度的增加,有利于将纤维素酶水解产生的葡萄糖快速发酵转化成乙醇,减少了由于葡萄糖的积累对纤维素酶的毒害作用,促进了反应的进行。
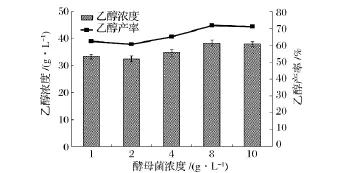
图4 酵母菌浓度对同步糖化发酵过程中乙醇浓度和产率的影响
本研究中,当酵母菌浓度为8 g/L时,乙醇浓度和产率达到最大值,为38.32 g/L和71.71%。当初始酵母菌浓度增加到10 g/L时,由于生物量太大,而酶解产生的葡萄糖有限,不能维持酵母菌正常的生成和代谢,乙醇浓度和产率均开始下降。适宜的酵母菌浓度能缩短同步发酵周期,提高乙醇产率。本研究中选取8 g/L为酵母菌浓度。
2.5 时间对秸秆同步糖化发酵的影响
图5为时间对同步糖化发酵过程的影响。可以看出,NaOH预处理过的小麦秸秆同步糖化发酵24 h后,发酵液中的乙醇浓度即可达到30.02 g/L,产率为56.18%。木糖浓度在24 h后基本已达最大值,为13.34 g/L。延长同步糖化发酵时间,乙醇浓度逐渐增加,但变化趋势相对缓慢,120h时乙醇浓度达38.32 g/L,产率达 71.71%,较 24h时提高了15.53%,此时木糖浓度为12.94 g/L。0~24 h乙醇平均生产率达1.25 g/(L·h),0~120 h乙醇平均生产率则下降为0.32 g/(L·h)。
时间的延长有利于乙醇浓度和产率的增加,但平均发酵速率却逐渐减小。这是由于0~24 h由于纤维素酶对秸秆中纤维素的快速吸附水解,产生的葡萄糖为酵母菌快速发酵产生乙醇,使得乙醇浓度较快增加。之后,一方面由于随着可供水解底物的减少,产生的乙醇对纤维素酶活性的抑制以及纤维素酶的脱附等因素,水解速率减缓,同时,随着发酵液中乙醇浓度的增加,乙醇对酵母菌毒性增大,细胞形态发生变化,细胞结构变得松散,细胞呼吸、生长受到抑制,甚至不再增长,发酵能力削弱;另一方面,由于酵母菌自身的增殖,需消耗较多营养维持自身正常生长,从而降低了乙醇平均产率。
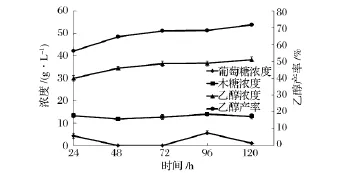
图5 最优同步糖化发酵条件下葡萄糖、木糖、乙醇浓度、产率随时间的变化
本实验中,考虑到120 h时乙醇浓度、产率和对原料的利用效率均较高,故选取120 h为小麦秸秆同步糖化发酵时间。
3 结论
利用S.cerevisiae BY4742同步糖化发酵NaOH预处理小麦秸秆制取燃料乙醇,通过考察温度、固体含量、纤维素酶投加量以及酵母菌浓度对其发酵性能的影响,得出同步糖化发酵最优条件为:发酵温度38℃,固体含量16%(m/V),纤维素酶投加量35 FPU/g底物,酵母菌浓度8 g/L。在此条件下,经过120 h同步糖化发酵后,乙醇浓度达到最大值,为38.32 g/L,产率达理论产率的71.71%,乙醇平均生产率为0.32 g/(L·h),此时木糖浓度为12.94 g/L。
通过此项研究,使得纤维素酶最佳水解温度和酵母菌发酵温度得到了很好的耦合,且使发酵过程中底物固体含量得到了较大程度的提高,达16%(m/V),大大提高了乙醇浓度和原料的利用效率,还可降低后续蒸馏的成本,促进了利用农业废弃物秸秆制取燃料乙醇的工业化进程。
[1]张桂英,张成明,姜立,等.木薯酒精蒸馏废液循环回用工艺的探讨[J].食品与发酵工业,2012,38(4):34-38.
[2]Searchinger T,Heimlich R,Houghton R A,et al.Use of US croplands for biofuelsincreasesgreenhouse gases through emissions from land-use change [J].Science,2008,319(5867):1 238-1 240.
[3]Fargione J,Hill J,Tilman D,et al.Land clearing and the biofuel carbon debt[J].Science,2008,319(5 867):1 235-1 238.
[4]Wang M,Wu M,Huo H.Life-cycle energy and greenhouse gas emission impacts of different corn ethanol plant types[J].Environmental Research Letters,2007,2(2):024001.
[5]Kang H W,Kim Y,Kim S W,et al.Cellulosic ethanol production on temperature-shift simultaneous saccharification and fermentation using the thermostable yeast Kluyveromyces marxianus CHY1612 [J].Bioprocess and Biosystems Engineering,2012,35(1/2):1-8.
[6]Park I,Kim I,Kang K,et al.Cellulose ethanol production from waste newsprint by simultaneous saccharification and fermentation using Saccharomycescerevisiae KNU5377[J].Process Biochemistry,2010,45(4):487-492.
[7]Tomás-Pejó E,Oliva J M,González A,et al.Bioethanol production from wheat straw by the thermotolerant yeast Kluyveromyces marxianus CECT 10875 in a simultaneous saccharification and fermentation fed-batch process [J].Fuel,2009,88(11):2 142-2 147.
[8]Pessani N K,Atiyeh H K,Wilkins M R,et al.Simultaneous saccharification and fermentation of Kanlow switchgrass by thermotolerant Kluyveromyces marxianus IMB3:The effect of enzyme loading,temperature and higher solid loadings[J].Bioresource Technology,2011,102(22):10 618-10 624.
[9]Sluiter A,Hames B,Ruiz R,et al.Determination of structural carbohydrates and lignin in biomass[R].USA:NREL Laboratory Analytical Procedure,2008:1-14.
[10]Ghose T.Measurement of cellulase activities[J].Pure &Applied Chemistry,1987,59(2):257-268.
[11]Jeya M,Zhang Y-W,Kim I-W,et al.Enhanced saccharification of alkali-treated rice straw by cellulase from Trametes hirsuta and statistical optimization of hydrolysis conditions by RSM[J].Bioresource Technology,2009,100(21):5 155-5 161.
[12]Cuevas M,Sánchez S,Bravo V,et al.Determination of optimal pre-treatment conditions for ethanol production from olive-pruning debris by simultaneous saccharification and fermentation[J].Fuel,2010,89(10):2 891-2 896.
[13]岳昌海,朱许慧,侯文贵,等.甘薯渣酒精发酵条件优化[J].化学工业与工程,2011,28(002):49-54.
[14]Chu D,Zhang J,Bao J.Simultaneous Saccharification and Ethanol Fermentation of corn stover at high temperature and high solids loading by a thermotolerant strain Saccharomyces cerevisiae DQ1[J].Bio Energy Research,2012,5(4):1 020-1 026.
[15]Laluce C,Tognolli J O,Oliveira K F,et al.Optimization of temperature,sugar concentration,and inoculum size to maximize ethanol production without significant decrease in yeast cell viability[J].Applied Microbiology and Biotechnology,2009,83(4):627-637.
[16]Zhang J,Chu D,Huang J,et al.Simultaneous saccharification and ethanol fermentation at high corn stover solids loading in a helical stirring bioreactor[J].Biotechnology and Bioengineering,2010,105(4):718-728.
[17]Tania I,Georgieva X H,Troels Hilstrøm,et al.Enzymatic hydrolysis and ethanol fermentation of high dry matter wet-exploded wheat straw at low enzyme loading [J].Biotechnology for Fuels and Chemicals,2008,148(1-3):35-44.
[18]E Tomás-Pejó J M O,A González,I Ballesteros,et al.Bioethanol production from wheat straw by the thermotolerant yeast Kluyveromyces marxianus CECT 10875 in a simultaneous saccharification and fermentation fed-batch process[J].Fuel,2009,88(11):2 142-2 147.
[19]Liu Q,Cheng K-k,Zhang J-a,et al.Statistical optimization of recycled-paper enzymatic hydrolysis for simultaneous saccharification and fermentation via central composite design [J].Applied Biochemistry and Biotechnology,2009,160(2):604-612.
[20]Zhao J,Xia L.Simultaneous saccharification and fermentation of alkaline-pretreated corn stover to ethanol using a recombinant yeast strain [J].Fuel Processing Technology,2009,90(10):1 193-1 197.
