β-胡萝卜素的合成工艺改进
2012-11-21金潇,徐亮
金 潇, 徐 亮
(四川大学 华西药学院,四川 成都 610041)
β-胡萝卜素(6)是一种广泛存在于绿色蔬菜和水果中的色素,是人体内维生素A的重要来源,具有保护视力、防癌、抗癌、防衰老、防治白内障、抗辐射线和提高机体免疫力等生理功能。现已广泛用作药品、食品、化妆品的着色剂、营养强化剂和饲料添加剂,同时用于红细胞生成性原卟啉症光敏病、口腔溃疡、 口腔白斑等的治疗和放疗、化疗的辅助治疗[1,2]。
6的合成路线较多[3~10],其工业上的合成路线主要有以Grignard反应为特征的Roche公司路线(简称Roche路线)[6~8]和以Wittig反应为特征的BASF公司路线(简称BASF路线)[9,10]。 BASF路线由于更为简洁而显得相对重要,其中的关键中间体2,7-二甲基-2,4,6-辛三烯-1,8-二醛(5)的高效合成是该合成工艺的关键。 BASF[10]路线以1,4-二氯-2-丁烯为起始原料,经Wittig-Horner等四步反应合成5,由于1,4-二氯-2-丁烯价格昂贵,国内未见大规模生产。
近年来,有多篇专利[11~13]方法以呋喃为起始物,经水解得丁烯二缩醛(3);3再与丙烯醚发生醇醛缩合可制得5,但关键的缩合反应不易控制,容易发生多聚化反应。2003年,Donate[14]改进此工艺,将3原位水解-Wittig反应制备了5,避免了前述路线中容易发生多聚化的缩合反应,但该方法并未进一步用于6的合成。
本文在文献[14]方法的基础上,经进一步工艺改进,优化操作步骤,以呋喃为原料,经水解、原位水解-Wittig反应、还原、氧化四步反应合成了数十克级规模的5; 5与衍生自β-紫罗兰酮的季鏻盐(2)[15]发生Wittig反应,高收率地合成了6(Scheme 1),其结构经1H NMR确证。

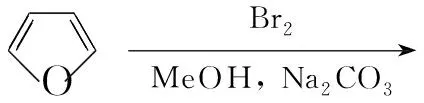
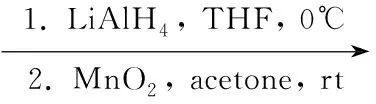
Scheme1
1 实验部分
1.1 仪器与试剂
Varian Unity NOVA-400/54型核磁共振仪(CDCl3为溶剂,TMS为内标)。
柱层析用硅胶,200目~300目,青岛海洋化工厂;薄层层析用GF254硅胶板,烟台江友硅胶开发有限公司;其余所用试剂均为分析纯,其中呋喃和乙酸乙酯用前重蒸,THF和CH2Cl2经干燥处理。
1.2 合成
(1) 乙烯基-β-紫罗兰醇(1)的合成
在反应瓶中加入β-紫罗兰酮19.2 g(100 mmol)的THF(100 mL)溶液,搅拌下于0 ℃滴加乙烯基溴化镁(1 mol·L-1in THF)溶液120 mL,滴毕,于0 ℃反应2.5 h。用饱和NH4Cl溶液焠灭反应,用乙酸乙酯(3×60 mL)萃取,合并有机层,依次用饱和NaHCO3溶液(2×40 mL),饱和NaCl溶液(30 mL)洗涤,无水硫酸钠干燥,浓缩后经硅胶柱层析[洗脱剂:V(石油醚) ∶V(乙酸乙酯)=60 ∶1]纯化得黄色油状液体1 12.5 g,收率57%;1H NMRδ: 0.8(s, 6H), 1.44~1.68(m, 4H), 1.42(s, 3H), 1.66(s, 3H), 1.97(t,J=6.0 Hz, 2H), 5.06~6.12(m, 5H)。
(2) 2的合成
将PPh3·HBr 13.72 g(40 mmol)悬浮于150 mL甲醇中,搅拌下加入1 11.9 g(54 mmol)的甲醇(40 mL)溶液,于室温反应1 h。减压蒸干后用乙酸乙酯(3×100 mL)洗涤,减压干燥得黄色固体2 15.7 g,收率72%;1H NMR(DMSO-d6)δ: 0.94(s, 6H), 1.4(s, 3H), 1.30~1.60(m, 4H), 1.60(s, 3H), 1.94(t,J=6.0 Hz, 2H), 4.65(dd,J=7.6 Hz, 17.2 Hz, 2H), 5.42(m, 1H), 6.00(s, 2H), 7.6~8.0(m, 15H)。
(3) 丁烯二缩醛(3)的合成
在反应瓶中加入呋喃17.6 g(258 mmol)的甲醇(160 mL)溶液,搅拌下于-45 ℃滴加Br242.56 g(266 mmol)的甲醇(100 mL)溶液(3.5 h); 2 h内缓慢升至-10 ℃,反应2 h。分批加入无水碳酸钠粉末70 g(660 mmol),加毕,反应3.5 h;于室温反应18 h。过滤,滤液于(67~71) ℃/133.3 Pa减压蒸馏得无色油状液体3 26 g,收率57%;1H NMRδ: 3.32(s, 12H), 4.82(s, 2H), 5.82(s, 2H)。
(4) 磷叶立德(7)的合成
在反应瓶中依次加入PPh328.82 g(110 mmol)的乙酸乙酯(120 mL)溶液和2-溴丙酸甲酯11.2 mL(100 mmol),搅拌下回流反应24 h。过滤,滤饼用石油醚(4×50 mL)洗涤,加入1 mol·L-1NaOH溶液100 mL,搅拌15 min;用CH2Cl2(3×60 mL)萃取,合并有机层,用水(6×40 mL)洗涤,无水硫酸钠干燥,浓缩得黄色固体7 25.2 g,收率72%。
(5) 十碳三烯双酯(4)的合成
在反应瓶中依次加入3 35.2 g(200 mmol), CH2Cl2300 mL, Amberlyst-15 15 g及H2O 11 mL,搅拌下于室温反应30 min;加入7 71 g(204 mmol),反应3 h;补加Amberlyst-15 15 g,反应2 h;加入7 71 g,反应3 h。过滤,浓缩滤液后经硅胶柱层析[洗脱剂:V(石油醚) ∶V(乙酸乙酯)=30 ∶1]分离得白色固体4 38 g,收率85%;1H NMRδ: 2.00(s, 6H), 3.80(s, 6H), 6.80(m, 2H), 7.30(m, 2H)。
(6) 5的合成
在反应瓶中加入LiAlH424 g (630 mmol)的THF(400 mL)悬浮液,搅拌下于0 ℃滴加4 72 g(320 mmol)的THF(600 mL)溶液,滴毕,于室温反应4 h。依次用水(48 mL), 15%NaOH溶液(48 mL)和水(96 mL)焠灭反应,过滤,滤液用无水硫酸钠干燥,浓缩后用丙酮500 mL溶解;加活性MnO2320 g(3.68 mol) ,于室温反应过夜。过滤,滤液浓缩后用混合溶剂[V(石油醚) ∶V(乙酸乙酯)=25 ∶1]重结晶得黄色晶体5 32.6 g,收率62%;1H NMRδ: 1.98(s, 6H), 6.90~7.10(m, 2H), 9.50(s, 2H)。
(7) 6的合成
在反应瓶中加入5 54 g(329 mmol), 2 447 g(820 mmol)和CH2Cl21.2 L,搅拌使其溶解;于0 ℃分十次加入ButONa 86 g(900 mmol),加毕,于0 ℃反应6 h。加入甲醇4.8 L,于-20 ℃冷冻结晶。过滤,滤饼干燥得红色粉末6 110 g;滤液减压除去CH2Cl2后,于-20 ℃冷冻结晶,过滤,滤饼干燥的红色粉末6 34.5 g。合并两次收集的6(144.5 g),收率82%,总收率43%(以3计)。将6在石油醚(5 mL·g-1)中回流8 h进行异构化,得全反式的红色粉末β-胡萝卜素。1H NMRδ: 1.03(s, 12H), 1.47(m, 4H), 1.61(m, 4H), 1.72(s, 6H), 1.97(s, 12H), 2.02(s, 4H), 6.11~6.16(m, 6H), 6.25(m, 2H), 6.35(m, 2H) , 6.62~6.67(m, 4H)(与标准品数据完全一致)。
2 结果与讨论
2.1 合成
(1) 4的合成
在3经一锅法发生原位水解Wittig反应合成4的研究中,我们发现文献[14]方法(在二氯甲烷中直接加入两当量的7, Amberlyst-15和水)虽经多次重复并增加Amberlyst-15的用量和延长反应时间,但只能得到单侧缩醛发生水解Wittig反应的产物8(Chart 1),几乎不能得到双Wittig产物4。经实验分步研究该反应并仔细筛选反应条件,最后发现在一锅反应中,先加入一摩尔当量7和Amberlyst-15,经TLC控制生成8后,再加入另一摩尔当量7和Amberlyst-15,即可得到期望的4。所用Amberlyst-15总量与文献[14]相当。
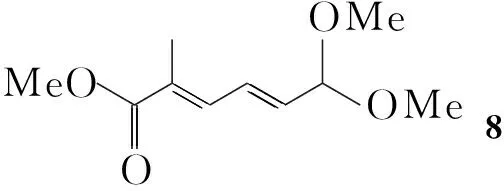
Chart1
(2) 5的合成
在由4还原氧化生成5的研究中,我们发现经LiAlH4还原的醇产物经计量的碱水处理,过滤所得粗产物不经纯化即可用于下步活性MnO2氧化成醛的反应中,所得粗产物5可不需要柱层析分离,直接在乙酸乙酯/石油醚中重结晶即可,两步收率62%。
(3) 6的合成
在优化合成关键中间体5的基础上,通过成熟的与季磷盐2的Wittig反应,百克级的制备得到6。
本文的改进方法为更为经济的工业化大量合成β-胡萝卜素奠定了基础。
[1] 唐刘蕴泉.β-胡萝卜素应用的研究进展[J].肠外与肠内营养,2005,12(2):121-123.
[2] 颜秀花,王正武,王仲妮.β-胡萝卜素的应用及研究进展[J].食品与药品,2007,9(6):58-61.
[3] 周云久,王凤云,姜玉娟,等.β-胡萝卜素合成研究[J].黑龙江医药科学,1998,21(4):32-33.
[4] Hansgeorg Ernst. Recent advances in industrial carotenoid synthesis[J].Pure & Appl Chem,2002,74(8):1369-1382.
[5] F Kienzle. The technial synthese sof carotenoid[J].Pure & Appl Chem,1976,47:180-193.
[6] O Isler, H Lindlar, M Montavon,etal. Synthesen in der carotinoid-reihe.1.Mitteilung.Die technische synthese vonβ-carotin[J].Helvetica Chimica Acta,1956,39(1):249-259.
[7] R Rüegg, M Montavon, G Ryser,etal. Synthesen in der carotinoid-reihe.15.Mitteilung synthesen in derβ-carotinalundβ-carotinal-reihe[J].Helvetica Chimica Acta,1959,42(3):854-864.
[8] Otto Isler, Basel, Herbert Lindal,etal. Prepartions of all-trans-carotinoid compounds[P].US 2 849 507,1958.
[9] Joachim Paust, Neuhofen, Michel Lambsheim. Preparation of beta-carotene products with a high 9(Z) content[P].US 5 689 022,1997.
[10] Dr.-Ing H Pommer. Synthesen in der carotinoid-reihe[J].Angewandte Chemie,1960,72(23):911-915.
[11] Christoph Wegner, Jochim Paust, Hansgeorg Ernst. Prepartion of 1,1,4,4-tetramethoxy-2-butene[P].US 0 128 520,2002.
[12] Juergen Frank, Udo Rheude, Bernhard Schulz,etal. 2,5-Bis(1,1-dialkoxy-2-propyl)-2,5-dihydrofurans,the preparation thereof and the use thereof for the preparation of carotenoids[P].US 5 300 658,1994.
[13] Juergen Frank, Udo Rheude, Bernhard Schulz,etal. 2,5-Bis(1,1-dialkoxy-2-propyl)-2,5-dihydrofurans,the preparation thereof and the use thereof for the preparation of carotenoids[P].US 5 382 732,1995.
[14] Daniel Frederico, Paulo Marcos Donate. A short and efficient synthesis of crocetin-dimethylester and crocetindial[J].The Journal of Organic Chemistry,2003,68:9126-9128.
[15] Robert Curley, Hector DeLuca. Ethyl 13,14-dihydro-13,14-methyleneretinoates analogues of all-transand 13-cis-retinoic acid[J].The Journal of Organic Chemistry,1984,49:1941-1944.
