具有平面手性和中心手性的二茂铁基亚砜膦配体的合成及其催化活性
2012-11-21李高伟王敏灿孔培培赵文献
李高伟, 唐 贝, 王敏灿, 孔培培, 赵文献
(1. 商丘师范学院 化学系 有机新材料合成重点实验室,河南 商丘 476000; 2. 河南省医药学校,河南 开封 475000; 3. 郑州大学 化学系 河南省化学生物与有机化学重点实验室,河南 郑州 450052)
在不对称催化研究中,手性配体的设计与合成一直是研究的热点之一,而合适的手性配体是不对称催化反应成功的关键。在众多结构各异的手性配体中,手性二茂铁配体具有其特殊而重要的地位[1]。通过硫醚化合物的不对称氧化是获得手性亚砜化合物的一种重要途径。由于手性亚砜本身具有体积大的硫原子,空间障碍小的孤对电子和极性较强的亚磺酰基,可以同多种金属络合形成手性络合物进行不对称诱导。
Fernández等[2]报道了具有二茂铁基的手性亚砜配体Ⅰ(Chart 1)在用量为3 eq时催化对苯腙的不对称烯丙基胺化反应取得了较好的对映选择性(82%ee); Carretero等[3]合成了一类新型的氨基取代二茂铁叔丁基亚砜Ⅱ(Chart 1),在其催化的二乙基锌对芳香醛的加成反应中催化效果表现较好(26%ee~96%ee); Enders小组[4]合成了具有平面手性和中心手性的二茂铁硫醚膦配体Ⅲ(Chart 1),将其应用于烯丙基取代反应的模板反应中,取得了97%的ee值。最近,Liao小组[5~7]发展了系列烷氧基取代的苯环骨架的手性膦亚砜配体Ⅳ(Chart 1),在其催化的二乙基锌对亚胺不对称加成反应,Pd-Ⅳ催化的不对称烯丙基取代反应和Rh-Ⅳ催化的芳基硼酸对烯酮的1,4-加成反应中都取得了很好的ee值。

Chart1

Scheme1

Scheme2
本课题组[8~10]近年来在手性二茂铁膦配体和硫醚配体的不对称催化应用方面也取得了一些进展,开发了脯氨酸衍生的二茂铁基胺膦配体,在铜络合物存在下,二乙基锌对N-磺酰基芳醛亚胺的加成取得了79%ee~86%ee。首次研究了手性二茂铁基氮膦配体的铜络合物对N-二苯基磷酰芳醛亚胺的不对称加成,产物手性胺的ee值最高达到90%。开发的手性二茂铁氮杂环丙烷硫醚配体在Pd-催化的烯丙基取代反应中取得高达91%ee。最近,Zhao等[7]报道了一种含硫的二茂铁基氨基醇手性配体的合成,该手性配体在不对称催化反应中的应用正在进一步考察之中。
本文在文献[5~7,10]的基础[10]上,借助二茂铁侧链上含有手性中心的杂原子(手性亚砜中的氧原子)的邻位导向作用,在高活性锂试剂丁基锂的作用下,二茂铁的邻位被高度立体专一性的锂化,然后在亲电试剂二苯基氯化膦的作用下合成了手性二茂铁亚砜膦配体3(Scheme 1),其结构经1H NMR,13C NMR, IR, MS和元素分析表征。以1,3-二苯基-2-丙烯基乙酸酯与丙二酸二甲酯/氢化钠的模板反应为例,初步研究了络合物Pd-3在烯丙基取代反应中的催化活性(Scheme 2),收率92%, 20%ee。
1 实验部分
1.1 仪器与试剂
YRT-3型熔点仪(温度计未经校正);Perkin Elmer 341型旋光仪(20 ℃, CHCl3为溶剂);Bruker DPX-400型超导核磁共振仪(CDCl3为溶剂,TMS为内标);Thermo Nicolet IR 200型红外光谱仪(KBr压片);Bruker Esquire 3000型质谱仪;Carlo Erba 1160型元素分析仪;高效液相色谱仪[HPLC, JASCO PU-1580智能型HPLC泵,JASCO UV-1575智能型紫外-可见检测仪(254 nm),手性柱Chiralcel OD Column(250 nm×4.6 mm, Daicel Chemical Ind., LTD, Japan];柱层析和薄层色谱用硅胶GF254,青岛海洋化工厂。
THF经金属钠(二苯甲酮)无水处理后压入钠丝保存;二氯甲烷经五氧化二磷无水处理后加入4 Å分子筛密封保存;其余所用试剂均为分析纯。
1.2 合成
(1) 二茂铁基叔丁基硫醚(1)的合成[12]
在反应瓶中加入二茂铁2.8 g(15 mmol)的THF(15 mL)溶液,于室温搅拌30 min。冰水浴冷却至0 ℃,慢慢滴加叔丁基锂10 mL(14.8 mmol, 1.5 mol·L-1in pentane),滴毕,反应2 h得二茂铁锂。升至室温,加入过硫化二叔丁基3.5 mL(18 mmol),反应2 h(TLC跟踪)。用2 mol·L-1氢氧化钠溶液12 mL终止反应,用乙醚(3×30 mL)萃取,合并有机相,用饱和食盐水(2×30 mL)洗至中性,无水硫酸钠干燥,浓缩后经TLC[展开剂:A=V(正己烷) ∶V(乙酸乙酯)=125 ∶1]纯化得红色固体1 1.85 g,产率45%, m.p.62.6 ℃~63.8 ℃(61 ℃~62 ℃[13]);1H NMRδ: 1.20(s, 9H, CH3in Bu), 4.19~4.30(m, 9H, FcH); IRν: 3 415, 3 129, 1 721, 1 400, 1 170, 812, 496 cm-1; ESI-MSm/z: 185.2(Fc+), 274.3(M+)。
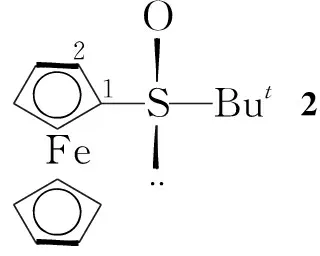
(2) 手性二茂铁基叔丁基亚砜(2)的合成[14,15]

(3) 3合成[15,18]

1.3 Pd-3的催化活性
氮气保护下将[Pd(η3-C3H5)Cl]23.7 mg(0.01 mmol)和3 4.9 mg(0.01 mmol)溶于THF(2 mL)中,络合反应30 min得络合物Pd-3。加入1,3-二苯基-2-丙烯基乙酸酯126 mg(0.5 mmol),反应10 min;加入新配制的NaCH(CO2Me)2-THF溶液[NaH(36 mg, 1.5 mmol)+丙二酸二甲酯(198 mg, 1.5 mmol)+THF(3 mL)],反应至终点(TLC跟踪)。加入饱和氯化铵水溶液,用乙醚(3×10 mL)萃取,合并有机层,用无水硫酸钠干燥, 减压浓缩后经硅胶柱层析[洗脱剂:V(石油醚) ∶V(乙酸乙酯)=10 ∶1]纯化得无色液体4,产率92%, 20%ee;1H NMRδ: 3.52(s, 3H, CO2CH3), 3.70(s, 3H, CO2CH3), 3.95(d,J=10.8 Hz, 1H, 1-H), 4.27(dd,J=8.8 Hz, 10.8 Hz, 1H, 2-H), 6.30(dd,J=8.8 Hz, 15.8 Hz, 1H, 3-H), 6.44(d,J=15.8 Hz, 1H, 4-H), 7.19~7.34(m, ArH, 10H)。
2 结果与讨论
2.1 1的合成
经Kagan试剂的不对称氧化合成1,其反应试剂要求(R,R)-DET/Ti(O-iPr)4都要经过减压蒸馏精制,尤其是(R,R)-DET,必须是光学纯品,CHP用4 Å分子筛储藏过夜。在室温下以无水二氯甲烷为溶剂,依次加入Ti(O-iPr)4, (R,R)-DET, H2O和CHP(1 ∶2 ∶1 ∶1),关键是在加入(R,R)-DET后才能再加入水,否则改变加入次序将产生沉淀物(TiO2),进而影响1的合成。
2.2 3的应用
用烯丙基取代反应考察了Pd-3的催化活性,结果表明,Pd-3的催化效果不佳(20%ee)。
[1] Arrayás R G, Adrio J, Carretero J C. Recent applicationsof chiral ferrocene ligands in asymmetric catalysis[J].Angew Chem Int Ed,2006,45:7674-7715.
[2] Fernández I, Valdivia V, Gori B,etal. The isopropylsulfinyl group:A useful chiral controller for the asymmetric aziridination of sulfinylimines and the organocatalytic allylation of hydrazones[J].Org Lett,2005,7:1307-1310.
[3] Priego J, Mancheńo O G, Cabrera S,etal. Aminosubstituted tert-butylsulfinylferrocenes as a new family of chiral ligands: asymmetric addition of diethylzinc to aldehydes[J].Chem Commun,2001:2026-2027.
[4] Enders D, Peters R, Lochtman R,etal. Asymmetric synthesis of novel ferrocenyl ligands with planar and central chirality and their application to Pd-catalyzed allylic substitutions[J].Eur J Org Chem,2000,20:3399-3426.
[5] Chen J M, Li D, Ma H F,etal. Catalytic asymmetric diethylzinc addition to diphenylphosphionyl imines using chiraltert-butanesulfinylphosphine ligands[J].Tetrahedron Lett,2008,49:6921-6923.
[6] Chen J M, Lang F, Li D,etal. Palladium-catalyzed asymmetric allylic nucleophilic substitution reactions using chiraltert-butanesulfinyl-phosphine ligands[J].Tetrahedron:Asymmetry,2009,20:1953-1956.
[7] Lang F, Li D, Chen J M,etal. tert-Butanesulfinylphosphines: simple chiral ligands in rhodium-catalyzed asymmetric addition of arylboronic acids to electron-deficient olefins[J].Adv Synth Catal,2010,(352):843-846.
[8] Wang M C, Xu C L, Zou Y X,etal. New chiral ferrocenyl amidophosphine ligand for remarkable improvement of enantioselectivities in copper-catalyzed addition of diethylzinc toN-sulfonylimines[J].Tetrahedron Lett,2005,46:5413-5416.
[9] Wang M C, Liu L T, Hua Y Z,etal. Novel chiral copper complexes of N,P-ferrocenylligands with central and planar chirality as effecient catalyst for asymmetric addition of diethylzinc to imines[J].Tetrahedron:Asymmetry,2005,16:2531-2534.
[10] Niu J L, Wang M C, Kong P P,etal. Origin of enantioselectivity with heterobidentates sufide-tertiary amine(sp3) ligands in palladium-catalyzed allylic substitution[J].Tetrahedron,2009,65:8869-8878.
[11] 赵文献,郑昕,李高伟,等. 一种新的含硫手性β-氨基醇配体的合成与表征[J].有机化学,2010,30:760-763.
[12] Rebiere F, Samuel O, Kagan, H B. A convenient method for the preparation of monolithioferrocene[J].Tetrahedron Lett,1990,31:3121-3124.
[13] Diter P, Samuel O, Taudien S,etal. Highly enantioselective oxidation of ferrocenyl sulfides[J].Tetrahedron: Asymmetry,1994,5:549-552.
[14] Rebiere F, Riant O, Ricard L,etal. Asymmetric synthesis and highly diastereoselective ortho-lithiation of ferrocenyl sulfoxides:Application to the synthesis of ferrocenyl derivatives with planar chirality[J].Angew Chem Int Ed Engl,1993,32:568-570.
[15] Minière S, Reboul V, Arrayás R G,etal. First epoxidation reaction of carbonyl compounds via ferrocenyl sulfur ylides[J].Synthesis,2003:2249-2254.
[16] Pichon C, Odell B, Brown J M. A direct meta-lithiation route to 1,3-disubstituted ferrocenes[J].Chem Commun,2004:598-599.
[17] Sato M, Sekino M. Synthesis and some properties of Pd(BF4)2and Pt(BF4)2complexes of 1,1′-bis[(alkyl- or phenyl-)chalcogeno]ferrocenes[J].J Organomet Chem,1989,(371):327-331.
[18] Lagneau N M, Chen Y, Robben P M,etal. Chiral sulfur-containing 1,2-disubstituted ferrocenes[J].Tetrahedron,1998,54:7301-7334.
