(+)-(1S,7aS)-1-羟基-7a-甲基-茚满-4-烯-5-酮的合成及其烷基化反应研究
2012-11-21孟程红张首国温晓雪颜海燕
孟程红, 王 林, 彭 涛, 张首国, 温晓雪, 刘 靖, 颜海燕
(1. 北京工业大学 生命科学与生物工程学院,北京 100124; 2. 军事医学科学院 放射与辐射医学研究所,北京 100850)
以甾体的CD环片段为原料,经烷基化反应全合成甾体母核是一条重要的甾体原料药合成路线[1]。良好的烷化反应条件是简单、有效地合成甾体中间体的前提。研究表明,在以光学活性的(+)-(1S,7aS)-1-羟基-7a-甲基-茚满-4-烯-5-酮(3)为起始原料的甾体合成路线中,绝大部分先用叔丁基将其五元环上的羟基进行保护[2,4,6],或者用其他方法对羟基进行保护,比如乙烯基乙醚[3],然后再用各种方法进行甾体的全合成。
本文参照文献方法,2-甲基-2-(3-丁酮)环戊烷-1,3-二酮(1)在L-脯氨酸诱导下,经酸催化环合[5]制得(S)-7a-甲基-茚满-4-烯-1,5-二酮(2); 低温下,用NaBH4选择性还原2的五元环上的羰基成β-羟基合成了3(Scheme 1)。 由于叔丁基保护3的羟基涉及异丁基的制备以及保护和脱保护步骤,操作繁琐。本文在未对3的进行羟基保护的情况下,改用NaH在DMSO中直接与卤代烃(4a~4e)的侧键进行烷基化反应制得5个3的衍生物(5a~5e, Scheme 1)。其中5a和5b是制备雌烯二酮的关键中间体,5d和5e制备雌酚酮的关键中间体。

Scheme1
1 实验部分
1.1 仪器与试剂
PolAAr 3005型自动旋光仪;JNM-ECA-400型超导核磁共振仪(DMSO-d6为溶剂,TMS为内标)。
柱层析硅胶和GF254硅胶,200目~300目,青岛海洋化工厂;其余所用试剂均为分析纯。
1.2 合成
(1) 2的合成

(2) 3的合成
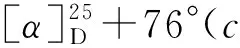
(3) 5的合成(以5a为例)
在反应瓶中加入NaH(含固量60%)90 mg(2.25 mmol)和干燥DMSO 20 mL,搅拌5 min~10 min形成混悬溶液;加入3 330 mg(1.98 mmol),搅拌1 min~2 min至溶液呈灰绿色后,加入现制的4-碘-2-丁酮(4a)590 mg(2.98 mmol),于室温反应4 h。倒入80 mL饱和氯化钠溶液中,用乙酸乙酯(4×20 mL)萃取,合并萃取液,依次用饱和碳酸氢钠溶液和水洗涤,无水硫酸钠干燥,减压蒸除溶剂得红棕色油状物0.45 g,经硅胶柱层析(梯度洗脱剂:A=5 ∶1~2 ∶1)纯化得5a。
用类似的方法合成5b~5e.合成5的实验条件和结果见表1,1H NMR数据见表2。
2 结果与讨论
α,β-不饱和酮的α-氢在碱的作用下失去质子形成烯醇负离子,与卤代烃发生亲核取代反应得到烃基化酮。但是在相同的碱性条件,不同卤代烃的烷基化结果大不相同。从表1可见,4c和4d反应较快(1 h);5b和5c收率较高;在强碱条件下,4d绝大部分被强碱破坏,4a反应不完全,且有两个副产物,4b和4c反应较完全,且产物较单一,4e没有副产物生成,但反应较难完全。
综上所述,吸电子基的存在可能使侧链活性比较强,副产物较多,导致收率较低;而供电子基存在,但产物较单一。
有文献报道[7]3环上的羰基用叔丁基保护后与4b在同样碱性条件和溶剂作用下,得到5b,产率略高于本文合成的5b,但产物不易分离,且涉及羟基的保护和脱保护。相比之下,本文报道的不保护羟基的直接烷基化法仍有较明显的优势,不涉及羟基的保护和脱保护,且易于分离。另有美国专利[3]报道,3用绝对干燥乙烯基乙醚保护后,在干燥DME中,氮气保护下,冰浴反应16 h即得到5d,产率较高,但因仍需制备绝对干燥的乙烯基乙醚来保护3,操作复杂。
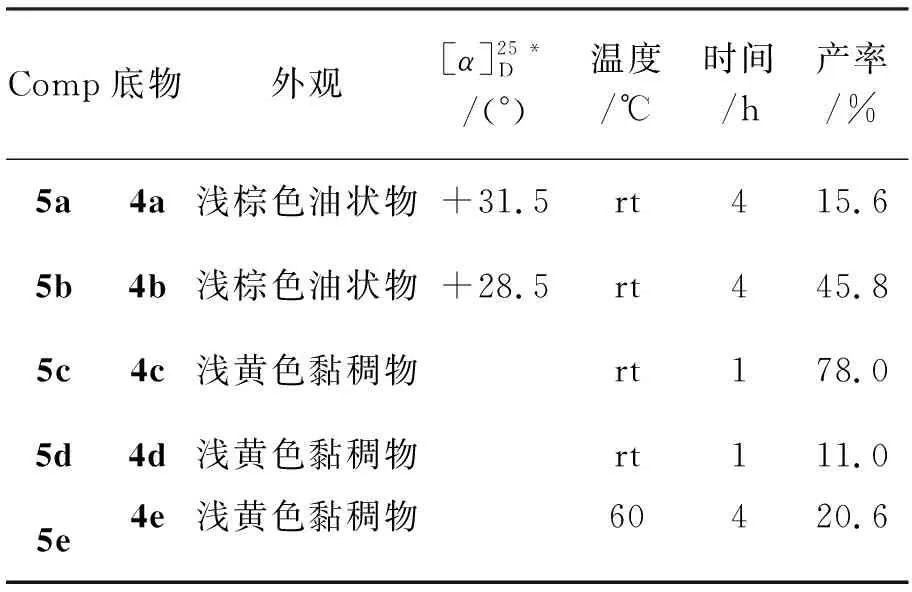
表1 合成5的实验条件和结果Table 1 Experimental conditions and results of synthesizing 5
*CHCl3为溶剂

表2 5的1H NMR数据Table 2 1H NMR data of 5
[1] 周维善, 庄治平. 甾体化学进展[M].北京:科学出版社,2002.
[2] Cai Zu-Yun, Ni Yuan, Sun Jen-Kon,etal. Total synthesis of optically active 17-t-butoxy-3-methoxy-7α- or 7β-18-dimethyl-1,3,5(10)-estratriene[J].J Chem Soc, Chem Commun, I985:1277-1278.
[3] Ethel G Love. 9,10-Secoestrane derivatives and their production[P].US 4 012 420 A,1977.
[4] Masataka Ihara, Izumi Sudow, Keiichiro Fukumoto. Chiral synthesis of androsterone through intramolecular Diels-Alder reaction[J].J Org Chem,1985,50:144-145.
[5] Hideaki Hioki, Takefumi Hashimoto, Mitsuaki Kodama. Efficient kinetic resolution of (±)-4-methyl-hajos-parrish ketone by baker’s yeast reduction[J].Tetrahedron:Asymmetry,2000,11:829-834.
[6] Masataka Ihara, Izumi Sudow, Keiichiro Fukumoto. Stereoselective total synthesis of testosterone and androsterone via A/B-ring construction of the steroidal ring system by intramolecular Diels-Alder reaction[J].J Chem Soc, Perkin Trans I,1986:117-123.
[7] Gijsbert Zomer, Hans Wynberg. [I,2,3,4-13C]Testosterone and [I,2,3,4-13C] estradiol steroids[J].1984,44:283-292.
