Lipozyme TL IM催化合成Temsirolimus
2012-11-21万振江卢晓霞
万振江, 卢晓霞
(中国科学院 成都生物研究所 天然产物研究中心,四川 成都 610041)
西罗莫司(3)又名雷帕霉素,是加拿大Wyeth Ayerst研究所于20世纪70年代初从放线菌吸水链霉菌培养液中分离出来的31元大环内酯类抗生素。研究初期表明3只具有弱的抗菌作用。近年研究表明,3在预防同种异体肾移植术后排斥反应、各种支架管置入导致的血管再狭窄及抗肿瘤等方面具有重要作用[1~3]。
Temsirolimus(5, Chart 1)是3的42-位丙酸酯类衍生物,为哺乳动物雷帕霉素靶蛋白抑制剂类药物,是此类药物中首个申请用于治疗癌症的产品。与α-干扰素疗法相比,5可将癌症的中位生存期延长3~6个月,因此该药物具有极高的市场价值。

Chart 1

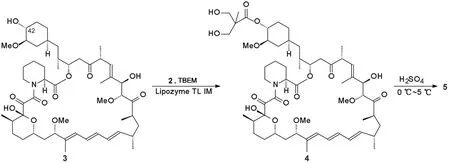
Scheme 1
由于3分子结构中有两个二级醇羟基,对42-位醇羟基进行酯化反应时,往往得到3的42-位和31-位碳类衍生物。5的化学合成[4]方法一般都采用三甲基硅基对3的42-位和31-位醇羟基进行保护,然后选择性在42-位脱保护,生成42-位为游离羟基的中间体,再与酯化剂反应后去保护得到5。该方法反应复杂,需要经过保护脱保护等过程,步骤较多,并且产率较低。
脂肪酶全称为甘油三酰酯水解酶,广泛存在于动植物和微生物中,能够催化化合物的水解、醇解、酯化和酯交换等,具有较高的催化活性和稳定性,易于生产,也有较好的专一性[5~7]。2005年,Gu等[8]利用Lipase PS-C“Amano”Ⅱ成功地催化合成了5。 Lipase PS-C “Amano”Ⅱ催化速率较快,产率较高,但价格昂贵。此外该反应所用酯化剂为烯基酯,合成时需要贵重金属Pd试剂进行催化,反应条件严格,成本较高。
本文在文献[8]方法的基础,通过对几种脂肪酶(猪胰蛋白酶,胃蛋白酶,Novozyme 435, Lipozyme TL IM和PS IM Amano)的筛选,发现商品脂肪酶Lipozyme TL IM为催化剂,2,2,5-三甲基-1,3-二氧六环-5-羧酸酐(2)为酯化剂,对3进行酯化反应时,能够高度区域选择性得到3的42-位丙酸酯类衍生物4(产率90%); 4水解后得到5(Scheme 1),总产率83.7%,远远高于传统的化学合成方法。
该方法反应专一性强,条件温和,副产物少,非常经济且利于生产规模的扩大,为Temsirolimus的合成提供了一种方便而有效的方法。
1 实验部分
1.1 仪器与试剂
Advance Bruker 600 MHz/300 MHz型核磁共振仪(DMSO为溶剂,TMS为内标);Polaris Q型质谱仪。
柱层析用硅胶300目~400目和HSGF254 高效薄层层析硅胶板,青岛海洋化工厂生产;脂肪酶Lipozyme TL IM,丹麦诺维信酶制剂公司;其余所用试剂均为分析纯。
1.2 合成
(1) 2,2,5-三甲基-1,3-二氧六环-5-羧酸酐(2)的合成
在反应瓶中依次加入2,2-二羟甲基丙酸10.0 g(74.55 mmol), 2,2-二甲氧基丙烷13.8 mL(111.83 mmol),对甲苯磺酸(TsOH)0.71 g(3.73 mmol)和丙酮50 mL,搅拌下于室温反应2 h(TLC监测)。用混合溶剂[V(NH3) ∶V(EtOH)=1 ∶1]1.0 mL中和剩余的TsOH,减压蒸除溶剂,残余物用二氯甲烷250 mL溶解后用水(40 mL)洗涤,无水MgSO4干燥,减压蒸除溶剂得白色固体2,2,5-三甲基-5-羧酸(1)11.7 g,收率90%, m.p.120 ℃;1H NMRδ: 3.99(d,J=11.5 Hz, 2H, CH2), 3.54(d,J=11.5 Hz, 2H, CH2), 1.33, 1.25(s, 6H, CH3), 1.06(s, 3H, CH3)。
将1 5.0 g(28.7 mmol)用二氯甲烷(20 mL)溶解,搅拌下加入二环己基碳二亚胺(DCC)2.96 g(14.4 mmol)的二氯甲烷(10 mL)溶液,产生白色固体,于室温反应4 h。过滤,滤液减压蒸馏,粗品用少量乙酸乙酯溶解;过滤,滤液减压蒸除溶剂得无色液体34.75 g,收率81%;1H NMR(CDCl3)δ: 1.21(s, 6H, CH3), 1.36(s, 6H, CH3), 1.41(s, 6H, CH3), 3.66(d,J=12.0 Hz, 4H, CH2O), 4.18(d,J=12.0 Hz, 4H, CH2O);13C NMR(CDCl3)δ: 17.83, 21.75, 25.72, 43.83, 65.85, 98.56, 169.68。
(2) 4的合成
在反应瓶中加入3 1.0 g(1.1 mmol), 2 0.34 g(1.1 mmol)和无水叔丁基甲基醚(TBME)20 mL,搅拌下于室温加入Lipozyme TL IM 1 g,缓慢搅拌反应12 h(TLC监测)。过滤,滤液减压除溶得淡黄色固体4,产率40%;1H NMRδ: 4.5(m, 1H, 42-H), 4.0(m, 4H), 3.6(m, 2H), 1.34(s, 3H), 1.24(s, 3H), 1.06(s, 3H)。
(3) 5的合成
在反应瓶中加入4 0.5 g(0.47 mmol)和THF 5 mL,搅拌使其溶解;于0 ℃~5 ℃缓慢滴加2 mol·L-1硫酸2.5 mL,滴毕,于室温反应48 h(TLC监测)。用乙酸乙酯(3×15 mL)萃取,合并萃取液,用无水MgSO4干燥,减压蒸除溶剂,粗品用少量二氯甲烷溶解后经硅胶柱层析[洗脱剂:V(正己烷) ∶V(丙酮)=2 ∶1]分离得白色固体5 0.45 g,收率93%;1H NMRδ: 4.5(m, 1H, 42-H), 3.4(s, 4H), 1.04(s, 3H); HR-ESI-MSm/z: Calcd for C56H87NO16Na{[M+Na]+} 1 052.591 7, found 1 052.588 6。
2 结果与讨论
脂肪酶的种类很多,催化性能也各不相同。以TBME为溶剂,在室温条件下,考察了五种脂肪酶催化3与2的酯化反应,结果见表1。从表1可见,Lipozyme TL IM的催化效果最好,产率达40%。与Lipase PS-C “Amano”Ⅱ相比, Lipozyme TL IM价格便宜,且易得。该方法更加简单容易,并且反应产物不需要进行柱层析纯化,经过简单的过滤就可直接进行下一步反应。且酯化剂2的合成简单方便,只需用DCC进行缩合就能得到。
以Lipozyme TL IM为催化剂,对酯化反应条件进行了筛选,结果见表2。由表2可见,最佳酯化反应条件为: 3 1 g(1.1 mmol), TBME 20 mL, Lipozyme TL IM用量为3质量分数的100%(1 g),n(3) ∶n(2)=1 ∶4,于40 ℃反应48 h, 4的产率达90%。
表1 脂肪酶对3酯化反应的影响*
Table1Effect of lipase on esterification of3
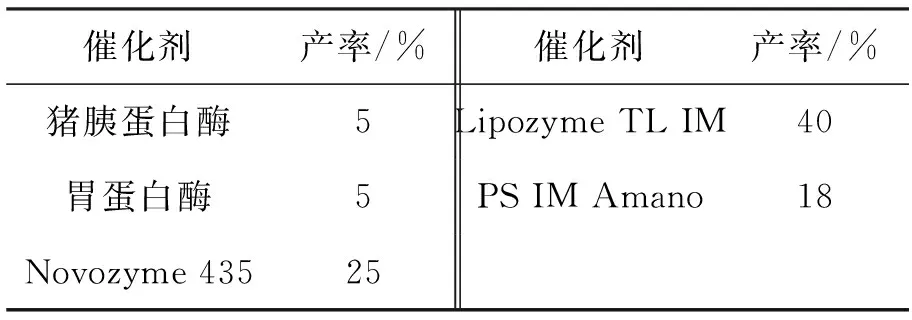
催化剂产率/%催化剂产率/%猪胰蛋白酶5Lipozyme TL IM40胃蛋白酶5PS IM Amano18Novozyme 43525
*3 1.0 g,催化剂1.0 g, TBME 20 mL, 2 1.0 eq, 于20 ℃反应12 h
表2 酯化反应条件筛选*
Table2 Selection of esterification reaction conditions
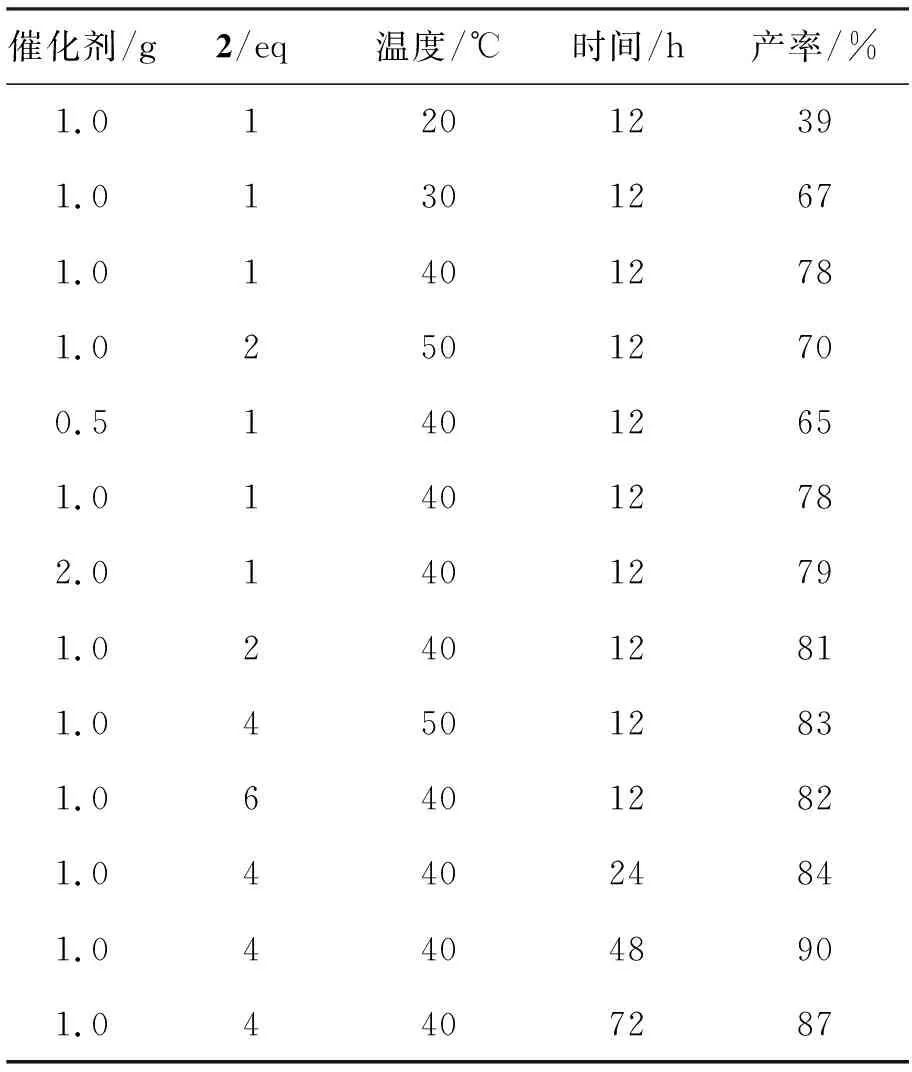
催化剂/g2/eq温度/℃时间/h产率/%1.012012391.013012671.014012781.025012700.514012651.014012782.014012791.024012811.045012831.064012821.044024841.044048901.04407287
*3 1 g, TBME 20 mL,其余反应条件同1.2(2)
[1] Vignot S, Faivre S, Aguirre D,etal. mTOR-targeted therapy of cancer with rapamycin derivatives[J].Ann Oncol,2005,16(4):525-537.
[2] Kerjaschki D. How to control lymphangio-genesis:A novel role for rapamycin[J].Kidney Int,2007,71(8):717-719.
[3] Petricoin E F, Espina V, Araujo R P,etal. Phosphoprotein pathway mapping:Akt/mammalian target of rapamycin activation is negatively associated with childhood rhab domyosarcoma survival[J].Cancer Res,2007,67(7):3431-3440.
[4] Jerauld S. Rapamycin hydroxyesters[P].US,5 362 718,1994.
[5] 段煜,杜宗良,李瑞霞,等. 天然多羟基化合物在酶催化下的选择性酯化[J].天然产物研究与开发,2006,(18):702-708.
[6] 熊小龙,杜鹏飞,金鹏,等. 脂肪酶催化药物合成的研究进展[J].化学与生物工程,2010,27(8): 1-7.
[7] 张中义,吴新侠. 脂肪酶在手性药物制备中的应用[J].食品与药品,2007,9(07):40-43.
[8] Jianxin G, Mark E R, Ping C. Lipase-catalyzed regioselective esterification of rapamycin:Synthesis of Temsirolimus(CCI-779)[J].Org Lett,2005,7(18):3945-3948.
