新型含磺酰基α-氨基膦酸酯的合成
2012-11-21张改红程传玲
张改红, 程传玲
(郑州轻工业学院 食品与生物工程学院,河南 郑州 450002)
α-氨基膦酸及其酯作为天然氨基酸的类似物,其合成方法和生物活性受到众多科学家的关注[1]。研究表明,α-氨基膦酸及其酯具有抗植物病毒活性[2]、除草活性[3]、抗肿瘤活性[4]、植物生长调节活性[5]、抑制酶活性[6]及杀菌活性[7]等重要的生物活性。
由于α-氨基膦酸酯上与磷原子相连的二个烷氧基不同,α-位碳原子以及氨基上取代基的不同均会导致其生物活性的差异。磺酰基在抗肿瘤药物的结构中发挥着十分重要的作用,近年来开发出的抗肿瘤药物的结构中很多都含有磺酰基,如CQS[8~10], E7010[11], E7070[12]等。
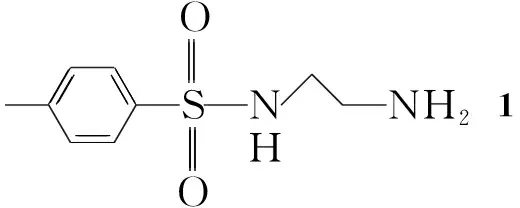
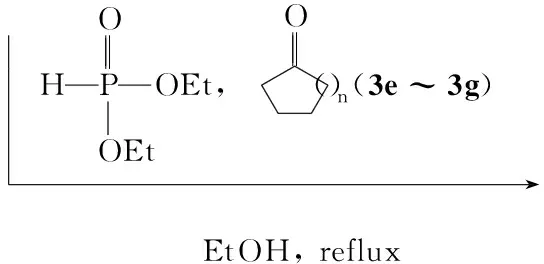
本文采用活性基团拼接法将磺酰基引入α-氨基膦酸酯中,设计并合成了7个新型含磺酰基的α-氨基膦酸酯(4a~4d,5e~5g)。以N-对甲苯磺酰基乙二胺(1),取代醛(2a~2d)[或芳酮(3e~3g)]及亚磷酸酯为原料,采用“一锅煮”合成了4a~4d[或5e~5g](Scheme 1),其结构经1H NMR,13C NMR,31P NMR和元素分析表征。
1 实验部分
1.1 仪器与试剂
X-4型显微熔点仪(温度未经校正);Varian AS400 MHz型核磁共振仪(CDCl3为溶剂,TMS为内标,85%H3PO4为31P NMR外标);EQUINOX55型红外光谱仪(KBr压片);Yanaco CHN Corder MT3型元素自动分析仪。
1按文献[13]方法制备;其余所用试剂均为分析纯,溶剂使用前经纯化处理。
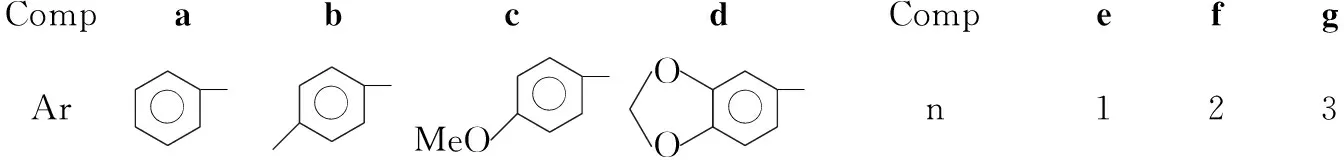
CompabcdCompefgAr - - MeO- -OOn123
Scheme1
1.2 4和5的合成(以4a为例)
在反应瓶中加入11.07 g(5 mmol),亚磷酸酯 0.69 g(5 mmol)和无水乙醇15 mL,搅拌下于室温滴加苯甲醛(2a) 0.53 g(5 mmol)的无水乙醇(10 mL)溶液(约30 min);回流反应8 h(TLC跟踪)。旋蒸除去溶剂后经硅胶柱层析[洗脱剂:V(乙酸乙酯) ∶V(石油醚)=2 ∶3]纯化得浅黄色黏稠物,用乙酸乙酯/石油醚重结晶得白色固体4a。用类似方法合成白分固体4b~4d,5e~5g。
2 结果与讨论
2.1 合成
由醛、胺和亚磷酸酯三组分合成α-氨基膦酸酯的方法一般有两种:一种是亚胺加成法,即先使醛和胺反应成亚胺,再和亚磷酸酯反应生成目标产物[14];另外一种方法是由醛、胺和亚磷酸酯三组分进行“一锅煮”反应直接得到目标产物。第二种方法大多要使用金属催化剂[15,16]。本文对文献方法进行改进,用乙醇作溶剂采用“一锅煮”直接合成目标化合物,无需金属催化剂。该方法操作更为简便。
4a~4d和5e~5g的实验结果,31P NMR和元素分析数据见表1;1H NMR和13C NMR数据见表2。由表1可见,芳香醛和环状脂肪酮均可与1反应,收率中等,其中环己酮(3f)与1的反应收率最高。
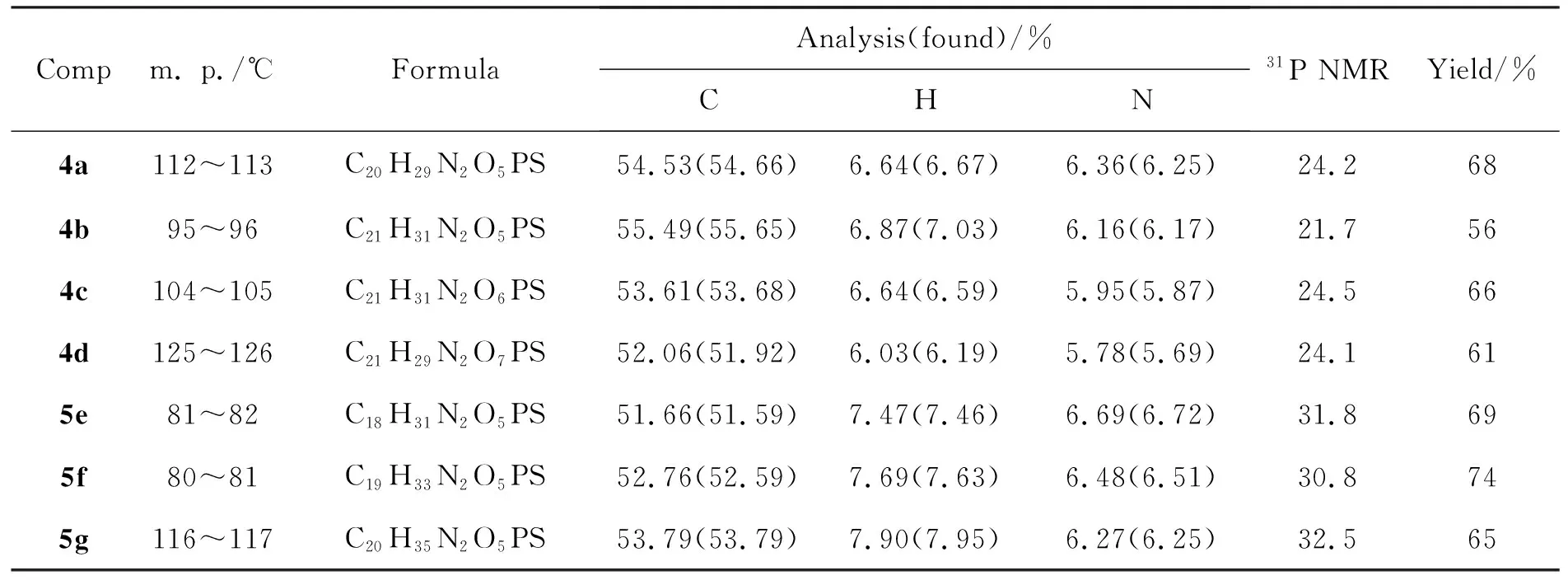
表 1 4a~4d和5e~5g的实验结果,31P NMR和元素分析数据Table 1 Experimental results, 31P NMR and analysis data of 4a~4d and 5e~5g

表 2 4a~4d和5e~5g的NMR数据Table 2 NMR data of 4a~4d and 5e~5g
本文还做了底物扩展实验,结果发现,脂肪醛如丙醛和丁醛代替芳香醛在相同条件下不易反应,产物非常复杂,收率很低。含有拉电子基的芳香醛如对氯苯甲醛,对硝基苯甲醛,不发生此反应。推测原因可能是此反应为一平衡反应,拉电子基虽然有利于第一步的亲核加成,但是却使后一步的脱水反应难以进行。
2.2 表征
(1)1H NMR
与膦酰化氨基酸一样,4a~4d中膦酸酯的两个酯基是核磁不等价的。从1H NMR谱图(略)可以看到两个甲基的吸收峰出现在1.09~1.31,均受亚甲基的影响裂分为三重峰。两个亚甲基的吸收峰受甲基和膦酰氧基的作用出现在3.67~4.10,均裂分为多重峰。这种现象可能是由于与磷原子相连的两个乙氧基分别处于苯环的屏蔽区和去屏蔽区。而在5e~5g中,Ce非苯环取代,而是环戊基、环己基、环庚基,其1H NMR谱图中未观察到核磁不等价现象。
4a~4d的e-H受到磷原子和氮原子的共同作用吸收峰出现在3.71~3.86,且裂分为两个双峰。5e~5g由于Ce上没有氢,故没有此特征峰。4a~4d中两个氮原子上的氢,一个出现在5.23~5.71,归属为a-H,另一个出现在1.95~2.17,归属为d-H。但它们并非总是同时出现,有时只出现一个。苯环上氢的吸收出现在6.69~7.72,符合取代苯环的一般规律。环烷基上氢的吸收出现在1.43~1.88,符合烷基氢的一般规律。
(2)31P NMR
从31P NMR谱图可以看到磷原子的吸收峰出现在21.7~32.5,且均为一单峰,没有裂分。Ce的取代基为芳基时磷的化学位移向高场移动,如4a~4d位于21.7~24.5。而Ce为环烷基时磷的化学位移向低场移动,如5e~5g位于30.8~32.5。这可能是4a~4d的磷原子受到了苯环屏蔽作用所致。
(3)13C NMR
13C NMR分析结果表明:(1)在4a~4d中,由于受磷的影响,Ce裂分为两重峰,且偶合常数相当大(JP-C>150 Hz)。乙氧基中的甲基和亚甲基碳分别裂分为两组双峰,偶合常数分别在5.5 Hz和7.0 Hz左右。本文判断它们的磁不等价现象主要是由于两个乙氧基分别处于苯环的屏蔽区和去屏蔽区引起的。Cc也裂分为两重峰,且偶合常数较大,在16.0 Hz~18.1Hz。取代芳环上的2-位碳也裂分为两重峰,偶合常数在6.1 Hz~7.6 Hz。(2) 在5e~5g中,Ce也裂分为两重峰,但JP-C<150 Hz,比芳基取代基的偶合常数小。乙氧基中的甲基和亚甲基碳分别裂分为一组双峰,没有磁不等价现象。环烷基中2-位碳裂分为两重峰,偶合常数在7.5 Hz左右。
综上分析表明,4a~5g的结构与Scheme 1预期吻合。
[1] 龙韫先,张克胜,邱德文.N-吡唑啉酮基-α-氨基膦酸酯的合成及其生物活性的研究[J].高等学校化学学报,1996,17( 8):1247-1249.
[2] 宋宝安,蒋木庚,吴扬兰,等.N-对三氟甲基苯基-α-氨基烷基膦酸酯的合成、晶体结构及生物活性[J].有机化学,2003,23( 9):967-972.
[3] 陈茹玉,戴庆. 类Mannich反应合成N-对甲苯磺酰基-α-氨基磷酸二乙酯[J].中国科学(B辑),1995,25( 6):591-595.
[4] 刘学军,陈茹玉,杨媛媛. 5-氟尿嘧啶-1-基磷三肽化合物的合成及抗癌活性研究[J].高等学校化学学报,2002,23(7):1299-1303.
[5] Allen J G, Atherton F R, Hall M J,etal. Phosphonopeptides,a new class of synthetic antibacterial agents[J].Nature,1978,272:56-58.
[6] TanaKa F, Kinoshita K, Tanimura R,etal. Relaxing substrate specificity in antibody-catalyzed reactions:Enantioselective hydrolysis ofN-Cbz-amino acid esters[J].J Am Chem Soc,1996,118(10):2332-2339.
[7] Bartlett P A, Kezer W B. Phosphinic acid dipeptide analogs:Potent,slow-binding inhibitors of aspartic peptidases[J].J Am Chem Soc,1984,106(15):4282-4283.
[8] Branda R F, Moore A L, McCormack J J,etal. Immunosuppressive properties of chloroquinoxaline sulfonamide[J].Biochem Pharmacol,1989,38:3521-3526.
[9] Branda R F, McCormack J J, Perlmutter C A. Cellular pharmacology of chloroquinoxaline sulfonamide and a related compound in murine B16 melanoma cells[J].Biochem Pharmacol,1988,37:4557-4564.
[10] Rigas J R, Francis P A, Miller V A,etal. Clinical and pharmacology study of chloroquinoxaline sulfonamide given on a weekly schedule[J].Cancer Chemother Pharmacol,1995,35:483-488.
[11] Yoshino H, Ueda N, Niijima J,etal. Novel sulfonamides as potential,systemically active antitumor agents[J].J Med Chem,1992,35(13):2496-2497.
[12] Owa T, Yoshino H, Okauchi T,etal. Discovery of novel antitumor sulfonamides targeting G1 phase of the cell cycle[J].J Med Chem,1999,42(19):3789-3799.
[13] Dijksman A, Elzinga J M, Li Y X,etal. Effcient ruthenium-catalyzed racemization of secondary alcohols:Application to dynamic kinetic resolution[J].Tetrahedron:Asymmetry,2002,13:879-884.
[14] Arsanious M H N, Issac Y A, Boulos L S. Reactions of phosphite esters and trisdialkylaminophosphines with 5-substituted 1,3,4-thiadiazol derivatives[J].Heteroat Chem,2001,12(7):594-601.
[15] Wu J, Sun W, Xia H G,etal. A facile and highly efficient route toα-amino phosphonates via three-component reactions catalyzed by Mg(ClO4)2or molecular iodine[J].Org Biomol Chem,2006,44:1663-1666.
[16] Ambica K S, Taneja S C, Hundal M S,etal. One-pot synthesis ofα-aminophosphonates catalyzed by antimony trichloride adsorbed on alumina[J].Tetrahedron Lett,2008,49:2208-2212.
