局灶性脑缺血小鼠皮层HSP60、HSP70表达的时序性变化
2012-11-21蒋淑君刁汇玲马中女滨州医学院生理学教研室山东烟台264003
蒋淑君 刁汇玲 马中女 (滨州医学院生理学教研室,山东 烟台 264003)
局灶性脑缺血小鼠皮层HSP60、HSP70表达的时序性变化
蒋淑君 刁汇玲 马中女 (滨州医学院生理学教研室,山东 烟台 264003)
目的 探讨热休克蛋白(HSP)60、HSP70在局灶性脑缺血小鼠脑缺血后不同时间点(1 h、2 h、3 h)皮层缺血核心区和半影区的蛋白表达变化。方法 健康雄性BALB/c小鼠,建立脑中动脉阻塞缺血模型(MCAO),利用蛋白印迹技术分析HSP60、HSP70蛋白表达量在脑缺血1、2、3 h的时序性变化。结果 与假手术组比较,MCAO小鼠脑皮层HSP60、HSP70的蛋白表达量明显升高(P<0.05),HSP60随缺血时间延长呈持续升高趋势,HSP70在缺血后1 h增加,2 h达高峰,3 h降低。结论 HSP60、HSP70是神经细胞损伤和耐受的敏感标志,局灶性脑缺血能引起HSP60、HSP70表达的时序性变化,为认识局灶性脑缺血损伤提供理论依据。
局灶性脑缺血;大脑中动脉阻塞模型;热休克蛋白60(HSP60);热休克蛋白70(HSP70);时序性变化
脑缺血可导致严重的迟发性神经元损伤,影响患者的愈后和功能的恢复。缺血缺氧后早期脑中蛋白质合成普遍降低,在某些神经元内出现多种基因的诱导表达。热休克蛋白(HSP)是一类在生物进化过程中极为保守的蛋白质,广泛存在于原核、真核细胞中,当机体受到各种有害刺激(如缺血、高渗、肿瘤发生等),胞内HSP合成增多〔1〕。HSP在缺血缺氧性脑损伤过程中的特殊改变,使其成为该方面的研究热点之一。其中HSP70、HSP60分布相当广泛,应激后生成最为显著,是主要的应激蛋白,本实验利用大脑中动脉阻塞(MCAO)小鼠局部脑缺血模型,观察局灶性脑缺血不同时间点HSP70、HSP60在小鼠皮层缺血核心区和半影区表达的时序性变化。
1 材料与方法
1.1 动物及MCAO模型的制备
健康BALB/c小鼠(雄性,18~22 g,8~10周龄,SPF级,滨州医学院实验动物中心)。首先随机分为假手术组、MCAO缺血模型组,MCAO缺血模型组又分为缺血1 h组、缺血2 h组和缺血3 h组。根据文献报道进行小鼠MCAO脑缺血模型制备〔2〕。腹腔注射戊巴比妥钠(0.06 g/kg)麻醉小鼠,显微镜下游离左侧颈总动脉、颈外动脉及颈内动脉,结扎颈总动脉的近心端和颈外动脉的远心端;将头端直径0.23 mm、主干直径0.18 mm的栓塞线,由颈外动脉插入至大脑中动脉(深度约12.0 mm),并固定线栓,造成局灶性脑缺血。假手术组只进行手术操作,不插入线栓。整个手术过程平均20 min完成,此间保持小鼠体温。
1.2 Nissl染色
脑组织切片经0.5%焦油紫工作液染色10~15 min,梯度酒精脱色,二甲苯透明,中性树胶封片,光学显微镜下观察。
1.3 蛋白样品的制备及Western印迹检测
参照文献〔3〕,抽提MCAO缺血模型组皮层缺血核心区(Ic)半影区(P)组织的胞溶(Cytosolic)、膜相关(Particulate)等蛋白组分。BCA法蛋白定量后,样品在-20℃保存备用。在进行Western印迹检测时,每组分别取25 μg蛋白样品进行蛋白电泳(10%SDS-PAGE,4℃、20~30 mA)和转膜(NC 膜,400 mA、3 h)。用 HSP60(1∶1 000,兔 源 性,Cell Signalling Technology),HSP70 抗 体(1∶1 000,鼠 源 性,Santa Cruz)的 一 抗 和 内 参 照 β-actin(1∶1 000,鼠源性单克隆抗体,Sigma aldrich公司)辣根过氧化物酶标记山羊抗兔二抗、山羊抗小鼠二抗(1∶1 000,Chemicon)和ECL反应底物(Chemicon公司)进行杂交。所得X线胶片结果用Gel Doc凝胶成像系统扫描分析。
1.4 统计学分析
2 结果
2.1 HPC对小鼠皮层神经元形态的影响
Nissl染色结果显示,缺血区对侧皮层神经细胞尼氏染色清晰均匀,胞体轮廓及尼氏体清晰可见,细胞形态完整。缺血核心区细胞层次紊乱,排列不规则,结构模糊,神经元肿胀,胞质淡染,体积增大,部分神经元胞体开始缩小,呈三角形,可见核固缩、核溶解,尼氏小体溶解、消失。半影区细胞胞体轮廓及尼氏体较清晰,细胞形态基本完整,有少量细胞肿胀及核固缩。见图1。
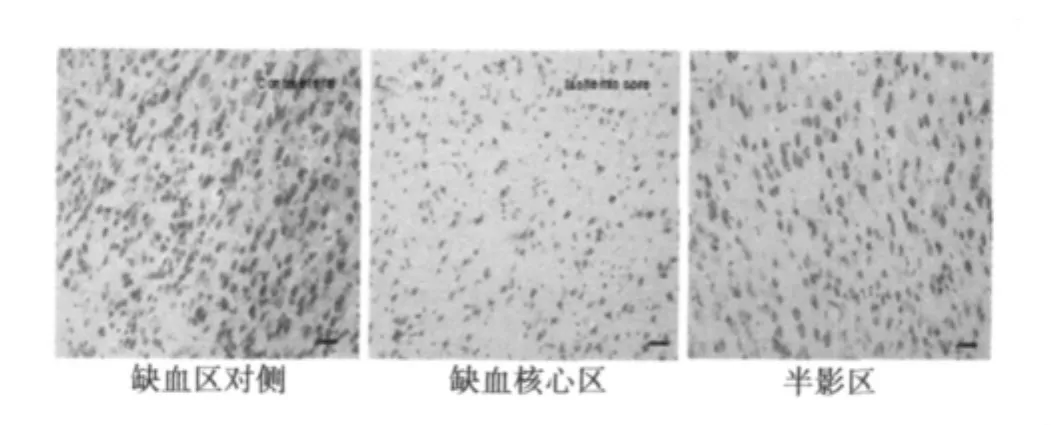
图1 Nissl染色示MCAO小鼠神经元形态(×200)
2.2 小鼠皮层膜相关成分中HSP60的表达
MCAO手术后随缺血时间延长小鼠皮层缺血核心区及半影区HSP60的蛋白表达明显增加,尤其半影区HSP60表达呈明显增加,缺血3 h半影区与假手术组比较表达量增加(6.5±0.29)倍。见图2。
2.3 小鼠皮层胞质成分中HSP70的表达
假手术组皮层组织HSP70的表达量很少,MCAO手术后小鼠皮层缺血核心区及半影区HSP70的蛋白表达在1 h即开始升高,2 h达高峰,3 h降低,但仍高于假手术组。见图3。
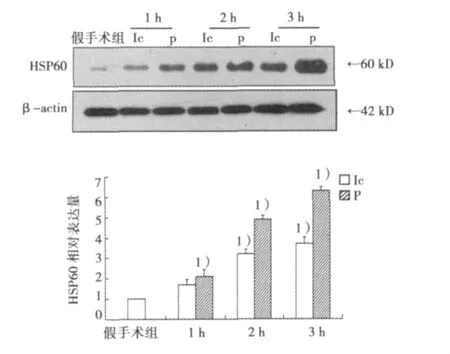
图2 脑缺血1、2、3 h小鼠皮层组织HSP60的蛋白表达
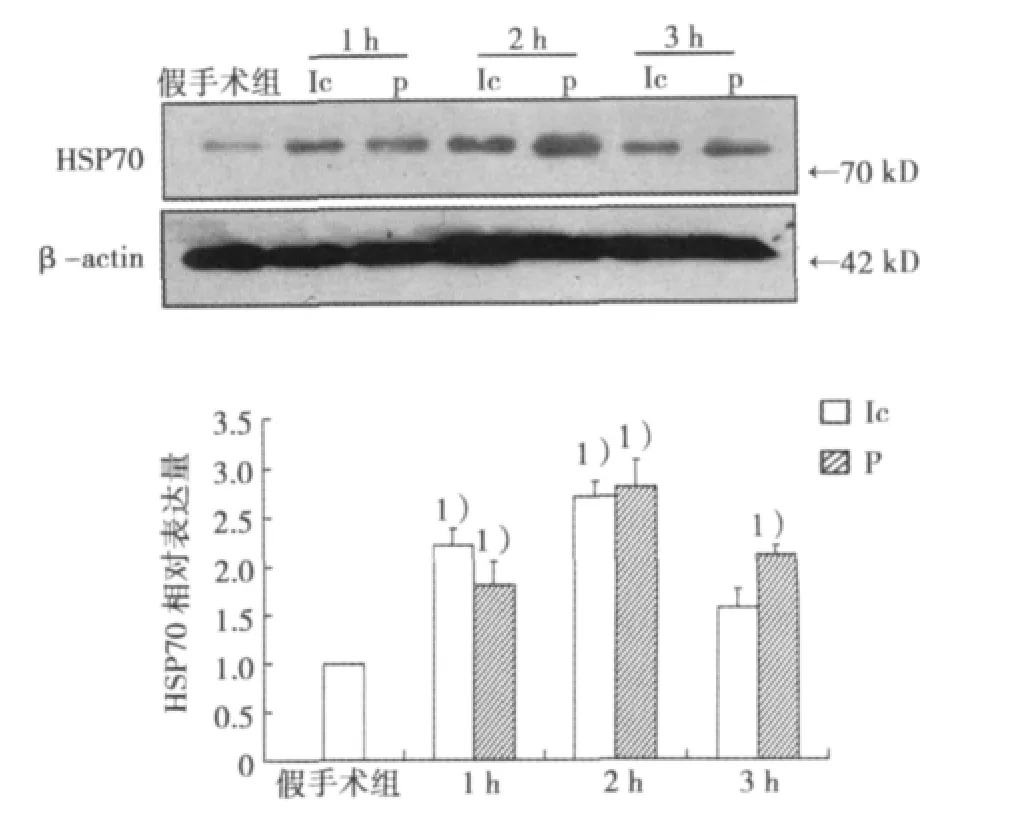
图3 脑缺血1、2、3 h小鼠皮层组织HSP70的蛋白表达
3 讨论
在局灶性脑缺血模型中,根据血供减少的程度可分为缺血核心区和半影区,轻中度缺血的半影区是脑保护的关键。近年大量研究表明,缺血性脑损伤引起的细胞死亡可能通过凋亡和坏死两条途径〔4〕。神经元的死亡在缺血灶中心区域以坏死为主,而在缺血半暗带以凋亡为主,缺血半暗带的保护是治疗脑缺血损伤的重点。HSP是一类在生物进化过程中极为保守的蛋白质,广泛存在于原核、真核细胞中,当机体受到各种有害刺激(如缺血、高渗、肿瘤发生等),胞内HSP合成增多〔1〕。许多应激原均可引起HSP的生成增加,诱生的HSP主要与应激时受损蛋白质的修复和移除有关,从而在蛋白质代谢水平对机体起保护、防御作用,增强机体对多种应激原的耐受能力。HSP70、HSP60分布相当广泛,是主要的应激蛋白,HSP60是反映线粒体应激和损伤程度的敏感指标,HSP70被视为细胞受到缺血损伤的敏感指标,又与缺血耐受有关。因而我们选择了HSP70、HSP60作为局灶性脑缺血损伤及耐受的观测指标。
HSP60主要存在于真核细胞的线粒体内,胞质内含量较少。正常状态下HSP60主要以稳定状态存在于线粒体基质中,在机体处于应激状态时可过表达或异位表达,因此,HSP60被认为是反映线粒体应激和损伤程度的指标〔5〕。本研究结果显示,在MCAO诱导的缺血模型中,缺血1 h小鼠皮层缺血核心区及半影区HSP60表达就开始增高,随着缺血时间延长,HSP60表达持续增加,尤其在缺血半影区HSP60表达水平明显升高,提示神经细胞在缺血/低氧状态下未折叠蛋白毒性堆积及线粒体应激导致神经损伤加重。
HSP70作为一种非特异性细胞内源性保护蛋白,可以防止应激引起的细胞损害并使受损细胞恢复,主要功能是发挥分子伴侣作用与新生、未折叠、错折叠或聚集的蛋白质相结合,使某些蛋白质聚集物解离,加速正确的肽链折叠和重折叠,维持某些肽链的伸展状态以利其跨膜转位,在线粒体、内质网等不同的区域内发挥作用,同时还促进某些变性蛋白的降解和清除,重新激活某些酶的作用,以维护细胞的功能和生存〔6〕。近年研究表明,正常生理情况下,HSP70蛋白在脑内无表达或呈非常弱的表达。应激情况下,HSP70表达增加,显示具有保护脑细胞,增加脑对缺氧的耐受性,抵抗进一步致死损伤的作用〔7〕。我们的实验结果观察到各缺血组HSP70表达率总的趋势为1 h出现增高,2 h达高峰,至3 h呈逐渐下降趋势,显示缺血低氧刺激使受损细胞产生变性蛋白诱导HSP70的合成,同时也获得暂时的对随后致死性缺血性损伤的耐受,缺血2 h内受损脑组织的应激和抗损伤能力较强,但随着脑组织缺血低氧时间的延长,脑细胞受损的加重,能够产生HSP70的能力也大大下降。该作用可能与HSP70保护细胞线粒体免遭活性氧化产物的攻击、抑制促炎症因子如TNF-α、IL-1等诱导的呼吸爆发有关〔8〕。
综上所述,HSP60、HSP70在缺血低氧刺激时的皮层组织中呈高表达,并随缺血时间延长呈现不同的表达趋势。本研究观察了局灶性脑缺血时HSP60、HSP70的表达规律,对探讨局灶性脑缺血的分子机制有重要意义,而HSP60、HSP70表达能否作为脑缺血诊断治疗的靶标及在脑缺血/低氧损伤中如何发挥作用等有待更深入的研究。
1 Welch WJ.Mammalian stress response:cell physiology,structure/function of stress proteins,and implication for medicine and disease〔J〕.Immunogenetics,1994;39(1):93-100.
2 蒋淑君,张 楠,卜祥宁,等.P38MAPK磷酸化增高参与HPC降低MCAO所致小鼠缺血性脑损伤〔J〕.基础医学与临床,2009;29(7):691-6.
3 Wexler EJ,Peters EE,Gonzales A,et al.An objective procedure for ischemic area evaluation of the stroke intraluminal thread model in the mouse and ra〔tJ〕.J Neurosci Methods,2002;113(1):51-8.
4 Giffard RG,Xu L,Zhao H,et al.Chaperones,protein aggregation,and brain protection from hypoxic/ischemic injury〔J〕.J Exp Biol,2007;207(18):3213-20.
5 Yin W,Signore AP,Iwai M,et al.Rapidly increased neuronal mitochondrial biogenesis after hypoxic-ischemic brain injury〔J〕.Stroke,2008;39(11):3057-63.
6 Bao XQ,Liu GT.Bicyclol a novel antihepatitis drug with hepatic heat shock protein 27/70 inducing activity and cytoprotective effects in mice〔J〕.Cell Stress Chaperones,2008;13(3):348.
7 Weinstein PR,Hong S,Sharp FR.Molecular identification of the ischemic penumbra〔J〕.Stroke,2004;35(11):2666-70.
8 Sun XC,Xian XH,Li WB,et al.Activation of p38 MAPK participates in brain ischemic tolerance induced by limb ischemic preconditioning by upregulating HSP 70〔J〕.Exp Neurol,2010;224(2):347-55.
Sequential changes of HSP60 and HSP70 expressions in mice with focal cerebral ischemia
JIANG Shu-Jun,DIAO Hui-Ling,MA Zhong-Nü.
Department of Physiology,Binzhou Medical University,Yantai 264003,Shandong,China
Objective To investigate sequential changes of HSP60 and HSP70 expression at 1,2,3 h in the ischemic core and the penumbra of cortex in the mice with focal cerebral ischemia.Methods Focal cerebral ischemia was induced by middle cerebral artery occlusion in mice,healthy male BALB/c mice weighted 18~20 g were randomly divided into 4 groups:sham,ischemia 1 h,ischemia 2 h,ischemia 3 h groups.Western blot combined with Gel Doc imagine systems were applied to examine the changes in HSP60 and HSP70 protein expression levels in the cerebral of mice.Results Protein expression levels of HSP60 and HSP70 in the ischemic core and penumbra were increased significantly in response to the repetitive of ischemia time when compared with sham group(P<0.05,n=6 for each group).Protein expression level of HSP60 showed a continous increasing trend with the ischemia time,while that of HSP70 was increased at 1 hour point,reached climax at 2 hour point,but decreased at 3 hour point.Conclusions HSP60 and HSP70 are the sensitive markers for nerve injury,and focal cerebral ischemia can result in the sequential changes of HSP60 and HSP70 expression,which provides evidence for the recognition and protection of focal cerebral ischemia.
Focal cerebral ischemia;Middle cerebral artery occlusion(MCAO);Heat shock protein 60(HSP60);Heat shock protein 70(HSP70);Sequential change
R373
A
1005-9202(2012)23-5189-03;
10.3969/j.issn.1005-9202.2012.23.040
山东省卫生发展科技计划项目(No.2009HW006)
蒋淑君(1971-),女,在读博士,副教授,主要从事神经生理学研究。
〔2011-10-24收稿 2012-03-10修回〕
(编辑 曹梦园)
