甲磺酸普立地诺口腔崩解片的研制及质量评价Δ
2012-11-21田朋鑫罗永煌刘艳玲聂延君西南大学药学院重庆400715
田朋鑫,罗永煌,刘艳玲,聂延君(西南大学药学院,重庆 400715)
甲磺酸普立地诺口腔崩解片的研制及质量评价Δ
田朋鑫*,罗永煌#,刘艳玲,聂延君(西南大学药学院,重庆 400715)
目的:研制甲磺酸普立地诺口腔崩解片并评价其质量。方法:以片剂崩解时限和口感为指标,单因素试验筛选崩解剂和矫味剂;以交联聚维酮(PVPP)、微晶纤维素(MCC)、聚维酮K30(PVP K30)和矫味剂用量占片重百分含量为考察因素,崩解时限为考察指标设计L9(34)正交试验,评价及优化辅料处方并进行验证试验(含量、含量均匀度和累积溶出度等)。结果:崩解剂为4%PVPP且内外加比例为1∶1,矫味剂为阿司帕坦/甜菊素按6∶1的比例占处方量3%,MCC用量为15%,PVP K30用量为2%时,所制备的口腔崩解片表面光滑,口感良好,崩解时限为(21.85±2.3)s,4min累积溶出度达(98.01±0.83)%,含量和含量均匀度均在规定范围内。结论:该口腔崩解片的处方及工艺合理,质量指标均符合口腔崩解片的要求。
甲磺酸普立地诺;口腔崩解片;正交试验;研制;质量评价
口腔崩解片(Orally disintegrating tablets,ODT)是近年来国内外研究开发的一种新型固体速释制剂,该片剂在口腔内可快速崩解、分散或溶解于唾液中,患者不需要水或只需少量水即可将药物顺利吞下,具有吸收快、起效快、肝脏首关效应小、生物利用度高、对胃肠道刺激小、服用方便等优点,特别适合老人、儿童及吞咽困难的患者[1]。此外,口腔崩解片为野外工作饮水不便的地质工作者、军人以及地震灾区人群等特殊情况的用药也提供了方便。
甲磺酸普立地诺(Pridinol mesylate,PM)是一种具有骨骼肌松弛作用的中枢性抗胆碱药[2],适用于肌肉痉挛及伴有疼痛或收缩的运动障碍疾病,如腰背疼痛、颈肩腕症候群、肩关节炎、脊椎变形等[3]。此类病症发病突然,疼痛剧烈,而口腔崩解片溶出迅速,能够迅速达到治疗效果。研究[4]表明,PM对帕金森综合征伴有的肌肉运动障碍也有一定治疗作用,当帕金森患者症状较重时,自主咀嚼、吞咽极其困难,很难接受传统片剂,而口腔崩解片的应用,极大增加了此类患者服药的顺应性。
目前,PM仅收载于《日本药局方外医药品规格》(2002年版)[5],其制剂主要在日本、韩国、阿根廷等国家和台湾地区上市,口服剂型仅有普通片、包衣片和肠溶片,其规格均为每片4mg。2010年版的《中国药典》中尚未收载PM及其制剂,其口腔崩解片的研究在国内外亦未见文献报道。本课题组依照国外上市制剂的含量规格,先以单因素试验筛选辅料,再以正交试验优化处方,湿法制粒制备PM口腔崩解片,并对其体外崩解时限、溶出度、含量、含量均匀度等质量指标进行了初步评价,其部分技术研究已申请国家发明专利(CN101664393)[6]。
1 仪器与试药
1.1 仪器
CJY-300B型片剂脆碎度测试仪、YPD-200C型片剂硬度仪、RCZ-6B2型药物溶出仪(上海黄海药检仪器有限公司);ZP-19旋转式压片机(泰州市黎明制药机械有限公司);LC-20AD高效液相色谱(HPLC)仪(日本岛津公司)。
1.2 试药
PM对照品(美国Sigma公司,批号:P4419,纯度:99.99%);PM原料药(重庆北碚现代应用药物研究所合成,批号:090701,纯度:99.88%);微晶纤维素(MCC,安徽山河药用辅料有限公司);低取代-羟丙基纤维素(L-HPC,西安惠安纤维素化工有限公司);交联聚维酮(PVPP,美国国际特品公司);交联羧甲基纤维素钠(CCNa,德国瑞登梅尔父子公司);聚维酮K30(PVP K30,海南南杭药业有限公司);PM口腔崩解片(西南大学药学院,批号:100301、100302、100303,规格:每片100mg)。
2 方法与结果
2.1 体外崩解时限测定
参照2003年9月国家食品药品监督管理局(SFDA)药品审评中心在《口腔崩解片的剂型特点和质量控制会议纪要》中的测定方法[7],任取片剂6片,分别放入装有2mL、(37±0.5)℃蒸馏水的小烧杯中,即刻计时,静态条件下观察其崩解情况。以完全崩解、且能通过2号筛网为准,记录崩解时限,其崩解时限应小于1min。
2.2 处方筛选单因素试验
2.2.1 崩解剂及内外加比例的筛选。经预试后以15%MCC为基础崩解剂,再分别与3种常用的药用级崩解剂,即PVPP、L-HPC和CCNa配伍(用量均为处方量的5%),固定原料药及其他辅料比例,将片剂硬度控制在15~25N左右,以片剂体外崩解时限和外观变化作为考察指标,筛选最佳崩解剂。结果,以PVPP作崩解剂,体外崩解时限最短,且吸水膨胀快,分散完全,无残留片芯,详见表1。
表1 3种崩解剂筛选结果Tab 1Results of screening three disintegrant(s

表1 3种崩解剂筛选结果Tab 1Results of screening three disintegrant(s
崩解剂PVPP L-HPC CCNa崩解时限/s 20.8±5.6354.6±11.3247.0±13.87崩解现象片剂在水中能够快速溶胀,崩解速度最快,无片芯残留崩解速度差,且片剂吸水膨胀慢,分散不够完全,其中有1片出现片芯残留水分浸润速度稍慢,溶胀较差,但分散较完全,无片芯残留
在确定PVPP为崩解剂的前提下,进一步考察PVPP内、外加的最佳比例。试验将PVPP按3∶1、1∶1、1∶3内、外加3种方式进行,仍以片剂崩解时限和外观变化为考察指标。结果,当PVPP内、外加比例为1∶1时,片剂的体外崩解时限最短,且无残留片芯,详见表2。
表2 PVPP内、外加比例筛选结果(Tab 2 Results of screening the inside-outside proportion of PVPP(

表2 PVPP内、外加比例筛选结果(Tab 2 Results of screening the inside-outside proportion of PVPP(
PVPP内、外加比例3∶11∶11∶323.2±8.3119.4±6.5828.1±8.94片剂吸水膨胀慢,较慢崩解,但分散完全,无片芯残留片剂吸水膨胀快,能迅速分散,崩解速度最快,分散完全,无片芯残留片剂吸水膨胀迅速,但分散的小颗粒较难崩解,达到崩解要求,且有1片出现片芯残留崩解时限/s 崩解现象
2.2.2 矫味剂的筛选。经预试,以矫味剂量占处方量的4%为基础,设计阿司帕坦和甜菊素比例分别约为2∶1、4∶1、6∶1。取处方粉末,按盲法分别置于6名健康志愿者口腔中,记录口感。结果,阿司帕坦/甜菊素为2∶1时,味甜,但其后味苦,且有金属味;阿司帕坦/甜菊素为4∶1时,味甜,略有金属味;阿司帕坦/甜菊素约为6∶1时,味甜,能掩盖药物苦味,且无金属味。故选择阿司帕坦/甜菊素约6∶1为PM口腔崩解片的复合矫味剂。
2.2.3 基本处方设计。根据预试验及单因素试验确定基本处方为:PM原料药4mg,MCC 15mg,PVPP 4mg,硬脂酸镁1.5mg,微粉硅胶1.5mg,阿司帕坦3.4mg,甜菊素0.6mg,甘露醇70mg。将所有组分分别粉碎成细度在100目以上的细粉,采用湿法制粒压片法,将PM与填充剂、内加崩解剂、矫味剂混匀,加入黏合剂制成软材,20~40目筛制粒,45℃干燥,整粒;将整粒后的干颗粒与外加崩解剂、润滑剂混匀,控制片重为100mg、硬度为15~20N压片,制备PM口腔崩解片。
2.3 正交试验
影响口腔崩解片质量的主要因素为处方主要辅料的用量。因此,以PVPP(%,A)、MCC(%,B)、PVP K30(%,C)、矫味剂(%,D)用量占片重百分含量为考察因素,采用4因素3水平设计L9(34)正交试验,以片剂崩解时限为主要考察指标,评价并优化处方,结果见表3、表4,方差分析见表5。

表3 正交因素水平表Tab 3 Factors and levels
表4 正交试验结果(Tab 4Results of orthogonal experiment(s

表4 正交试验结果(Tab 4Results of orthogonal experiment(s
编号 因素123456789ⅠⅡⅢR A 1 1 1 2 2 2 3 3 3B 1 2 3 1 2 3 1 2 3C 1 2 3 2 3 1 3 1 2D 1 2 3 3 1 2 2 3 1体外崩解时限/s 21.0±5.0920.3±6.7727.7±7.5224.2±6.1529.9±7.9326.0±5.4233.6±8.8928.5±5.6230.7±6.3023.026.730.97.926.326.228.11.925.225.130.45.327.226.626.80.6
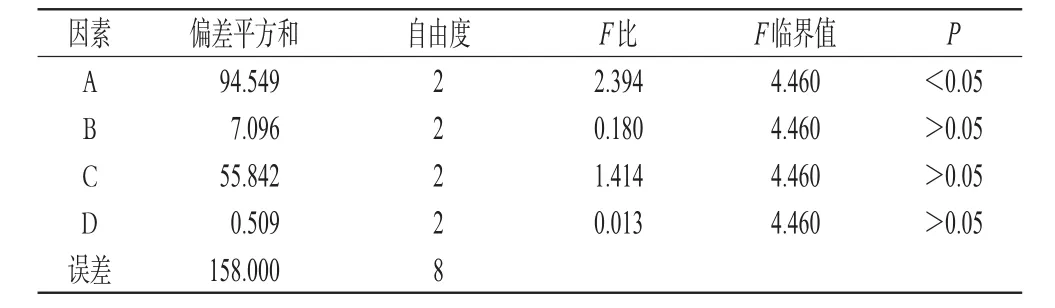
表5 方差分析结果表Tab 5 Results of variance analysis
由表4中极差R值的大小可知,各因素对体外崩解时限的主次关系为PVPP>PVP K30>MCC>矫味剂。其优化水平组合为:A1B2C2D2,即PVPP用量为4%,MCC用量为15%,PVP K30用量为2%,矫味剂即阿司帕坦/甜菊素用量为3%。
2.4 含量测定方法
参照文献[5]建立PM口腔崩解片含量测定方法。色谱条件为:色谱柱:岛津C18(150mm×4.6mm,5μm);流动相:含0.05mol·L-1辛烷磺酸钠的甲醇-0.1%磷酸=60∶40,流速:1.0mL·min-1;内标物:对羟基苯甲酸丁酯;检测波长:215nm;柱温:30℃。PM的保留时间为8.3min;取处方量空白辅料,以流动相溶解过滤,按上述色谱条件进样,结果,其色谱峰对主峰无干扰,见图1。
取PM对照品适量,用流动相溶解并配成质量浓度分别为0.01、0.02、0.04、0.08、0.16mg·mL-1的溶液,进样3μL。以PM与内标物峰面积的比值(y)对质量浓度(x)进行线性回归,得标准曲线方程为:y=2.6361x+0.0236(r=0.9999)。表明PM检测浓度线性范围为0.01~0.16mg·mL-1。其质量浓度分别为0.02、0.06、0.12mg·mL-1时的方法回收率分别为:(101.67±1.09)%、(100.51±0.59)%、(101.35±1.05)%;低、中、高浓度的日内RSD分别为0.62%、0.85%、1.07%,日间RSD分别为1.24%、1.09%、1.14%。
2.5 制备工艺验证
PM在处方中的用量,参照文献[5]中PM片的规格,即每片含PM 4mg。采用湿法制粒压片法,照上述优化后的处方比例,将PM与填充剂、内加崩解剂、矫味剂混匀,加入黏合剂制成软材,20~40目筛制粒,45℃干燥,整粒;将整粒后的干颗粒与外加崩解剂、润滑剂混匀,压片,制备PM口腔崩解片3批(批号100301、100302、100303),检测其片剂的硬度、崩解时限、含量均匀度、含量和口感等质量指标,结果均符合口腔崩解片的相关质量要求[7],详见表6。
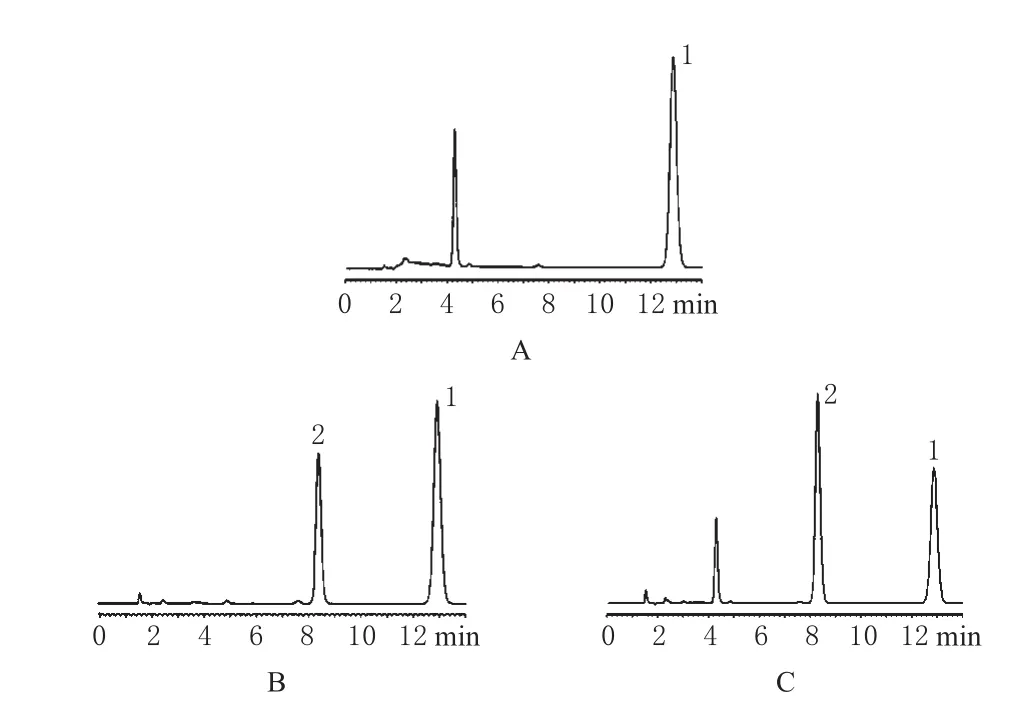
图1 高效液相色谱图A.空白辅料+内标;B.PM对照品+内标;C.样品+内标;1.内标;2.PMFig 1 HPLC chromatogramsA.blank excipients and internal standard;B.PM reference substance and internal standard;C.sample and internal standard;1.internal standard;2.PM
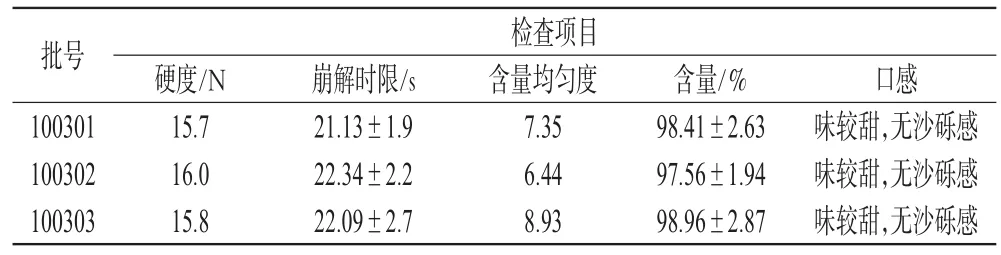
表6 3批PM口腔崩解片质量检查结果Tab 6 Quality examination of 3batches of PM orally disintegrating tablets
2.6 溶出度测定
参照《中国药典》2010版二部附录ⅩC片剂溶出度测定法(第三法)[8],以37℃水为溶出介质,选择转速为50r·min-1。依法操作,分别于0.5、1、2、4、8、15、30、45min取样3mL,同时补充同温度同体积新鲜介质,用0.45μm滤膜过滤,取续滤液进样,测定其溶出度。结果,PM口腔崩解片在1min时的溶出度达到(71.25±1.27)%,4min累积溶出度达到(98.01±0.83)%,详见图2。
3 讨论
3.1 崩解时限
口腔崩解片为固体速释制剂,美国食品药品管理局(FDA)规定其崩解时限为30s内[9],SFDA要求60s内[7]。因此,筛选合适的崩解剂及其内外加比例是成功制备口腔崩解片的关键。笔者最终筛选到的4%PVPP和15%MCC联合使用作为崩解剂,完全达到了口腔崩解片的崩解时限要求。研究[10]表明,PVPP是PVP的高分子交联聚合物,不溶于水及有机溶剂,但在水中能迅速溶胀,崩解性能优越;MCC具有海绵状的多孔管状结构,具有毛细管作用,但溶胀性差[11]。因此,PVPP与MCC的联合应用,可能是其溶胀作用与毛细管作用互补增效,从而加快了口腔崩解片的崩解过程。
根据Washburn方程[12],固/液界面接触角即辅料的疏水性对水分的渗透有显著的影响。PVPP和MCC为疏水性辅料,PVP K30为亲水性辅料,本试验筛选出(4%PVPP+15%MCC)/2%PVP K30的用量比为9.5∶1,此时PM口腔崩解片的崩解性最好,表明辅料的疏水性/亲水性平衡对片剂的崩解性有重要影响。
3.2 矫味剂
口腔崩解片需在口腔内崩解,因此口感是很重要的一项质量指标。PM本身味苦,为改善其口腔崩解片口感,笔者最终筛选出阿司帕坦与甜菊素联合应用作为矫味剂,二者合用占处方量的3%并按约6∶1比例加入时,能够明显掩盖PM的苦味。阿司帕坦的甜度是蔗糖的180~300倍,热量低,安全性高,代谢不需胰岛素参与,对糖尿病、肥胖病患者亦适用;甜菊素的甜度是蔗糖的200~450倍,对热、酸、碱稳定,不参与体内代谢[13]。二者联用对PM有良好的矫味作用。
3.3 溶出度
目前尚无法定的方法测定PM口腔崩解片的溶出度。笔者参照文献[8]方法,进行了介质体积选择、转速选择、溶出均一性、溶出重现性、系统适用性、系统耐用性、溶液稳定性、准确度、精密度、标准曲线、最低检测限和最低定量限等试验,确立了PM口腔崩解片的溶出度测定方法(另文发表)。测定结果表明,PM口腔崩解片4min累积溶出度达到(98.01±0.83)%,与日本规定的PM普通片30min溶出80%相比,具有显著的速释效应。
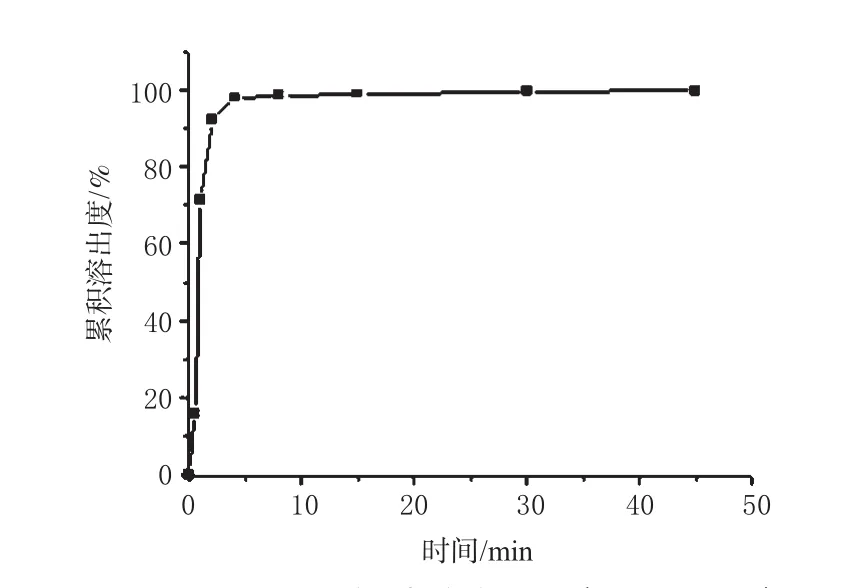
图2 PM口腔崩解片溶出曲线(x±s,n=6)Fig 2 In vitro dissolution curves of PM orally dissolving tablet(sx±s,n=6)
3.4 制备方法
目前口腔崩解片的制备方法主要有粉末直接压片法、冷冻干燥法、喷雾干燥法、湿法制粒压片法等。其中粉末直接压片法是最常用的一种方法,但对原辅料流动性有较高要求,且由于大量采用MCC,成品的口感可能存在较强砂砾感[14]。因此,本试验按上述优化后的处方,采取湿法制粒制备口腔崩解片,其中崩解剂PVPP按1∶1内外加工艺(其中内加是将崩解剂与处方中其他成分混匀制粒,崩解剂存在于颗粒内部;外加则是在压片前将崩解剂与颗粒混匀。崩解剂内、外加比例对崩解时限有较大影响),所制得的口腔崩解片符合相关质量要求,表明本处方科学合理,工艺简单,质量易控,适合于工业生产,具有潜在的市场前景。
[1] 翟光喜,王海刚,凌沛学.口腔崩解片质量评价与临床应用研究进展[J].中国新药杂志,2007,16(12):926.
[2] Svensson P,Wang K,Arendt-Nielsen L.Effect of muscle relaxants on experimental jaw-muscle pain and jaw-stretch reflexes:a double-blind and placebo-controlled trial[J].Eur J Pain,2003,7(5):449.
[3] Pipino F,Menarini C,Lombardi G.et al.A direct myotonolytic(pridinol mesilate)for the management of chronic low back pain:A multicentre,comparative clinical evaluation[J].Eur J Clin Res,1991,1(5):55.
[4] Oertel WH,Dodel RC.International guide to drugs for Parkinson’s disease[J].Mov Disord,1995,10(2):121.
[5] 日本厚生劳动省公定书协会.日本药局方外医药品规格[S].2002年版.东京:Jiho株式会社,2002:207.
[6] 罗永煌,田朋鑫,聂延君,等.甲磺酸普立地诺口腔崩解片及其制备方法[P].CN101664393,2010-03-10.
[7] 国家食品药品监督管理局药品审评中心.口腔崩解片的剂型特点和质量控制会议纪要[EB/OL].http://www.cde.org.cn/.2003-08-02.2009-12-04.
[8] 国家药典委员会.中华人民共和国药典(二部)[S].2010年版.北京:中国医药科技出版社,2010:附录85.
[9] U.S.Food and Drug Administration.Guidance for Industry Orally Disintegrating Tablets[EB/OL].http://www.fda.gov/cder/guidance/index.htm.2008-11.2009-12-05.
[10] 胡盛松,王 清.氟哌啶醇口腔崩解片的制备及质量评价[J].中国实用医药,2010,5(10):13.
[11] 梁国成,吕 洁.蒺藜总皂苷口腔崩解片的制备[J].广东药学院学报,2010,26(1):5.
[12] Kanig J,Rudnic EM.The mechanisms of disintegrant action[J].Pharm Tec,1984,8(4):50.
[13] 唐建华.新型矫味剂在药物口服制剂中的应用[J].中国药业,2007,16(18):59.
[14] 李 标,蒲道俊.口腔崩解片的研究进展[J].中国医院用药评价与分析,2010,10(2):159.
Preparation and Quality Control of Pridinol Mesylate Orally Disintegrating Tablets
TIAN Peng-xin,LUO Yong-huang,LIU Yan-ling,NIE Yan-jun(College of Pharmacy,Southwest University,Chongqing 400715,China)
OBJECTIVE:To prepare orally disintegrating tablets containing pridinol mesylate and investigate its quality.METHODS:Disintegrants and correctants were selected by single-factor experiment with disintegration time and taste as index.The formulation was optimized by L9(34)orthogonal experiment with disintegration time as index using amount of PVPP,MCC,PVP K30and correctants as factors.And validation test was conducted(content,content uniformity and dissolution).RESULTS:4%PVPP was selected as the disintegrant and the inside-outside proportion was 1∶1,3%correctant was aspartame/steviosin with proportion of 6∶1,15%MCC and 2%PVP K30were used.The orally disintegrating tablets were integrated and smooth with desirable taste and feel in the mouth.The disintegration time was(21.85±2.3)s and the cumulative dissolution percentage was(98.01±0.83)%within 4min.The content and content uniformity were up to specification.CONCLUSION:The prescription and technology are reasonable and the quality indexes conform to the requirement of orally disintegrating tablets.
Pridinol mesylate;Orally disintegrating tablets;Orthogonal experiment;Preparation;Quality evaluation
R971+.8;R943
A
1001-0408(2012)01-0048-04
DOI 10.6039/j.issn.1001-0408.2012.01.17
Δ重庆市科技创新能力建设基金资助(CSTC,2009CB1010)
*硕士研究生。研究方向:药物分析学及药剂学。E-mail:tianpengxin@yahoo.com.cn
#通讯作者:教授,硕士研究生导师。研究方向:新药研发。E-mail:luoyonghuang@sohu.com
2011-02-23
2011-04-18)
