塞来昔布对人舌鳞癌Tca-8113细胞表达乙酰肝素酶的影响
2012-11-20刘春临
刘春临
(临汾市人民医院口腔科, 临汾 041000)
舌鳞状细胞癌是口腔颌面部常见的恶性肿瘤,其生长快、预后差与其侵袭性生长及转移率高有关。探讨肿瘤细胞迁移的机制是目前肿瘤治疗的重点。研究表明前列腺素合成中的重要限速酶环氧化酶2(cyclooxygenase-2,COX-2)在舌鳞癌的发生发展中均发挥着重要重要作用,特别是COX-2的高表达与舌鳞癌的侵袭和淋巴转移密切相关[1]。塞来昔布(celecoxib)为COX-2的拮抗剂,目前对于塞来昔布的抗癌机制尚不清楚,认为其可能抗癌机制为抑制COX-2活性,促进肿瘤细胞凋亡,抑制新生血管形成和阻碍癌细胞转移等。乙酰肝素酶(heparanase,Hpa)可降解硫酸乙酰肝素,促进肿瘤细胞侵袭和转移。本实验通过研究塞来昔布对体外培养的人舌鳞癌Tca-8113细胞表达Hpa的影响,分析其对舌鳞癌的抑制作用及其可能机制,为塞来昔布应用于舌鳞癌临床治疗提供可靠的实验依据。
1 材料与方法
1.1 材料 人舌鳞癌细胞Tca-8113细胞株(中国科学院上海动物研究所);DMEM培养液(Gibco,USA);胎牛血清(杭州四季青,北京);胰蛋白酶(Sigma,USA);兔抗人Hpa抗体(北京中杉);过氧化物酶标记的链霉素卵白素(SP)免疫组织化学试剂盒、二氨基联苯胺(DAB)显色试剂盒(北京中杉)。
1.2 仪器设备 25 ml塑料培养瓶、六孔板(Orange scientific);CO2培养箱(Asheville NC,USA);LDZS-2型离心机(北京医用离心机厂);Ⅱ超净工作台(北京市新技术应用研究所);倒置显微镜(重庆光学仪器厂);BI-2000医学图像分析系统(成都泰盟科技有限公司)。
1.3 方法
1.3.1 Tca-8113细胞培养的培养 人舌鳞癌Tca8113细胞株培养于低糖DMEM(10%灭活胎牛血清、100 U/ml青霉素、100 U/ml链霉素)培养液中,置于37℃、5%CO2孵箱内培养。待细胞铺满瓶底后,用0.25%胰蛋白酶和0.02%EDTA消化成单个细胞,按1∶4传代后分瓶并扩大培养。取对数生长期的细胞用于实验。
1.3.2 接种细胞及分组 取对数生长期细胞,胰酶消化后以1×105/cm2接种于含有盖玻片的六孔板内,每组设4孔。置入37℃、5%CO2的无菌孵箱中培养24 h。加入含塞来昔布的培养基,其浓度为:对照组(不加塞来昔布),10 μmol/L,20 μmol/L,40 μmol/L,80μmol/L。将培养板置入孵箱中无菌培养24 h。
1.3.3 塞来昔布的免疫组织化学法 培养48 h后,免疫组织化学检测Hpa的表达,具体步骤如下:取出长有Tca8113细胞的盖玻片,PBS清洗,4%多聚甲醛固定30 min;接着用PBS冲洗,3%H2O2孵育10 min;加一抗4℃湿盒过夜;PBS洗涤后加二抗室温孵育30 min,DAB进行免疫细胞化学显色,常规酒精梯度脱水,二甲苯透明,中性树胶封片。
1.3.4 结果判定 光镜下观察染色结果:免疫组织化学阳性结果为细胞的胞质内有棕黄色阳性颗粒,胞质呈棕黄色。计算机图像分析采用HPIAS-1000高清晰度彩色病理图文分析系统对染色结果进行定量分析,取4个视野在高倍镜(×400)下测量阳性细胞的平均光密度值(OD值),其均值为该标本的测量结果。Hpa的表达与光密度值呈正相关,通过光密度值间接反映Tca8113细胞中Hpa的表达量。
2 结果
Tca8113细胞中Hpa的表达:对照组可见多数阳性染色细胞,细胞胞质中分布有密集的阳性染色颗粒(图1A,见第240页)。实验组中阳性染色细胞数下降,细胞胞质中阳性染色颗粒的密度也降低(图1B,见第240页)。
对细胞的平均光密度值进行统计学分析,五个浓度组进行方差分析,不同浓度的塞来昔布作用后Tca8113细胞分泌Hpa的总体均数不全相等(P<0.05,见表1)。与对照组相比,10,20,40,80 μmol/L四个实验组中Hpa的表达都明显降低(P<0.05),差异有统计学意义。浓度为20-80μmol/L时Hpa的表达,与10μmol/L组相比差异有统计学意义(P<0.05)。

图1 对照组和实验组培养的Tca8113细胞中Hpa的表达(免疫组化染色,×100)Fig 1 Expression of Hpa in Tca8113 cells(immunohistochemistry,×100)
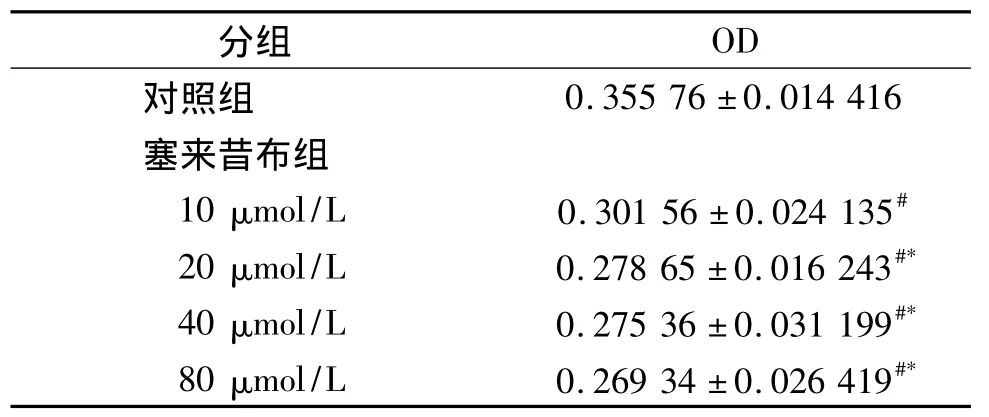
表1 不同浓度下的光密度值方差分析结果 (n=4)Tab 1 Results of statistical analyses on expression of Hpa(n=4)
3 讨论
舌鳞状细胞癌是常见的恶性肿瘤之一,其恶性程度和较强的侵袭能力是导致患者复发和预后不良的主要原因。环氧化酶又称前列腺素内过氧化物合酶,是前列腺素前体花生四烯酸合成过程中的重要限速酶。环氧化酶有2个亚型:Cox-1和Cox-2。其中COX-2是一种催化致炎物质地诺前列酮合成的重要限速酶,在体内呈诱导性表达。在癌前病变、恶性肿瘤,包括口腔白斑和头颈肿瘤中COX-2的表达都是增强的。遗传学的研究也已证明COX-2过度表达和癌症的发生间存在着因果关系[2]。其中,COX-2可能通过以下途径促进肿瘤细胞的侵袭和转移[3,4]:①促进新生血管的生成;②产生或诱导产生降解细胞外基质的蛋白酶;③上调细胞黏附分子的表达;④抑制机体的免疫反应;⑤抑制肿瘤细胞凋亡。
COX-2抑制剂属于非甾体类抗炎药物,其中塞来昔布为高选择性环氧合酶同工酶2(COX-2)的拮抗剂。研究表明,塞来昔布不但能抑制恶性肿瘤细胞的生长、增殖,还能促进肿瘤细胞凋亡,同时能增强肿瘤细胞对抗癌药及放射线的敏感性[5],在口腔中,塞来昔布在抑制人舌鳞癌Tca-8113细胞增殖的同时,抑制前列腺素的分泌,诱导细胞凋亡。此外,塞来昔布还增强抗癌药物对Tca-8113细胞的杀伤作用[1]。这种作用除了依赖于抑制COX-2酶的功能外,也可能存在不依赖于COX-2酶的其他途径,其中包括通过抑制NF-κB通路的激活来实现的[6]。
Hpa是一种内糖苷酶,可降解细胞外基质和基底膜中的硫酸乙酰肝素(heparan sulfate,HS)。HS是构成细胞外基质和基底膜的基本成分,起着维持细胞外基质的稳定性,限制细胞迁移、黏附的重要作用。同时也是构成血管壁的主要成分之一。Hpa可在数个位点上降解硫酸乙酰肝素,破坏细胞外基质和基底膜的完整性,从而有利于肿瘤细胞穿越细胞外基质和血管壁,促进其侵袭和转移,同时还有利于血管内皮细胞的迁移和生长,促进新生血管的形成[7],对肿瘤细胞的侵袭和转移具有重要作用。
本实验用免疫组织化学技术观察塞来昔布对人舌鳞癌Tca-8113细胞合成Hpa的影响情况。结果显示,塞来昔布在10μmol/L就已抑制了Hpa合成。随着塞来昔布浓度的升高至20-80μmol/L,Hpa的表达下降并趋于稳定,抑制作用并未随着浓度的增加而无限增强。这一结果说明塞来昔布在一定的浓度范围内可抑制舌鳞癌Tca-8113细胞中Hpa的表达。通过抑制Hpa的表达进而抑制肿瘤细胞的侵袭和转移,限制血管内皮细胞的迁移和生长及新生血管的形成。这一研究也为舌鳞癌的治疗提供了重要的理论依据,但其中的机制及临床治疗价值尚需进一步的研究。
[1]Minter HA,Eveson JW,Hunfley S,etal.The cyclooxygenase-2 selective inhibitor NS-398 inhibits proliferation of oral carcinoma cell lines by mechanism dependent and independent of reduced prostagland in E2 synthesis[J].Clin Cancer Res,2003,9:1885.
[2]郭伟,曾庆华,王存玉.头颈肿瘤防治的新靶点环氧酶的研究进展[J].中华口腔医学杂志,2004,39(3):261.
[3]Méric JB,Rottey S,Olaussen K.etal.Cyclooxygenase-2 as a target for anticancer drug development[J].Crit Rev Oncol Hematol,2006,59(1):51-64.
[4]Sinicrope FA.Targeting cyclooxygenase-2 for prevention and therapy of colorectal cancer[J].Mol Carcinog,2006,45(6):447-454.
[5]Ohneseit PA,Krebiehl G,Dittmann K,etal.Inhibition of cyclooxygenase-2 activity by celecoxib does not lead to radiosensitization of human prostate cancer cells in vitro[J].Radiother Onco,2007,82(2):229-238.
[6]Yang GZ,Li L,Ding HY,etal.Cyclooxygenase-2 is overexpressed in Chinese esophageal squamous cell carcinoma,and correlated with NF-κB:An immunohistochemical study[J].Exp Mol Pathol,2005,79(3):214-218.
[7]Vlodavsky I,Goldshmidt O,Zcharia E,etal.Molecular.properties and involvement of heparanase in cancer metastasis and angiogenesis[J].Clin Invest,2001,108:341-347.
