SCF/c-kit过度激活在肠易激综合征内脏敏化中的作用
2012-11-20张静瑜黄裕新王景杰
张静瑜, 黄裕新, 秦 明, 王景杰
(第四军医大学唐都医院消化内科, 西安 710038;*通讯作者,E-mail:jingjie@fmmu.edu.cn)
肠易激综合征(irritable bowel syndrome,IBS)为常见功能性胃肠病,其显著特征是内脏敏化及胃肠运动异常。Cajal间质细胞(interstitial cells of Cajal,ICC)为胃肠道节律蠕动发起者及节律电位传播者,也是胃肠神经、脑肠肽调节胃肠活动和各类递(调)质调控胃肠运动的枢纽,且ICC与胃肠道感觉神经有直接的神经突触联系[1-4]。新近研究发现,ICC的身分识别者的c-kit配体—干细胞因子(stem cell factor,SCF)可分泌大量刺激肥大细胞、单核细胞上的c-Kit激酶,该激酶可导致肥大细胞、单核细胞活化增生进而引发肥大细胞、单核细胞在低位肠道的大量浸润[5-7]。那么,SCF在 IBS的内脏敏化以及胃肠动力异常中是否发挥重要作用是我们感兴趣的问题。故此,我们以SCF的特异性阻断剂——甲磺酸伊马替尼(imatinib mesylate,STI-571)特异性阻断SCF/c-kit的活性[8],通过免疫组化和电生理的方法对此问题进行相关的研究,旨在揭示 SCF在IBS内脏敏化中的作用,为新药物开发提供理论依据。
1 材料与方法
1.1 主要实验材料及试剂 保虫昆明鼠(旋毛虫系云黑龙江株)购自河南省疾病预防控制中心,实验大鼠购自第四军医大学实验动物中心,为雄性SD大鼠。兔抗c-Kit血清(1∶3 000,Santa-Cruz公司),羊抗兔 IgG(1∶500,Sigma公司),ABC 复合物(1∶500,Sigma公司)。
1.2 IBS动物模型制作 ①旋毛虫幼虫制备及传代由河南省疾病预防控制中心提供的保虫昆明鼠种鼠(旋毛虫系黑龙江株)共3只,脊柱脱臼法处死后剔除皮毛及内脏,剔除肌肉。将肌肉剪碎置于300 ml 2.5%胃蛋白酶和0.5%盐酸消化液中,置37℃水浴中消化12-20 h。经筛过滤,滤液用生理盐水反复沉淀洗涤3-5次,收集旋毛虫幼虫胞囊并计数。取昆明鼠20只,25 g左右,灌胃法给予0.1 ml含250-300条幼虫的生理盐水悬液。②感染大鼠后将传代感染的昆明鼠以颈椎脱臼法处死收集旋毛虫(方法同前)。③实验组大鼠灌胃法给予1 ml含4 000条幼虫囊胞的生理盐水悬液。被感染鼠饲养8周,抽检测定感染情况,确立模型制作成功[9]。
1.3 实验分组 选取30只IBS模型大鼠随机分为IBS组、IBS结肠扩张组(结肠扩张条件选用我们以往实验的高峰值刺激,即给予球囊中注水1.0 ml)和IBS结肠扩张+STI-571组(腹腔注射20 mg/ml STI-571 0.5 ml/kg),每组10只。再选取正常大鼠20只,随机分为正常组和正常结肠扩张组(结肠扩张条件同上)。即整体实验分组情况:A.正常对照组;B.正常给予扩张组;C.IBS组;D.IBS结肠扩张组;E.IBS结肠扩张+STI-571组。再将以上5组分别随机分成两个亚组,一个亚组用于腹直肌肌电+免疫荧光组化检测,另外一个亚组用于骶髓后连合核(DCN)放电频率测定。
1.4 腹直肌肌电的测量 分别对一个亚组的各实验组大鼠测量腹直肌肌电。电极置于大鼠腹中线两侧、电极间距3-4 cm,采用RM6280B生物信号采集处理软件记录和分析腹壁肌电活动(成都仪器厂生产)。记录安静无刺激状态下腹直肌放电幅值,维持30 s。间期休息5 min后,对IBS结肠扩张组进行结肠扩张刺激。将气囊缓慢插入大鼠直肠,进入到结肠距离肛门35 mm处固定,记录给予直肠刺激后腹直肌放电幅值,维持30 s。休息5 min后再应用注射器给气囊注入1.0 ml蒸馏水。再次记录给予肠道压力后腹直肌放电幅值。电生理记录仪参数设置:采集频率40 kHz,扫描速度200 ms/div,灵敏度500 μV,时间常数0.001 s,滤波频率3 kHz。
1.5 切片制备及免疫荧光化学标记
1.5.1 组织冰冻切片制作 分别对一个亚组的各实验组大鼠进行灌注内固定后立即剖腹,取乙状结肠处0.4 cm×0.2 cm大小组织,置于4%多聚甲醛固定液 X-100的0.1 mol/L PBS后固定6 h(4℃),取出标本移入30%蔗糖液中24 h(4℃)。超低温切片机(美国NUAIR公司)切片10μm,待染。
1.5.2 双重荧光免疫组织化学标记(间接法) 将标本置于0.3%H2O2-甲醇中浸泡30 min封闭内源性过氧化物酶,0.1%Triton浸泡30 min,PBS漂洗,分别入免疫血清稀释的1∶200 c-kit兔多抗。4℃孵育过夜(约14 h),第2天将切片和铺片置于室温下复温1 h,经PBS漂洗后入1∶60稀释的四甲基异硫氰酸罗丹明(TMRITC)标记的抗兔IgG二抗及异硫氰酸荧光素(FITC)标记的抗小鼠IgG二抗,室温孵育3 h,PBS漂洗后,将铺片平置于载玻片上,与切片标本同时用60%缓冲甘油封片。
1.5.3 激光共聚焦显微镜采图分析 每一张切片或铺片取4-6个视野,将数字化图像储存于LSCM系统的计算机,待实验结束后进行图像分析。
1.6 骶髓后联合核(DCN)神经元单位放电测定分别对另一个亚组的各实验组大鼠进行骶髓后联合核(DCN)神经元单位放电测定,选择S1处(参照Paxnos图谱第二版,在L6-S3之间)的锥板,将其咬除,暴露脊髓,将硬脊膜去除,通过反馈式电热毯将动物体温控制在正常生理范围内[直肠温度(37±1)℃]。采用单管玻璃微电极细胞外记录的方法,以玻璃微电极5-10 MΩ,在暴露脊髓背侧正中线约0.8-1 mm左右,深度600-1 000μm范围内寻找典型广动力范围(wide dynamic range,WDR)单细胞电位。待放电稳定后开始记录。
1.7 统计学分析 采用SPSS16.0软件进行统计分析。大鼠腹直肌肌电的波幅和频率数据以±s表示,组间比较采用非参数检验;荧光半定量经Image J 1.43软件进行处理,所得到的荧光光度值差异采用Kruskal-Wallis H检验及Nemenyi法检验进行比较;大鼠DCN放电频率数据组间采用非参数检验进行处理。
2 结果
2.1 STI-571对IBS大鼠腹直肌肌电活动的影响实验结果显示:正常状态下,大鼠腹直肌肌电的波幅和频率比较稳定。正常大鼠以结肠插入球囊灌水扩张后,大鼠腹直肌肌电的频率和波幅有所增加,但与正常对照组相比未见明显差异(P>0.05)。与正常组及正常扩张组相比,IBS组大鼠腹直肌肌电未见有显著变化(P>0.05)。IBS大鼠给予结肠刺激后,腹直肌肌电变化较正常大鼠给予扩张刺激后有显著性差异(P<0.05),而给予STI-571腹腔注射干预组的IBS大鼠与给予结肠刺激的IBS大鼠腹直肌肌电相比,存在统计学差异(P<0.05,见图1、表1)。
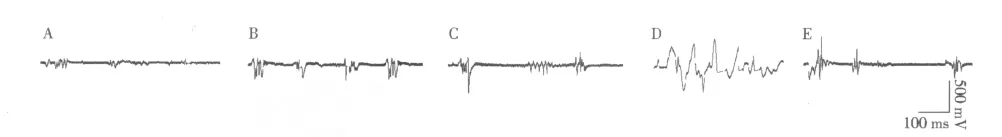
图1 STI-571对IBS大鼠腹直肌肌电活动的影响Fig 1 Effect of STI-571 on the electro-activity of rectus abdominis in IBSrats

图2 STI-571对IBS大鼠肠道ICC活化的影响 (n=5,Bar=100μm)Fig 2 Effect of STI-571 on the activity of intestinal ICC in IBSrats (n=5,Bar=100 μm)
表1 STI-571对IBS大鼠腹直肌肌电的影响(±s,n=5)Tab 1 Electro-activity of STI-571 on the rectus abdominis in IBS rats(±s,n=5)
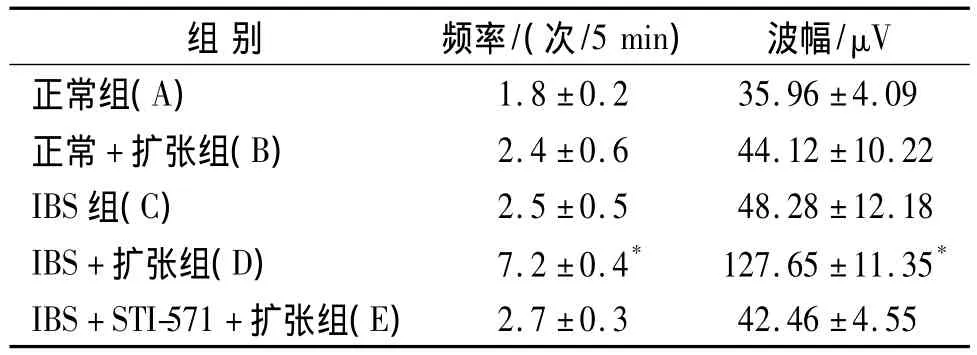
表1 STI-571对IBS大鼠腹直肌肌电的影响(±s,n=5)Tab 1 Electro-activity of STI-571 on the rectus abdominis in IBS rats(±s,n=5)
与A、B、C、E 组比较,*P<0.05;C 组与 B、E 组比较,P>0.05;B组与A组比较,P>0.05
IBS+扩张组(D) 7.2±0.4* 127.65±11.35*IBS+STI-571+扩张组(E)2.7±0.3 42.46±4.55
2.2 STI-571对IBS大鼠肠道ICC活化的影响 实验结果显示:正常状态下,大鼠结肠部位的c-kit处于稳定的低水平表达状态,其荧光光度值切片为43±5;铺片为55±5。给予正常大鼠以结肠插入球囊灌水扩张后,大鼠结肠部位的c-kit表达水平有所增加,其荧光光度值切片为47±5;铺片为61±5,与正常对照组相比未见明显差异(P>0.05)。IBS组大鼠结肠部位的c-kit表达水平略有增加,切片荧光光度值为52±5;铺片为63±5,与正常对照组及正常扩张组相比未见明显差异(P>0.05)。IBS组大鼠给予结肠刺激后,其结肠部位的c-kit表达水平显著增高(其荧光光度值切片92±5;铺片104±5),与正常给予扩张刺激组有显著差异(P<0.01),而给予STI-571腹腔注射干预组的IBS大鼠结肠部位的c-kit表达明显降低(其荧光光度值切片50±5;铺片58±5),与IBS结肠扩张组相比,存在显著差异(P<0.01)见图2(见第239 页)、3。
2.3 STI-571对IBS大鼠DCN放电频率的影响实验结果显示:正常状态下,大鼠放电频率较为规显差异(P>0.05)。IBS大鼠DCN放电频率较稳定,与正常组及正常扩张组相比未见显著差异(P>0.05)。IBS大鼠给予结肠刺激后,其DCN放电频率显著增高,与正常给予扩张刺激组有显著性差异(P<0.05),而给予STI-571腹腔注射干预组的IBS组大鼠DCN放电频率与仅给予结肠刺激的IBS组相比,存在统计学差异(P<0.05,见图4、5)。律。给予正常大鼠以结肠插入球囊灌水扩张后,大鼠DCN放电频率有所增加,与正常对照相比未见明
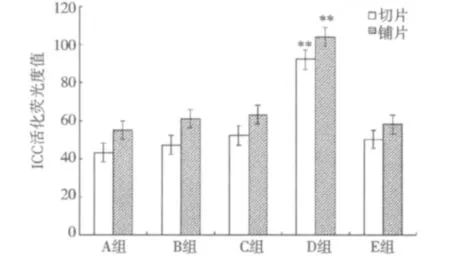
图3 STI-571对IBS大鼠肠道ICC活化影响的荧光光度值比较Fig 3 Comparison of fluorescence photometric values of ICC in IBSrats
3 讨论
肠易激综合征(IBS)为常见功能性胃肠病,其显著特征是内脏敏化及胃肠运动异常。Cajal间质细胞(ICC)为胃肠道节律蠕动发起者及节律电位传播者,也是胃肠神经、脑肠肽调节胃肠活动和各类递(调)质调控胃肠运动的枢纽,且ICC与胃肠道感觉神经有直接的神经突触联系。c-kit广泛分布于胃肠道ICC内,是ICC的身份标志基因,在ICC的分化发育与生存中起关键作用,有文献报道,在大鼠出生后连续胃肠内给予c-kit的抗体能使大部分胃肠内ICC死亡,至成年后会出现与c-kit基因删除后同样的表型变化,即胃肠道不出现慢波(SW),胃肠不蠕动或蠕动很慢,在成年后给予c-kit抗体能抑制ICC 的节律放电[10-12]。SCF 是 c-kit的天然配体,ckit受体是由原癌基因c-kit编码的一种具有酪氨酸激酶活性的跨膜蛋白,是Ⅲ型酪氨酸激酶受体家族中的重要成员,与其同属一个家族的受体分子还包括巨噬细胞集落刺激因子受体、血小板衍生的生长因子受体和flk2/flk3受体等。人类c-kit基因定位于4号染色体长臂(4q11-12),编码一种相对分子质量约为145 000 的跨膜蛋白,又称 CD117[13,14]。c-kit受体的分子结构由细胞外区、跨膜区和细胞质区等3部分组成,其中最重要的是细胞外区,该区担负着与配体结合的功能。c-kit受体广泛存在于各种发育阶段的造血细胞以及其他的一些组织中,如胃肠道组织中。SCF与其受体c-kit之间的特异性结合可触发c-kit的同源二聚体化和其细胞膜内酪氨酸残基的磷酸化,产生停泊位点,捕获含有SH2结构域的信号分子,通过多种信号因子的参与将细胞外的信号转导到细胞内部,引发某些基因的特异性表达,从而精确地调控细胞的分化与增殖。SCF/c-kit信号途径下游信号转导通路非常复杂,目前已知有如下 4条:①Ras/Raf21/MAP通路;②Jak/STAT通路;③Src家族通路;④磷酯酰肌醇3激酶(PI3K)通路。有文献已经报道,SCF是引发IBS发生时肥大细胞、单核细胞在肠黏膜内大量浸润与增生的主要细胞因子[15]。
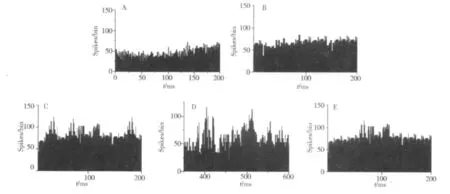
图4 STI-571对IBS大鼠DCN放电频率的影响Fig 4 Effect of STI-571 on the discharge frequency of DCN in IBSrats

图5 STI-571对IBS大鼠DCN放电频率影响的比较Fig 5 Comparison of the discharge frequency of DCN in IBSrats
我们新近发现,当SCF被过度激活,ICC产生异常放电,经肠道感觉神经传入引起支配左半结肠运动的骶髓后联合核(DCN)电活动产生显著变化,提示SCF的过度激活是IBS发生的重要基础,我们在本研究中进一步采用SCF的特异性阻断剂STI-571对IBS大鼠的SCF/c-kit进行阻断发现。IBS大鼠对于扩张刺激的反应性明显降低,主要表现在IBS大鼠腹直肌肌电活动频率和波幅的降低,结肠ICC活化程度明显降低,支配左半结肠运动的骶髓后连合核的放电频率的降低明显,提示当STI-571阻断SCF/c-kit情况下,IBS大鼠的内脏敏化程度明显得到抑制。另外一个方面,当STI-571阻断SCF/c-kit情况下,IBS大鼠的结肠部分的ICC活化程度明显降低,由于ICC是胃肠动力的起搏细胞,故此提示STI-571阻断SCF/c-kit可使IBS大鼠的胃肠道异常运动受到明显控制。通过上述研究我们可以说明,SCF/c-kit在IBS发生过程而产生的内脏敏化以及胃肠运动异常方面占有重要地位,有关其具体的发生机制以及细胞信号转导机制尚待进一步研究。
[1]Fox EA,Phillips RJ,Baronowsky EA,etal.Neurotrophin-4 deficient mice have a loss of vagal intraganglionic mechanoreceptors from thesmall intestineand adisruption of short-term satiety[J].JNeurosci,2001,21(21):8602-8615.
[2]Iino S,Horiguchi S,Horiguchi K.Interstitial cells of Cajal in the gastrointestinal musculature of W(jic)c-kit mutant mice[J].J Smooth Muscle Res,2011,47(3/4):111-121.
[3]Khan S,Chang L.Diagnosis and management of IBS[J].J Nat Rev Gastroenterol Hepatol,2010,7(10):565-581.
[4]Ghaith O,El-Halabi M,Hashash JG,etal.Investigational agents for the irritable bowel syndrome[J].J Expert Opin Investig Drugs,2010,19(10):1161-1178.
[5]Ohman L,Simrén M.Pathogenesis of IBS:role of inflammation,immunity and neuroimmune interactions[J].JNat Rev Gastroenterol Hepatol,2010,7(3):163-173.
[6]Barbara G,De Giorgio R,Stanghellini V,etal.A role for inflammation in irritable bowel syndrome[J].Gut,2002,51(Suppl 1):141-144.
[7]Huizinga JD,Thuneberg L,Kluppel M,etal.W/kit gene required for interstitial cells of Cajal and for intestinal pacemaker activity[J].Nature,1995,373(6512):347-349.
[8]Heinrich MC,Griffith DJ,Druker BJ,etal.Inhibition of c-kit receptor tyrosine kinase activity by STI 571,a selective tyrosine kinase inhibitor[J].Blood,2000,96(3):925-932.
[9]Wang XY,Vannucchi MG,Nieuwmeyer F,etal.Changes in interstitial cells of Cajal at the deep muscular plexus are associated with loss of distention-induced burst type muscle activity in mice infected by Trichinella spiralis[J].Am J Pathol,2005,167(2):437-453.
[10]Midrio P,Vannucchi MG,Pieri L,etal.Delayed development of interstitial cells of Cajal in the ileum of a human case of gastroschisis[J].J Cell Mol Med,2008,12(2):471-478.
[11]Li J,Goodyer CG,Fellows F,etal.Stem cell factor/c-Kit interactions regulate human islet-epithelial cluster proliferation and differentiation[J].Int J Biochem Cell Biol,2006,38:961-972.
[12]Gibson PC,Cooper K.CD117(KIT):a diverse protein with selective applications in surgical pathology[J].J Adv Anat Pathol,2002,9(1):652-669.
[13]Akbar A,Yiangou Y,Facer P,etal.Increased capsaicin receptor TRPV1-expressing sensory fibres in irritable bowel syndrome and their correlation with abdominal pain[J].Gut,2008,57:923-929.
[14]Takeuchi Y,Fujino Y,Watanabe M,etal.Aberrant autophosphorylation of c-Kit receptor in canine mast cell tumor cell lines[J].JVet Immunol Immunopathol,2010,137(3/4):208-216.
[15]Guilarte M,Santos J,de Torres I,etal.Diarrhoea-predominant IBS patients show mast cell activation and hyperplasia in the jejunum[J].Gut,2007,56(2):203-209.
