赭曲霉毒素A直接竞争ELISA试剂盒的研制
2012-11-20李沐洁张明洲陈宗伦王唯芬
李沐洁 奚 茜 张明洲, 陈宗伦 王唯芬
(浙江省生物计量与检验检疫重点实验室 中国计量学院生命科学学院1,杭州 310018)
(杭州迪恩科技有限公司2,杭州 310013)
赭曲霉毒素A直接竞争ELISA试剂盒的研制
李沐洁1奚 茜1张明洲1,2陈宗伦2王唯芬1
(浙江省生物计量与检验检疫重点实验室 中国计量学院生命科学学院1,杭州 310018)
(杭州迪恩科技有限公司2,杭州 310013)
在多克隆抗体的基础上研制了赭曲霉毒素A(OTA)直接竞争酶联免疫检测(cd-ELISA)试剂盒。在0~10 ng/mL范围内,该试剂盒50%抑制率(IC50)为1.09 ng/mL,检测灵敏度(IC15)为0.08 ng/mL;与赭曲霉毒素B、C的交叉反应率分别为6.28%和0.16%,而与黄曲霉毒素B1等生物毒素未见有交叉反应;板内与板间平均变异系数分别为2.21%和2.79%;花生、玉米和玉米粉3种样品中OTA的检测低限分别为1.71,1.26和1.85 μg/kg,平均添加回收率在83.80%~91.40%;与 HPLC 检测方法具有较高的相关性,相关系数(R2)分别为0.94、0.88和0.90;检测时间只需20 min,可用于花生、玉米及玉米粉中OTA的批量快速筛查。
赭曲霉毒素A 多克隆抗体 直接竞争ELISA
赭曲霉毒素主要是由赭曲霉(Aspergillus ochraceus)及纯绿青霉(Penicillium viridicatum)等有毒真菌在恶劣环境条件下产生的有毒次级代谢产物[1],属烈性的肝脏和肾脏毒素。它包括7种化学结构相似的化合物,其中毒性最大、分布最广、产毒量最高、对农作物污染最重、对人和动物影响最大的是赭曲霉毒素A(OTA)。OTA具有肾脏毒性、肝脏毒性、免疫毒性、以及致畸、致癌和致突变作用等多种毒性,对动物和人体健康有很大的潜在危害[2]。1993年,国际癌症研究机构(The International Agency for Research on Cancer,LARC)将 OTA定为2B类致癌物(即可能引起人类癌症的物质)[3]。因此世界各国均重视对赭曲霉毒素A的检测和控制,欧盟于2006年12月19日制定欧盟委员会条例(EC)No1881/2006[4],规定谷物原料中 OTA 最大限量为 5 μg/kg,谷物加工制品和直接供人食用的谷物中最大限量为3 μg/kg,婴幼儿食品及有特殊医疗目的婴儿食品中不超过0.5 μg/kg;我国也规定供人食用谷类和豆类中 OTA 的最大限量为 5 μg/kg[5]。
目前OTA的检测方法主要有薄层色谱法(TLC)[6-8]、高效液相色谱法(HPLC)[9-11]、液相色谱串联质谱法[12-13]、酶联免疫吸附法[14-16]等。但色谱分析需要昂贵的仪器、复杂的样品预处理(净化,浓缩或衍生)和大量的有机溶剂和其他化学品[17],不能满足基层大规模筛查和现场抽检的需要。酶联免疫分析(ELISA)方法可以在较短时间内完成大量样品的分析,操作简便,成本比较低,适合作为大量阴性样品的快速筛选[18]。本研究在制备OTA特异性多克隆抗体的基础上,采用直接包被抗体的方法成功研制出OTA直接竞争酶联免疫(cd-ELISA)检测试剂盒,为谷物中OTA免疫快速筛检方法的建立和拥有自主知识产权检测试剂盒产品的开发奠定基础。
1 材料和方法
1.1 主要试剂
赭曲霉毒素A、赭曲霉毒素B、赭曲霉毒素C、黄曲霉毒素B1、黄曲霉毒素M1、玉米赤霉烯酮、伏马毒素B1、呕吐毒素与T-2毒素:以色列Fermantek公司;人血清白蛋白(HSA)、辣根过氧化物酶(HRP)、3,3',5,5'- 四甲基联苯胺(TMB)、弗氏完全与不完全佐剂、N-羟基琥珀酰胺(NHS)、N,N-二环己基碳二亚胺 (DCC)、N,N-二甲基甲酰胺(DMF)、N,N'-羰基二咪唑(CDI):美国Sigma公司;牛血清白蛋白(BSA):美国Amesco公司;辣根过氧化物酶标记羊抗兔IgG:美国Pierce公司;色谱纯甲醇、乙腈:美国Tedia公司,其他试剂均为国产分析纯。
磷酸盐缓冲溶液(PBS):0.01 mol/L,pH 7.4;洗液(PBST):含 0.05%Tween-20的 PBS;包被液(CBS):0.1 mol/L pH 9.6的碳酸盐缓冲液;封闭液:含5%OVA的PBST;终止液:2 mol/L硫酸。
1.2 主要仪器与耗材
UV-4802S紫外可见分光光度计:美国Unico公司;VE-180垂直电泳槽、EPS-300数显稳压稳流电泳仪:上海天能科技有限公司;Gel Doc XR凝胶成像系统:美国Bio-rad公司;Multiskan Ascent全自动酶联免疫分析仪:美国Thermo公司;H P1100高效液相色谱仪(配荧光检测器):美国Agilent公司;96孔酶标板:美国Corning-Costar公司。
1.3 OTA人工抗原的合成与鉴定
采用活泼酯法合成OTA人工抗原(图1)。准确称取 3.5 mg OTA、3.8 mg NHS 和13.6 mg DCC 溶于0.5 mL DMF中,室温下避光搅拌反应18 h,吸取100 μL上述溶液,冰浴条件下逐滴加入1.75 mg BSA(溶于 0.75 mL 0.13 mol/L NaHCO3溶液)中,室温下避光搅拌反应2 h。反应结束后,4℃下PBS透析3 d[19]。同法合成包被抗原OTA-HSA。人工抗原采用紫外光谱扫描、SDS-PAGE电泳与红外扫描(波数400~4 000 cm-1)鉴定。

图1 OTA人工抗原合成路线
1.4 OTA酶标抗原的制备
准确称取2 mg OTA溶于100 μL丙酮,加入3 mg CDI,室温避光搅拌反应20 min后逐滴加入4 mg HRP(溶于1.5 mL 0.05 mol/L 碳酸盐缓冲液)中,室温避光搅拌反应4 h。反应结束后,4℃下PBS透析3 d[20]。
1.5 多克隆抗体的制备及效价测定
将1 mg/mL OTA-BSA与等量佐剂乳化(第1次免疫用弗氏完全佐剂,以后加强免疫均用弗氏不完全佐剂),采用背腹部皮下多点注射方式免疫2.5~3 kg体重新西兰大白兔,共免疫4次,首次免疫剂量为 0.5 mg/(mL·只),加强免疫为 0.25 mg/(mL·只)。第4次加强免疫后10 d心脏采血。血清经辛酸-硫酸铵分离纯化后由SDS-PAGE电泳鉴定并采用间接ELISA测定抗体效价。
1.6 OTA直接竞争ELISA(cd-ELISA)的建立
1.6.1 抗体与酶标抗原最适工作浓度的确定
用CBS将抗体倍比稀释(1∶500~1∶3 000)后包被 96 孔酶标板,100 μL/孔,37 ℃ 孵育 2 h,PBST洗涤3次;200 μL/孔封闭液,37 ℃封闭 2 h,PBST洗涤3次;加入PBS倍比稀释的OTA酶标抗原(1∶100 ~1∶800),100 μL/孔,37 ℃ 孵 育 10 min,PBST 洗涤3 次;加入显色剂,100 μL/孔,37 ℃ 孵育10 min;每孔加入100 μL终止液终止反应,酶标仪测定各孔的OD450nm值。选择OD450nm值为1.0左右的组合[21]。
1.6.2 OTA与酶标抗原最佳反应模式的确定
在抗体与酶标抗原最适工作浓度下,加入PBS或PBS配制的10 ng/mL OTA与酶标抗原(A:50 μL PBS或 OTA+100 μL 酶标抗原;B:100 μL PBS 或OTA+100 μL 酶标抗原;C∶100 μL PBS 或 OTA+50 μL 酶标抗原;D∶50 μL PBS 或 OTA+50 μL 酶标抗原),按1.6.1测定各孔的OD450nm值并计算4种模式下方法对10 ng/mL OTA的抑制情况,选择抑制效果好的反应模式。
1.6.3 OTA 直接竞争 ELISA(cd-ELISA)标准曲线的建立
在最佳工作浓度和反应模式下,PBS配制OTA系列标准工作溶液(10、5、2.5、1.0、0.5、0.25、0.1、0 ng/mL),采用cd-ELISA测定OD450nm值。以结合率(B/B0,B是不同质量浓度的 OTA标准品的OD450nm值,B0是 OTA标准品质量浓度为 0时的OD450nm值)为纵坐标,OTA不同质量浓度为横坐标绘制OTA标准曲线,并分别计算50%(IC50)和15%(IC15)抑制浓度,以IC50衡量抗体对OTA的亲合性,以IC15衡量OTA cd-ELISA法的检测灵敏度。结合率与抑制率计算公式如下:

1.6.4 方法的特异性分析
在cd-ELISA最佳工作条件下,将赭曲霉毒素B、C及其他生物毒素(黄曲霉毒素B1、黄曲霉毒素M1、玉米赤霉烯酮、伏马毒素B1、呕吐毒素与T-2毒素)作为抑制剂,测定各抑制剂50%抑制浓度(IC50),以抗体对OTA的IC50与对各抑制剂的IC50之比的百分数为其交叉反应率(CR),通过交叉反应率高低衡量方法的特异性。交叉反应率(CR)按式(3)计算:
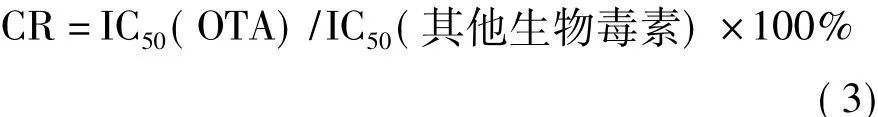
1.6.5 方法的准确性分析
通过在同一酶标板上做6组平行cd-ELISA标准曲线和分别在6个包被批次的酶标板上各做1组平行cd-ELISA标准曲线进行板内与板间变异系数分析,研究不同标准品浓度测定结果的准确性。
1.6.6 样品添加回收试验与最低检出限分析
1.6.6.1 样品前处理方法
精确称取粉碎样品2 g于50 mL可密封的离心管中,加入10 mL提取液(50%的甲醇水溶液),于振荡器上振荡提取5 min,用滤纸过滤,或者5 000 r/min离心5 min,取上清液备用。
1.6.6.2 样品基质影响试验
取花生、玉米和玉米粉阴性样品,按1.6.6.1方法分别制备提取上清液,以PBS稀释1、2.5和5倍不同处理;以PBS为对照,每处理用于配制系列标准品溶液,按1.6.3方法建立4条标准曲线,分析样品基质对OTA cd-ELISA的影响。
1.6.6.3 检测低限分析
随机抽取阴性样品,按1.6.6.1方法前处理并消除基质影响后以建立的OTA cd-ELISA分析,检测低限(LOD)以阴性样品的平均测定值(n=20)加上其3倍的标准差进行计算。
1.6.6.4 样品加标回收率试验
在花生、玉米和玉米粉阴性样品中分别添加OTA标准品至5、10和25!g/kg,每浓度重复做3次,每个重复设2孔平行。样品按1.6.6.1方法前处理并消除基质影响后,cd-ELISA测定OD450nm值,并根据标准曲线计算样品添加回收率:

1.6.7 与HPLC比对试验
1.6.7.1 色谱条件[22]
色谱柱:Hypersil C18(150 mm ×4.6 mm,3 μm);柱温:室温;流动相:乙腈/水/乙酸(99/99/2,体积比);流速:0.4 mL/min;进样量:20 μL;激发波长:330 nm;发射波长:450 nm。
1.6.7.2 OTA 标准曲线制备
乙腈配制OTA系列标准工作溶液(100、40、20、10、1、0 ng/mL),采用上述色谱条件测定各浓度下的色谱峰面积,以浓度为横坐标,峰面积为纵坐标绘制标准曲线。
1.6.7.3 样品前处理[23]
取粉碎后的样品5 g,加入25 mL甲醇,超声提取20 min,过滤;取适量甲醇润洗容器和滤纸,合并甲醇溶液;将甲醇提取液减压蒸干,取5 mL流动相溶解,过0.22 μm滤膜后进样分析。以保留时间定性,峰面积定量。
1.6.7.4 比对方法
在花生、玉米和玉米粉粉碎阴性样品中分别添加 OTA 标准品至 5、10、25、50 μg/kg,分别用 HPLC与ELISA方法提取测定,每个样品添加浓度重复6次,以HPLC测定值为横坐标、ELISA测定值为纵坐标绘制散点图进行回归分析,以相关系数(R2)衡量2种方法的相符性。
2 结果与讨论
2.1 OTA人工抗原鉴定
2.1.1 紫外扫描分析
将 OTA、BSA、HSA、OTA -BSA、OTA -HSA 溶液用PBS稀释到合适浓度后进行紫外扫描。结果表明(图2),载体蛋白BSA、HSA在280 nm有特征吸收,OTA在333 nm具有特征吸收峰,反应产物的图谱与载体蛋白、OTA的图谱都有所不同。同时,反应产物的最大吸收峰波长与载体蛋白、OTA的比较都有所移动,这说明反应产物是不同于载体蛋白和半抗原的物质,是载体蛋白和OTA的复合物。

图2 OTA人工抗原的紫外扫描图
2.1.2 SDS-PAGE 电泳分析
OTA人工抗原SDS-PAGE电泳结果如图3所示,第3、5泳道分别明显滞后于第2、4泳道,说明载体BSA或HSA经合成反应后连接上了一定数目的OTA,从而使得分子质量增大。

图3 OTA人工抗原SDS-PAGE电泳图
2.1.3 红外扫描分析
将OTA、BSA和OTA-BSA冻干粉与适量KBr混匀研磨后压片进行红外扫描,从图4可以看出,反应产物的图谱与载体蛋白、半抗原的图谱存在一定差异。与OTA相比,产物在羧基中氧氢键所在的3 000 cm-1处的吸收峰的峰型不明显,而与BSA相比,产物在1 530 cm-1处伯氨基的吸收峰明显降低,可以推测这是由于OTA的羧基与BSA的伯氨基发生脱水缩合反应形成肽键,导致羧基和伯氨基大量减少造成的,再结合紫外光谱图和SDS-PAGE结果,证明OTA与BSA确已发生了偶联反应。

图4 OTA人工免疫原的红外扫描图
2.2 血清纯化结果
血清经纯化由SDS-PAGE(图5)鉴定可知,其在2、4泳道中仅呈现2条带,分子质量大约在52 ku和26 ku左右,分别与抗体的重、轻链分子质量55 ku和26 ku大小一致,其他条带均消失,说明血清纯化达到较好的效果。

图5 血清抗体SDS-PAGE电泳图
2.3 抗体效价测定
用CBS将包被抗原OTA-HSA稀释成2 μg/mL后包被96孔酶标板,采用间接ELISA测定纯化抗体效价。OD450nm值为0.8~1.0左右时抗体的稀释倍数即为其效价。从表1可看出OTA抗体的效价为1∶3 000。

表1 OTA抗体效价测定
2.4 OTA直接竞争ELISA(cd-ELISA)的建立
2.4.1 OTA抗体与酶标抗原最适工作浓度的确定
根据棋盘法结果(表2),选择 OD450nm值为1.0左右的组合。考虑到阴性值越低对检测影响越小,以及节约抗体、酶标抗原使用量的原则,最后确定包被抗体稀释3 000倍,酶标抗原稀释200倍时为最佳工作浓度。

表2 OTA抗体和酶标抗原最佳工作浓度的确定
2.4.2 OTA与酶标抗原最佳反应模式的确定
结果如表3,考虑到抑制情况,最后确定OTA加样量为100 μL,酶标抗原为50 μL为最佳反应模式。

表3 反应模式的确定
2.4.3 OTA cd-ELISA 标准曲线的建立
用CBS将抗体稀释3 000倍后包被96孔酶标板,100 μL/孔,37℃ 孵育 2 h,PBST 洗涤 3 次;200 μL/孔封闭液,37℃封闭2 h,PBST洗涤 3次;加入100 μL OTA 系列标准工作溶液(10、5、2.5、1.0、0.5、0.25、0.1、0 ng/mL)与 50 μL PBS 稀释 200 倍的OTA酶标抗原,37℃孵育10 min,PBST洗涤 3次;加入显色剂,100 μL/孔,37 ℃孵育10 min;每孔加入100 μL终止液终止反应,酶标仪测定各孔的OD450nm值。
以结合率为纵坐标、OTA浓度为横坐标绘制的标准曲线如图6所示。在0.1~10 ng/mL质量浓度范围内结合率与浓度呈线性关系,线性回归方程为y= -0.347 6x+0.878 3,R2=0.991 9,50%抑制率IC50=1.09 ng/mL,方法的检测灵敏度 IC15=0.08 ng/mL。
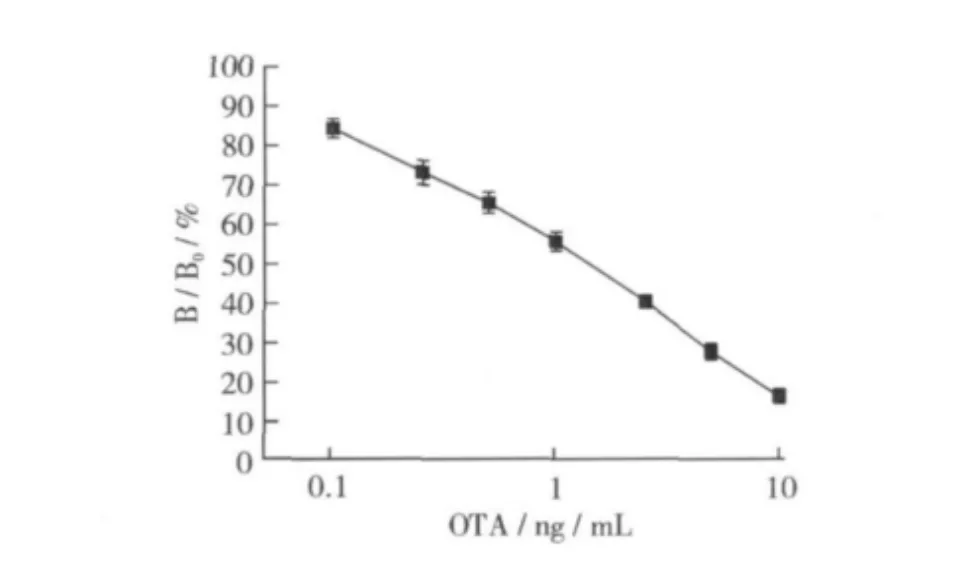
图6 OTA标准曲线
2.4.4 方法的特异性分析
OTA抗体对其类似物赭曲霉毒素B、C的交叉反应率分别为6.28%和0.16%;而对黄曲霉毒素B1等生物毒素的交叉反应率均小于0.01%(表4)。说明以本研究获得的OTA抗体建立的cd-ELISA检测方法具有良好的特异性,其他生物毒素对OTA检测的干扰较小。

表4 交叉反应试验结果
2.4.5 方法的准确性分析
结果表明(表 5),各浓度板内变异系数在0.73%~3.79%之间,平均变异系数为 2.21%,板间变异系数在1.67%~4.29%之间,平均变异系数为2.79%。说明该方法的准确性较高,可以满足谷物中OTA含量分析的基本要求。

表5 板内与板间变异系数
2.4.6 样品基质影响分析
与对照(样品稀释液)相比较,样品基质被稀释1倍和2.5倍时,样品基质仍对标准曲线有一定影响;稀释5倍时,0.1~10 ng/mL范围内的标准曲线变化不大(图7)。因此,花生、玉米和玉米粉3种样品选择5倍稀释来消除基质影响。

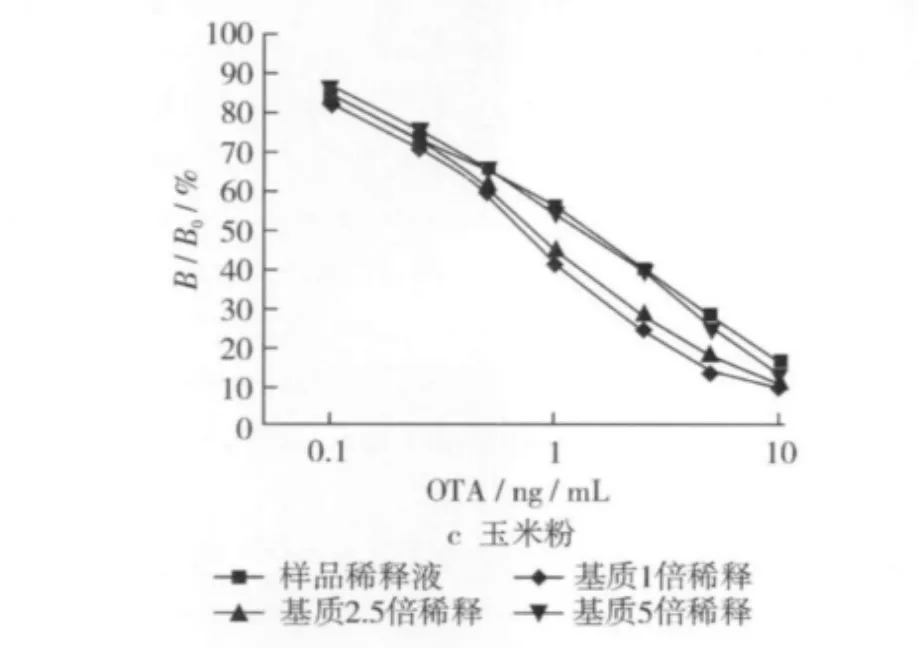
图7 样品基质对标准曲线的影响
2.4.7 方法的检测低限分析
从表6可见,花生、玉米及玉米粉中OTA的检测低限分别为1.71、1.26 和 1.85!g/kg。

表6 花生、玉米与玉米粉的检测低限/!g/kg
2.4.8 样品加标回收率试验
花生、玉米和玉米粉阴性样品中,OTA在添加5~25!g/kg的平均回收率在83.80%~91.40%范围内(表7),说明该方法的准确性较高。

表7 样品加标回收试验结果(平均值)
2.5 HPLC 比对试验
添加 5、10、25 和 50 μg/kg OTA 的花生、玉米和玉米粉样品分别采用ELISA和HPLC方法进行检测。


图8 ELISA与HPLC方法检测OTA含量的相关性
结果表明(图8),花生、玉米和玉米粉样品中2种检测方法的相关系数(R2)分别为0.94、0.88与0.90,表明本研究建立的ELISA方法与HPLC方法具有较高的相符性,可用于谷物中OTA批量快速筛查。
3 结论
OTA属于一种小分子半抗原,本身没有免疫原性,必须与载体蛋白大分子连接才能产生完整的免疫应答。通过活泼酯法,利用OTA上的—COOH将之与载体蛋白BSA连接,后免疫兔子获得了高效价和高特异性多克隆抗体,并在此基础上研制了OTA cd-ELISA检测试剂盒。该试剂盒IC50为1.09 ng/mL,IC15为0.08 ng/mL;与赭曲霉毒素B、C的交叉反应率分别为6.28%和0.16%,而与其他毒素未见有交叉反应;在花生、玉米及玉米粉中的检出低限分别为1.71,1.26 和1.85 μg/kg,平均回收率在 83.80%~91.40%;与HPLC检测方法具有较高的相符性;检测时间短,只需20 min;显示出较好的特异性、灵敏度、准确性、及简便快速等优点,可满足花生、玉米及玉米粉中OTA的免疫快速检测。
[1]RatolaN,Martins L,Alves A.Ochratoxin A in wines- assessing global uncertainty associated with the results[J].Analytica Chimica Acta,2004,513(1):319 -324
[2]舒黛廉,王珏.乳及乳制品中抗生素残留微生物检测法研究进展及其控制措施[J].中国畜牧兽医,2008,35(1):74-77
[3]高翔,李梅,张立实.赭曲霉毒素A的毒性研究进展[J].国外医学:卫生学分册,2005,32(1):51-55
[4]European Commission.(EC)No 1881/2006 setting maximum levels for certain contaminants in foodstuffs[s].Official Journal of the European Union,2006 -12 -20
[5]GB 2715—2005粮食卫生标准[S]
[6]Santos E A,Vargas E A.Immunoaffinity column clean - up and thin layer chromatography for determination of ochratoxin A in green coffee[J].Food Additives and Contaminants,2002,19(5):447 -458
[7]Pittet A,Royer D.Rapid,low cost thin -layer chromatographic screening method for the detection of ochratoxin A in green coffee at a control level of 10 μg/kg[J].Journal of Agricultural and Food Chmistry,2002,50(2):243 -247
[8]Meritxell V,Ivan A,Francesc B P,et al.Two - dimensional thin-layer chromatographic method for the analysis of ochratoxin A in green coffee[J].Journal of Food Protection.2005,68(9):1920-1922
[9]Tessini C,Mardones C,Baer V D,et al.Alternatives for sample pre-treatment and HPLC determination of ochratoxin A in red wine using fluorescence detection[J].Analytica Chimica Acta,2010,660(1 -2):119 -126
[10]褚庆华,郭德华,王敏,等.油料和食用油中真菌毒素快速测定方法的研究[J].中国粮油学报,2006,21(2):114 -120
[11]Vega M,Munoz K,Sepúlveda C,et al.Solid - phase extraction and HPLC determination of Ochratoxin A in cereals products on Chilean market[J].Food Control,2009,20(7):631-634
[12]Lattanzio V M T,Solfrizzo M,Powers S,et al.Simultaneous determination of aflatoxins,ochratoxin A and Fusarium toxins in maize by liquid chromatography/tandem mass spectrometry after multitoxin immunoaffinity cleanup[J].Rapid Communications in Mass Spectrometry,2007,21(20):3253 -3261
[13]Vatinno R,Vuckovic D,Zambonin C G,et al.Automated high-throughput method using solid-phase microextraction-liquid chromatography-tandem mass spectrometry for the determination of ochratoxin A in human urine[J].Journal of Chromatography A,2008,1201(2):215 -221
[14]Fujii S,Ribeiro R M R,dos Santos Scholz M B ,et al.Reliable indirect competitive ELISA used for a survey of ochratoxin A in green coffee from the North of Paraná State,Brazil[J].Food Additives and Contaminants,2006,23(9):902 -909
[15]Flajs D,Domijan A M,Ivic'B,et al.ELISA and HPLC analysis of ochratoxin A in red wines of Croatia[J].Food Control,2009,20(6):590 -592
[16]Klaric'M S,Cvetnic'Z,Pepeljnjak S,et al.Co - occurrence of aflatoxins,ochratoxin A,fumonisins,and zearalenone in cereals and feed,determined by competitive direct enzyme -linked immunosorbent assay and thin-layer chromatography[J].Archives of Industrial Hygiene and Toxicology,2009,60(4):427-434
[17]Chun H S,Choi E H,Chang H J,et al.A fluorescence polarization immunoassay for the detection of zearalenone in corn[J].Analytica Chimica Acta,2009,639(1 -2):83 -89
[18]王松雪,李爱科,谢刚,等.粮食饲料资源霉菌毒素检测技术[J].中国粮油学报,2006,21(3):415-418
[19]Märtlbauer E,Gareis M,Terplan G.Enzyme immunoassay for the macrocyclic trichothecene roridin A:production,properties,and use of rabbit antibodies[J].Applied and Environment Microbiology,1988,54(1):225 -230
[20]Xiao H,Clarke J R,Marquardt R R,et al.Improved methods for conjugating selected mycotoxins to carrier proteins and dextran for immunoassays[J].Journal of Agricultural and Food Chemistry,1995,43(8):2092 -2097
[21]王海艳,袁飞,吴亚君,等.食品中过敏原胡桃蛋白间接竞争ELISA检测方法研究[J].中国食品学报,2010,10(5):217-222
[22]Aboul-Enein H Y,Kutluk ö B,Altiokka G,et al.A modified HPLC method for the determination of ochratoxin A by fluorescence detection[J].Biomedical Chromatography,2002,16(7):470 -474
[23]王向红,刘涛,王忠斌,等.高效液相色谱法同时测定谷物中的赭曲霉毒素和玉米赤霉烯酮[J].中国食品学报,2008,8(5):148 -152.
Development of a Direct Competitive ELISA
Kit for Rapid Detection of Ochratoxin A
Li Mujie1Xi Xi1Zhang Mingzhou1,2Chen Zonglun2Wang Weifen1
(Zhejiang Provincial Key Laboratory of Bio - metrology,Inspection and Quarantine College of Life Science,China Jiliang University1,Hangzhou 310018)
(DNA Scitech Co.,Ltd.2,Hangzhou 310013)
A direct competitive enzyme-linked immunosorbent assay(cd-ELISA)kit based on ochratoxin A(OTA)polyclonal antibodies was developed.In the 0 ~10 ng/mL range,the OTA ELISA kit had a good sensitivity with an IC50of 1.09 ng/mL and IC15of 0.08 ng/mL,showed 6.28%,0.16%cross- reactivitives to ochratoxin B and C respectively,and scarcely showed cross- reactivity to others.The mean variation coefficient of intra - assay and inner-assay were 2.21%and 2.79%.The limit of detection in peanut,maize and maize flour samples were 1.71,1.26 and 1.85 μg/kg,respectively,and spiked recovery ranged from 83.80%to 91.40%.Compared with HPLC,the correlation coefficients(R2)were 0.94、0.88 and 0.90 for peanut,maize and maize flour,respectively.And the detection time of the kit is 20 minutes.It is indicated that the OTA ELISA kit in this paper was applicable to rapid preliminary screening of OTA.
ochratoxin A,polyclonal antibody,cd-ELISA
TS207.3
A
1003-0174(2012)09-0116-08
浙江省重大科技专项(2006C12102),杭州市重大科技创新专项(20083212A25),浙江省重点科技创新团队(2010R50028),浙江省科技成果转化项目(2011E 61018)
2011-12-20
李沐洁,女,1986年出生,硕士,生物化学与分子生物学
张明洲,男,1970年出生,教授,硕士生导师,食品质量与安全
