糖基化终末产物对纯化培养的视网膜神经节细胞caspase-3活性的影响
2012-11-20刘光耀吉林大学第二医院眼科吉林长春3004
金 燕 刘光耀 (吉林大学第二医院眼科,吉林 长春 3004)
糖尿病视网膜病变(DR)包括糖尿病视网膜微血管病变和视网膜神经病变。研究表明,糖尿病早期未出现微血管病变之前即出现视网膜的神经病变〔1,2〕。慢性高血糖导致的糖基化终末产物(AGEs)的堆积是促进DR发生及发展的重要机制〔3〕。本研究体外建立纯化的视网膜神经节细胞(RGCs)培养体系,观察AGEs对纯化培养的RGCs细胞半胱氨酸蛋白酶caspase-3活性的影响,探讨糖尿病时RGCs的损伤机制。
1 材料与方法
1.1 实验动物 选择出生3 d的Wistar乳鼠用于实验。
1.2 材料 Neurobasal培养基、B27(美国,Gibco),脑源性神经营养因子、睫状神经营养因子、碱性成纤维生长因子、层黏连蛋白、多聚鸟氨酸、抗-鼠巨噬细胞抗体(美国,Chemicon)、抗鼠Thy1.1单克隆抗体。
1.3 AGEs及其对照物的制备和检测 牛血清白蛋白(BSA)50 g/L、D-葡萄糖 0.5 mol/L、磷酸缓冲 液 (PBS,pH7.4)0.01 mol/L,1.5 mmol/L的苯甲基磺酰氟化物和0.5 mmol/L的乙二胺四乙酸,0.22 μm滤膜过滤除菌,37℃孵化42 d。对照液除不含D-葡萄糖外,其他物质浓度及配置方法同上。所有AGEs孵化结束后,采用PBS广泛透析法将未结合的葡萄糖除去,调整葡萄糖浓度至5.5 mmol/L(pH7.2),4℃冰箱储存备用,AGEs的浓度用Bradford法测定。AGEs-BSA对照物的制备除不加葡萄糖外,其他材料及方法同前。
1.4 RGCs纯化培养及鉴定 无菌条件下将乳鼠断头处死,解剖显微镜下钝性分离视网膜,制备RGCs悬液。抗鼠巨噬细胞抗体(1∶100,PBS稀释)包被培养瓶,室温孵育 2 h,4℃过夜,PBS轻洗3次。抗鼠Thy1.1单克隆抗体(1∶300,PBS稀释)包被塑料培养管,室温孵育2 h,4℃过夜,PBS轻洗3次。在包被抗鼠巨噬细胞抗体的培养瓶内加入 RGCs悬液,37℃孵育30 min,吸取未黏附的细胞悬液,置于包被抗鼠Thy1.1单克隆抗体的塑料培养管中,37℃孵育30 min,收集黏附于管壁的RGCs,计数后进行培养。内置盖玻片的24孔培养板,预先用多聚鸟氨酸室温包被,加入含B27的Neurobasal培养液,于37℃,5%CO2的培养箱内培养。培养12 h后,去除培养液,PBS冲洗,4%多聚甲醛固定,用ABC法进行Thy1.1抗体免疫组化鉴定。培养细胞用1 mol/L calcein-AM(Molecular Probes,Eugene,OR)染色,激光共聚焦显微镜对荧光染色的细胞照相。
1.5 细胞存活率检测 采用Live/Dead Cell Viability Kit检测培养体系中RGCs存活率,检测活细胞数/总细胞数的百分比。
1.6 原位末端脱氧核糖核苷酸转移酶标记技术(TUNEL法)检测凋亡细胞 分别在实验组、对照组加入AGEs及其对照250 μg/ml,24 h后4%多聚甲醛固定,按试剂盒说明标记细胞凋亡,显微镜下观察8个高倍视野的阳性细胞数,将阳性细胞数占对照组总细胞数的百分比作为检测指标。
1.7 caspase-3活性检测 培养结束后,各组细胞600 r/min离心5 min,收集细胞弃上清,冰浴裂解后4℃ 16 000 r/min 4℃离心15 min,把上清转移至预冷的离心管中,-70℃保存备用;实验设空白对照孔和待测样品孔,均加入含荧光底物Ac-DEVD-AMC的caspase-3反应缓冲液45 ml/孔;空白孔加5 ml/孔正常细胞裂解液(含 cocktail),待测样品孔加10 mg/孔(5 ml)细胞总蛋白,总量50 ml/孔。加入样品后立即使用Polarstar荧光分光光度计检测AMC释放量。
2 结果
2.1 RGCs的培养 纯化的RGCs培养3 h后开始贴壁,24 h后细胞开始伸出小的突起,72 h后突起增多并伸长,培养1 w后存活的RGCs数量开始减少。24 h后,培养体系中细胞存活率为(93.2±7.52)%。AGEs作用下培养24 h的RGCs存活率为(58.17±6.23)%。较对照组细胞存活率明显降低(P<0.05)。见图1。
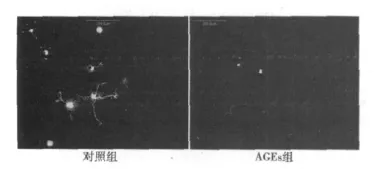
图1 两组培养24 h的RGCs(calcein-AM染色,×200)
2.2 细胞凋亡的检测 AGEs作用24 h后,(29.2±3.5)%的RGCs发生凋亡,而正常对照组有(4.8±1.3)%的细胞凋亡,两者比较有显著性差异(P<0.05)。
2.3 caspase-3活性检测 AGEs作用下不同时间RGCs细胞caspase-3活性为,0 h:0.97 ± 0.03,8 h:4.12 ± 0.87,16 h:8.65±1.87,24 h:12.31±2.23。较正常对照组 caspase-3 活性明显增强(P<0.05)。
3 讨论
RGCs的纯化培养是本研究的关键步骤。RGCs的体外培养主要分为纯化培养和混合培养,混合培养的RGCs存活率高,但混有其他视网膜神经细胞及神经胶质细胞等,影响对RGCs特性的分析。Immuno-panning方法是目前国际上认可的建立RGCs纯化培养体系的可靠方法,采用免疫学方法将纯化RGCs分离出来。用无血清的神经基质培养基进行培养,能避免血清中的多种不明成分影响实验结果的观察。采用的培养基添加了B27等神经生长因子,B27可以降低培养过程中的氧化损伤,利于细胞生长。利用此方法能得到高纯度、活力好的RGCs〔4〕。Calcein-AM是一种绿色荧光细胞标记物,仅使存活的细胞染色,而死细胞则不染色。本实验结果显示建立的纯化培养RGCs体系是研究RGCs凋亡机制及神经保护有效手段。
经典的理论认为DR主要是微血管病变,近年来越来越多的研究发现,糖尿病早期视网膜神经元的功能及稳定性发生变化并参与视网膜病变的病理发展过程,且神经病变的发生早于器质性血管病变〔1〕。研究显示,在未出现视网膜微血管病理改变之前,就可见视网膜神经的损伤,继而出现视网膜功能改变,相干光断层扫描检查发现视网膜神经纤维层明显变薄〔2,5,6〕。动物实验证实早期糖尿病时,RGCs发生凋亡〔7〕。糖尿病时,慢性高血糖引起体内糖基化蛋白过量沉积形成AGEs。研究表明,AGEs的形成和沉积是糖尿病视网膜病变的重要发病机制。AGEs通过两种方式发挥作用:非受体途径即直接损伤和受体途径,目前认为受体途径是主要的。AGEs在局部沉积,通过与其受体结合激活多个信号转导通路,导致多种细胞因子与生长因子的合成与释放,使视网膜中氧自由基生成增加,促使DR的发生〔3〕。本研究结果证实 AGEs能体外诱导 RGCs发生凋亡。
caspase-3在凋亡所需的蛋白水解中起着直接作用,其水解底物多为细胞中的功能蛋白质。研究表明,AGEs诱生剂glyoxal作用于具有视网膜神经元表型的视网膜细胞系E1A-NR3,使细胞线粒体膜电位降低,caspase-3表达增加。AGEs诱生剂glyoxal作用于大鼠的视网膜组织培养物,组织块中bax及活化的 caspase-3 表达增加,视网膜各层凋亡细胞增加〔8,9〕,表明caspase-3参与了AGEs诱生剂glyoxal诱导的视网膜神经细胞的凋亡。本研究显示,在AGEs作用下,体外纯化培养的RGCs发生凋亡,细胞caspase-3活性增加,提示AGEs可能通过增强细胞caspase-3活性诱导RGCs发生凋亡,造成RGCs损伤。在本研究基础上,进一步观察 caspase抑制剂对AGEs诱导的RGCs凋亡的影响,旨在抑制凋亡过程,为糖尿病时RGCs损伤提供神经保护。
1 Barber AJ.A new view of diabetic retinopathy:a neurodegenerative disease of the eye〔J〕.Prog Neuropsychopharmacol Biol Psychiatry,2003;27(2):283-90.
2 Fletcher EL,Phipps JA,Ward MM,et al.Neuronal and glial cell abnormality as predictors of progression of diabetic retinopathy〔J〕.Curr Pharm Des,2007;13(8):2699-712.
3 Park JW,Park SJ,Park SH,et al.Up-regulate expression of neuronal nitric oxide synthase in experimental diabetic retina〔J〕.Neurobiol Dis,2006;21(1):43-9.
4 Otori Y,Kusaka S,Kawasaki A,et al.Protective effect of nilvadipine against glutamate neurotoxicity in purified retinal ganglion cells〔J〕.Brain Res,2003;961(2):213-9.
5 Neckell A.Adaptometry in diabetic patients〔J〕.Ophthalmologia,2007;51(1):95-7.
6 Huang TN,Zhang MN.Multifocal electroretinogram in patients with subclinical diabetic Retinopathy〔J〕.Int J Ophthalmol,2006;6(5):664-6.
7 Martin PM,Roon P,Van Ells TK,et al.Death of retinal neurons in streptozotocin-induced diabetic mice〔J〕.Invest Ophthalmol Vis Sci,2004;45(9):3330-6.
8 Reber F,Kasper M,Siegner A,et al.Alteration of the intracellular pH and apoptosis induction in a retinal cell line by the AGE-inducing agent glyoxal〔J〕.Graefes Arch Clin Exp Ophthalmol,2002;240(12):1022-32.
9 Reber F,Geffarth R,Kasper M,et al.Graded sensitiveness of the various retinal neuron populations on the glyoxal-mediated formation of advanced glycation end products and ways of protection〔J〕.Graefes Arch Clin Exp Ophthalmol,2003;241(3):213-25.
