小鼠皮肤烫伤模型的建立
2012-11-18官大威马文翔张书韬
任 鹏,官大威,赵 锐,马文翔,2,张书韬,3
(1.中国医科大学法医学院法医病理学教研室,辽宁 沈阳 110001;2.大连市中级人民法院,辽宁 大连116012;3.黑龙江省公安厅刑事技术总队,黑龙江 哈尔滨 150008)
小鼠皮肤烫伤模型的建立
任 鹏1,官大威1,赵 锐1,马文翔1,2,张书韬1,3
(1.中国医科大学法医学院法医病理学教研室,辽宁 沈阳 110001;2.大连市中级人民法院,辽宁 大连116012;3.黑龙江省公安厅刑事技术总队,黑龙江 哈尔滨 150008)
目的 建立用于热损伤研究的小鼠皮肤烫伤动物模型。 方法 小鼠麻醉后,使用沸水在其背部烫出直径1cm的圆形烫伤区,沸水接触时间分别为10s和25s。烫伤后1、3、5、7和10d处死动物。对不同损伤时间点皮肤取材,进行肉眼和组织学检查。 结果 10s烫伤组,烫伤累及全层皮肤,程度为深Ⅱ°;25s烫伤组烫伤累及全层皮肤及背部肌肉,程度为Ⅲ°。 结论 该模型采用简单的方法成功制作出较为稳定的皮肤烫伤模型,为以后的皮肤热损伤研究奠定了一定的基础。
法医病理学;模型,动物;皮肤;烫伤;小鼠
皮肤烫伤是一种常见的损伤,是临床医学及法医学实践中经常遇到的一类损伤,也是病理学研究的一个重要课题。既往大多数研究往往没有明确阐述烫伤模型的具体制作过程,烫伤面积和深度也难以稳定控制,方法复杂繁琐,操作性和重复性较差。为了更好地对皮肤烫伤进行研究,建立一个稳定、简便、重复性良好且经济的烫伤模型成为研究中的必要步骤。本研究克服既往烫伤模型的一些不足,以建立一种皮肤烫伤模型制作方法,使烫伤面积和烫伤深度标准化,并且对其病理改变做出描述,为临床医学和法医学研究烫伤提供资料。
1 材料与方法
1.1 实验动物及分组
昆明小白鼠55只,雌雄不限,体质量35~45g,由中国医科大学实验动物中心提供,清洁级饲养。将小鼠按烫伤时间分为10s烫伤组、25s烫伤组和正常对照组,每个烫伤组25只,正常对照组5只。各烫伤组再按烫伤后观察时间分为1、3、5、7、10 d 5个亚组,每组5只小鼠。
1.2 模型制作及取材处理
将小鼠背部皮肤剪毛,尽量剪除但不要伤及皮肤,用戊巴比妥钠(50mg/kg)腹腔麻醉后,将小鼠置于俯卧位,四肢伸展,用胶带将其四肢固定在操作板上,使背部皮肤较平坦。室温(20~24℃)下,将带有刻度的两端无堵头、内直径1 cm的中空塑料管直立于小鼠背部,其一端与小鼠备皮处皮肤紧密接触(接触压力保证水不流出且不对皮肤造成损伤),另一端用预热后的注射器快速向塑料管内注入沸水(97~100℃)至2 mL刻度线处,沸水与皮肤持续接触10 s(经检测,水温基本无变化)或25s(经检测,水温下降1℃左右)后,迅速将操作板及小鼠连同中空管翻转,将热水从塑料管上口倒出。烫伤区域为圆形,直径1cm。伤后小鼠分笼饲养并给予饲料及蒸馏水,保证垫料干燥清洁,通风良好,不给予小鼠任何处理。对照组小鼠背部皮肤剪毛后,操作步骤同实验组,用室温蒸馏水代替沸水。
实验组动物在烫伤后按预先设定时间乙醚麻醉处死,取背部烫伤区及周边区1.5 cm×1.5 cm大小皮肤,用4%多聚甲醛中性液固定8 h后,常规脱水、透明、浸蜡、包埋,制作5μm石蜡切片,进行HE染色。
1.3 烫伤程度标准
采用人体烧伤深度标准对小鼠皮肤烫伤深度进行分类[1]。
2 结 果
2.1 皮肤烫伤区肉眼所见
烫伤后立即观察,烫伤组动物烫伤区皮肤表面完好,皮肤呈淡棕黄色,无红斑、水泡形成。
10s烫伤组:烫伤后1d烫伤区表面干燥,内面观明显圆形暗红色烫伤区,水肿明显;3d烫伤区表面干燥,烫伤区与周边皮肤界限明显,内面观水肿消失;5d烫伤区表面干燥、淡棕色,烫伤区与周边皮肤界限明显;7 d烫伤区明显缩小,痂皮形成;10 d烫伤区痂皮周边翘起,烫伤区域进一步缩小。
25s烫伤组:烫伤后1d烫伤区皮肤表面干燥,内面观皮肤明显水肿,其对应背部肌肉充血、水肿;3 d烫伤区表面干燥,水肿消失,烫伤区与周边皮肤界限明显,皮肤内面与背部肌肉粘连;5d烫伤区表面干燥,烫伤区与周边皮肤界限明显,皮肤内面与背部肌肉仍粘连;7d烫伤区表面干燥、淡棕色,烫伤区与周边皮肤界限明显,皮肤内面与背部肌肉粘连明显;10 d烫伤区明显缩小,痂皮形成,皮肤内面与背部肌肉粘连明显。
2.2 组织学所见
2.2.1 对照组
皮肤全层完好,角质层存在,棘细胞层结构清晰,上皮脚和真皮乳头交错,真皮内胶原纤维排列整齐,皮肌层排列整齐,可见肌横纹,毛囊及皮脂腺结构清晰。
2.2.2 10s烫伤组
烫伤后1d表皮全层坏死,烫伤区可见坏死物附着,毛囊等皮肤附属器坏死,真皮层胶原纤维排列紊乱,血管扩张、淤血,皮肌层肌纤维横纹消失,细胞崩解坏死,真皮层空泡形成,大量多形核粒细胞浸润,少量单个核细胞出现;烫伤交界区真皮层可见大量多形核粒细胞和少量单个核细胞浸润(图1A)。
烫伤后3d烫伤区表皮均质变明显,炎症细胞减少;烫伤交界区棘细胞增生并向痂皮下延伸,仍存在大量多形核粒细胞,单个核细胞较1 d时明显增多,开始出现梭形成纤维细胞。
烫伤后5 d烫伤区表皮均质变增厚,皮肤结构分辨不清;烫伤交界区多形核粒细胞减少,单个核细胞和梭形成纤维细胞增多;棘细胞层增厚,肉芽组织形成,其内见新生毛细血管和梭形成纤维细胞;真皮层内可见新生肌细胞(图1B)。
烫伤后7d烫伤区表皮均质变开始变薄,烫伤交界区肉芽组织内见较多新生毛细血管和梭形成纤维细胞,单个核细胞略减少。
烫伤后10 d烫伤区表皮均质变进一步变薄,棘细胞层增厚明显,创面下充满肉芽组织,其内见大量新生毛细血管和梭形成纤维细胞(图1C)。
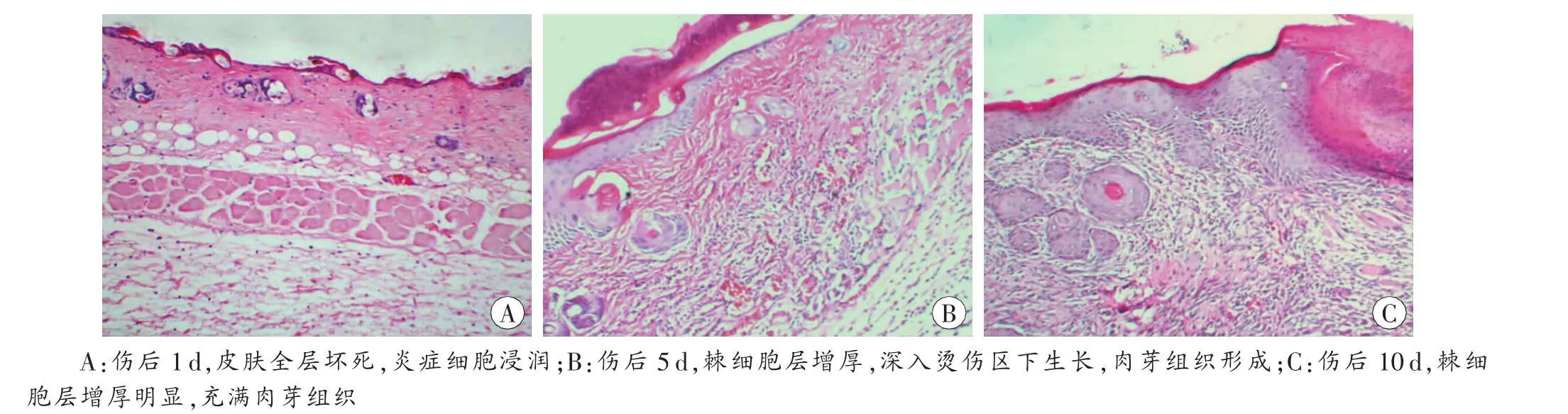
图1 10s烫伤组组织病理学结果 HE×100
通过对烫伤后1 d烫伤区的组织病理学检验可知,烫伤累及皮肤全层,按照人体烧伤深度标准符合深Ⅱ°烧伤[1]。以上各时间点烫伤区表皮均质变有时间变化规律,5d时达到最厚。1、3和5d时炎症细胞在未烫伤区浸润程度明显多于烫伤区。
2.2.3 25s烫伤组
烫伤后1d(图2A)和3d时与10s烫伤组的1d和3d时镜下所见相似;5d时肉芽组织不明显(图2B);7d时烫伤区表皮均质变未见变薄,肉芽组织形成,其内见梭形成纤维细胞、新生毛细血管;10 d时烫伤区均质变略变薄,肉芽组织形成明显(图2C)。
烫伤区表皮均质变7d达最厚。1、3和5d时炎症细胞在未烫伤区浸润程度也明显多于烫伤区。
通过对烫伤后1 d烫伤区的宏观及组织病理学检验可知,皮肤损害除累及皮肤全层外,还累及背部肌肉,按照人体烧伤分度标准可以认为是Ⅲ°烧伤[1]。25s烫伤组肉芽组织生成较10s烫伤组晚,皮肤愈合速度较缓慢。
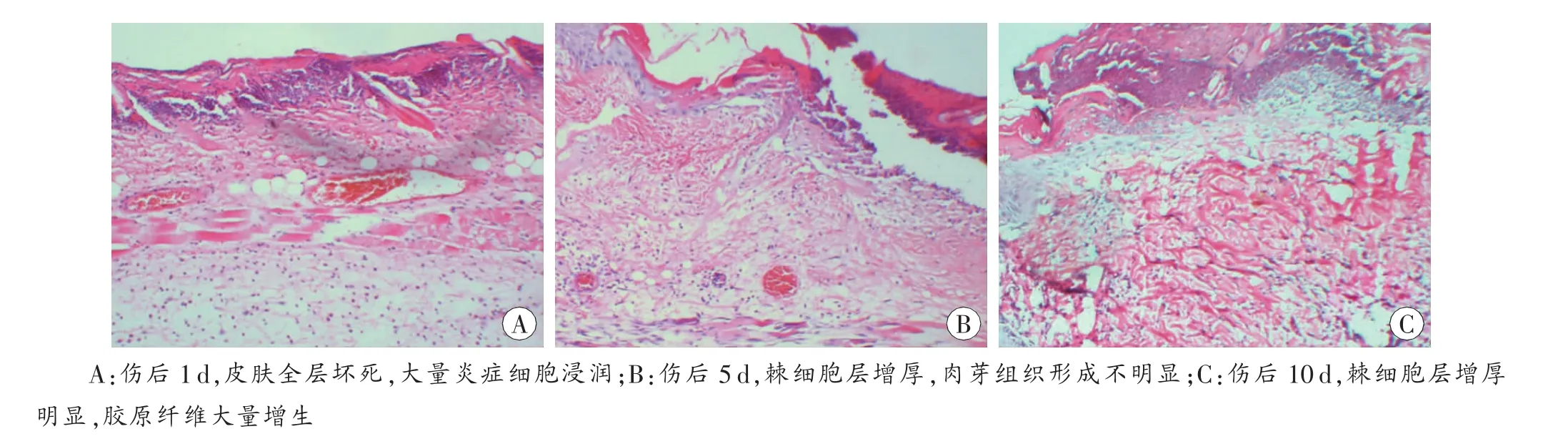
图2 25s烫伤组组织病理学结果 HE×100
3 讨 论
既往研究曾经使用混合固体燃料或酒精涂抹皮肤点燃烧伤建立烫伤动物模型[2-3],或使用预热的金属进行烫伤[4]。采用固体燃料和酒精的方法,能够建立出Ⅲ°烧伤的模型,但燃料烧灼皮肤的温度不恒定且无法测量;燃料使用量直接影响烫伤时间的长短,如果燃料用量较少,其烧伤的时间无法达到预定的时间;若使用酒精等液体燃料,不仅温度不恒定并无法测量,而且酒精等液体燃料容易在皮肤表面弥散,不易控制烧伤面积的大小。金属预热的方法可以有效地控制烫伤面积和时间,但其接触皮肤的压力往往是比较难以控制的,并且金属散热较快,烫伤温度不易控制,这些缺点也是很明显的。本研究采用沸水作为烫伤物质[5]建立了一个损伤程度稳定的小鼠皮肤烫伤模型。在复制皮肤烫伤模型过程中,需要考虑烫伤温度的恒定,烫伤面积的大小,烫伤时间的长短,使用何种物质进行烫伤,烫伤物与皮肤接触的压力等因素。本研究建立的烫伤模型,利用沸腾的蒸馏水控制烫伤时的温度,秒表控制烫伤的时间,自制的中空塑料管内径控制一致的烫伤面积,注入中空塑料管热水的高度控制一致的接触压力。本模型制作需要在温度(20~24℃)较为恒定的实验室进行,随着烫伤时间的延长,热水的温度会略有降低,烫伤时间在一定程度上也对温度有影响,本研究中热水在烫伤10s后温度基本无变化,烫伤25s后温度仅下降1℃左右,温度基本恒定。烫伤面积为直径1cm的圆形区域,经计算,烫伤面积为(1/2)2π cm2,沸水柱与皮肤接触压力为0.02 N,压强为800/π帕。
在脱毛过程中,为了避免损伤毛囊等附属器和表皮结构的完整性,不采用化学脱毛剂脱毛或刀片刮除毛发,使用小剪刀尽量剪短小鼠背部毛发。经过肉眼观察,25 s烫伤组损伤累及背部皮下肌肉,10 s烫伤组损伤未累及背部肌肉。对两组皮肤取材,以烫伤后1d的组织病理学改变为评价烫伤程度的标准[6],可见皮肤全层均坏死,如图1A和图2A。人体皮肤烫伤后往往出现红斑、水泡,而本研究中,烫伤后并未见到皮肤红斑、水泡出现,可能是由于小鼠皮肤与人体皮肤结构之间的种属差异所致,但并不影响烫伤程度的判断。结合肉眼和镜下所见,按照人体烧伤深度标准,10s烫伤组全层皮肤损伤可以认定为深Ⅱ°烧伤;25s烫伤组全层皮肤损伤并累及背部肌肉,可以认定为Ⅲ°烧伤。25s烫伤组的皮肤损伤程度明显重于10 s烫伤组,且皮肤愈合速度较缓慢。经过多次反复试验,采用该方法建立的皮肤烫伤模型的损伤程度稳定,重复性好,操作简便,可以复制出深Ⅱ°和Ⅲ°两种程度的烫伤,为进一步研究在体皮肤烫伤的形态学变化及远期修复奠定了基础。
[1]吴在德,吴肇汉.外科学[M].第7版.北京:人民卫生出版社,2008.
[2]褚锋,刘建国,唐帆,等.小鼠Ⅲ度烧伤模型的复制及皮肤病理形态改变的动态观察[J].中国实验动物学报,2009,17(3):213-215.
[3]侯敏娜,平大地.混合燃料建立大鼠火焰烧伤模型的实验研究[J].云南中医中药杂志,2010,31(8):67-68.
[4]Singer AJ,McClain SA,Romanov A,et al.Curcumin reduces burn progression in rats[J].Acad Emerg Med,2007,14(12):1125-1129.
[5]Lee JA,Jeong HJ,Park HJ,et al.Acupuncture accelerates wound healing in burn-injured mice[J].Burns,2011,37(1):117-125.
[6]刘毅,薛晓东,贾赤字,等.恒温恒压电烫仪建立小鼠烫伤模型的实验研究[J].兰州医学院学报,2001,27(1):6-8.
2011-09-28)
(本文编辑:张建华)
Establishment of Skin Scald Model in Mice
REN Peng1,GUAN Da-wei1,ZHAO Rui1,MA Wen-xiang1,2,ZHANG Shu-tao1,3
(1.Department of Forensic Pathology,School of Forensic Medicine,China Medical University,Shenyang 110001,China;2.Dalian Intermediate People’s Court,Dalian 116012,China;3.Criminal Technology Agency of Heilongjiang Public Security Bureau,Harbin 150008,China)
Objective To establish the model of skin scald in mice for the study of skin thermal injuries. Methods After anaesthetization mice were scalded in a 1 cm-diameter circle area on the central dorsum by boiling water at contact times:10s or 25s.The mice were sacrificed at 1,3,5,7 and 10 days after scald.The skin samples were collected and analyzed by gross and histopathological examinations.Results DeepⅡ degree thermal injury involving full-thickness skin was observed in the 10s scald group.Ⅲ degree thermal injury involving full-thickness skin and the dorsal skeletal muscle was observed in the 25 s scald group.Conclusion A mouse skin scald model is established which is stable and can be used on the skin thermal injury in future research.
forensic pathology;models,animal;skin;scald;mice
DF795.1
A
10.3969/j.issn.1004-5619.2012.02.004
1004-5619(2012)02-0092-03
任鹏(1985—),男,辽宁锦州人,硕士研究生,主要从事皮肤损伤愈合机制的研究;E-mail:jqkahi@163.com
官大威,男,博士,教授,博士研究生导师,主要从事法医病理学教学、科研及鉴定工作;E-mail:dwguan@mail.cmu. edu.cn
