肠道病毒71型在脑干脑炎婴幼儿脑干中的分布及感染机制
2012-11-18汤大为王小广刘水平孔小平黄京璐毕启明
郝 博,高 迪,汤大为,王小广,刘水平,孔小平,刘 超,黄京璐,毕启明,权 力,罗 斌
(1.中山大学中山医学院法医学系,广东 广州 510080;2.广州市公安局番禺区分局,广东 广州 511400;3.广州市公安局刑事科学技术研究所,广东 广州 510030)
肠道病毒71型在脑干脑炎婴幼儿脑干中的分布及感染机制
郝 博1,高 迪1,汤大为1,王小广1,刘水平1,孔小平2,刘 超3,黄京璐1,毕启明1,权 力1,罗 斌1
(1.中山大学中山医学院法医学系,广东 广州 510080;2.广州市公安局番禺区分局,广东 广州 511400;3.广州市公安局刑事科学技术研究所,广东 广州 510030)
目的 观察人肠道病毒71型(enterovirus 71,EV71)以及细胞间黏附分子1(intercellular adhesion molecules-1,ICAM-1)在脑干脑炎死亡的婴幼儿脑干中的表达及分布特点,探讨EV71进入中枢神经系统的机制以及ICAM-1的参与作用。 方法 收集22例尸检确认为脑干脑炎婴幼儿的脑干组织为实验组,并以10例先天性心脏病死亡婴幼儿的脑干组织作为对照组。选择实验组中镜下小血管呈典型的“袖套样”改变的切片进行EV71-VP1免疫组织化学染色,然后对EV71-VP1阳性的切片进行ICAM-1免疫组织化学染色。染色结果经图像分析和统计学处理,比较实验组和对照组的染色结果。 结果 (1)实验组EV71-VP1免疫组织化学阳性染色呈深棕黄色,主要位于脑干星形胶质细胞内,对照组染色呈阴性。(2)ICAM-1阳性呈深棕黄色,在脑干血管周围炎症细胞、胶质小结内的炎症细胞及胶质细胞表达升高,与对照组比较差异具有统计学意义 (P<0.05)。 结论 EV71可作为脑干脑炎致死婴幼儿法医病理诊断的筛选依据。EV71可能通过血源性侵染脑干,ICAM-1可能在脑干炎症改变过程中起重要作用。
法医病理学;手足口病;肠道病毒属;细胞间黏附分子1
肠道病毒71型(enterovirus 71,EV71)是引起婴幼儿手足口病(hand,foot and mouth disease,HFMD)主要病原体之一。5岁以下儿童易感HFMD,多数病例预后较好,少部分病例后果严重,如无菌性脑膜炎、脑干脑炎、脑脊髓炎、心肌炎、急性迟缓性麻痹、神经源性肺水肿等,可在短时间内导致死亡。本研究以疑似EV71致死的婴幼儿脑干组织为研究对象,通过EV71-VP1多克隆抗体特异性结合EV71衣壳蛋白VP1区检测EV71在脑干中的分布,并通过细胞间黏附分子1(intercellular adhesion molecules-1,ICAM-1)多克隆抗体检测ICAM-1在脑干中的表达,旨在探讨EV71侵入中枢神经系统的机制以及ICAM-1在此机制中的作用,以期为此类案件的法医学鉴定提供帮助。
1 材料与方法
1.1 实验对象
收集2006—2010年中山大学法医鉴定中心诊断为脑干脑炎死亡的婴幼儿脑干组织蜡块22例为实验组,其中临床EV71病毒检测确诊为HFMD 4例;以10例先天性心脏病死亡婴幼儿的脑干组织蜡块作为对照组。所有婴幼儿尸体均为低温保存1~3d后进行的解剖检验,提取的脑干(包括中脑、脑桥、延髓)组织经置10%甲醛溶液中固定72h后,制成蜡块保存。取组织蜡块重新制作常规切片后进行HE和免疫组织化学染色。
1.2 病例资料
实验组均有完整的病历资料,多以发热,胃肠道不适,体表、口腔及咽峡部炎性疱疹为主要首发症状(1例在治疗过程中四肢出现疱疹),发病季节以春、夏季为主,发热呈不规则热,36.4~40℃,病程1~6 d。除发热外,部分病例伴有咳嗽、气促、抽搐、呕吐、腹泻等症状,部分病例无特殊临床症状。大部分婴幼儿被诊断为“上感”、“婴幼儿肺炎”、“婴幼儿腹泻”,经“抗感染、对症治疗”病情仍恶化,短时间内死亡;小部分婴幼儿诊断为“手足口病”,且采用规范抗病毒治疗,仍短时间死亡。
尸体解剖见双手指甲床发绀,体表皮肤可见疱疹,脑组织轻度水肿。镜下除3例外病理改变基本一致,脑膜、脑内血管扩张充血,脑组织疏松,神经细胞及血管周隙增宽,脑实质未见出血、坏死及炎症细胞浸润,脑神经元无明显坏死表现。部分脑实质内见胶质细胞增生,形成胶质小结,脑干大部分小血管周围见较多炎症细胞呈“袖套样”浸润。19例于尸体解剖时曾抽右心室血送中山大学附属第一医院检验科进行IgE浓度检测(ELISA法),其中8例IgE检测结果升高,为127.00~932.00IU/mL(正常参考值0~120IU/mL)。
1.3 试剂
兔抗人EV71-VP1多克隆抗体(0.2 mL)购自北京博奥森生物技术有限公司,兔ICAM-1多克隆抗体(0.2mL)、生物素化的羊抗兔IgG抗体、即用型SABC免疫组织化学试剂盒、DAB显色试剂购自武汉博士德生物工程有限公司。
1.4 HE染色
取实验组和对照组切片经HE染色后显微镜下观察,选出实验组中镜下小血管呈典型“袖套样”改变的脑干组织(中脑、脑桥、延髓)切片,供免疫组织化学染色。
1.5 免疫组织化学染色
将对照组切片和经HE染色后选出的实验组切片经3%甲醇-过氧化氢溶液去除内源性过氧化物酶,室温静置10min;PBS溶液洗片3次,每次5min;参照SABC使用说明,以EDTA溶液(pH=6.0)行高压热修复法修复抗原10 min;PBS溶液洗片3次,每次5min,滴加正常山羊血清,室温保湿孵育20min;实验组及对照组分别滴加1∶50稀释的EV71-VP1抗体。随机另取实验组中4个案例的切片以PBS溶液代替一抗作为空白对照组,4℃保湿孵育过夜;37℃复温45 min,滴加生物素标记的羊抗兔抗体,室温保湿孵育20 min;PBS溶液洗片3次,每次5 min,滴加DAB显色溶液,显微镜下观察显色结果(约2min);终止反应后以苏木素复染1min,1%盐酸-乙醇分化,自来水中返蓝30min;烤箱中56℃烘干10min,二甲苯透明,中性树胶封片。
EV71-VP1免疫组织化学阳性者按照上述步骤进行ICAM-1(CD54)多克隆抗体免疫组织化学染色、观察、统计。
1.6 结果判定及统计学处理
EV71-VP1抗体及ICAM-1抗体免疫组织化学染色阳性均呈深棕黄色颗粒状。随机选取每张切片中5个呈“袖套样”改变的小血管视野(×100),使用Image-Pro Plus 6.0软件测定小血管周围EV71-VP1抗体阳性细胞数及“袖套样”分布炎症细胞阳性反应物的平均光密度值,数据均用±s表示。采用SPSS 16.0软件,以t检验进行统计学分析。检验水准α=0.05。
2 结 果
2.1 HE染色
实验组小血管周围炎症细胞呈典型的“袖套样”分布,对照组未见该形态。
2.2 免疫组织化学染色结果
2.2.1 EV71-VP1免疫组织化学染色
对照组未见EV71-VP1抗体阳性反应细胞(图1A)。
实验组中有19例EV71-VP1抗体免疫组织化学染色阳性,判断为EV71感染阳性;另外3例未见阳性染色,判断为其他病毒感染的脑干脑炎。EV71-VP1阳性者阳性细胞数明显高于对照组及EV71-VP1阴性者(表1)。其中EV71-VP1抗体阳性反应表现为星形胶质细胞胞浆、胞核内出现棕黄色颗粒,“袖套样”改变小血管周围胶质细胞胞浆、胞核内有少量表达,而神经元中EV71-VP1阳性表达较星形胶质细胞弱(图1B);胶质小结中部分细胞呈阳性染色(图1C),数量相对于血管周围脑实质无明显增多。

图1 EV71-VP1免疫组织化学染色结果
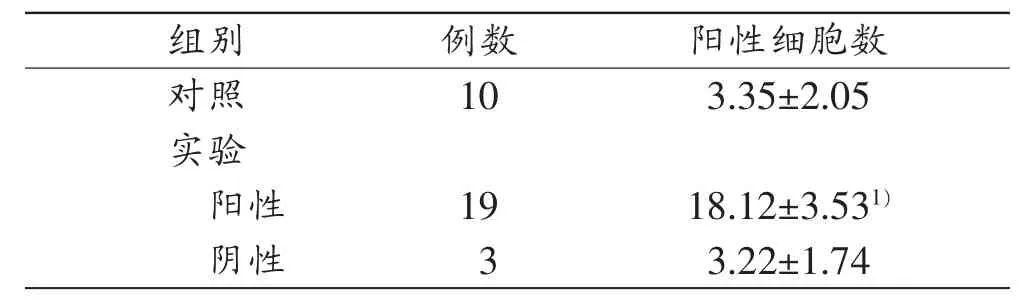
表1 各组EV71-VP1免疫组织化学染色阳性细胞数统计
2.2.2 ICAM-1免疫组织化学染色结果
对照组未见典型ICAM-1阳性反应细胞(图2A)。
实验组19例EV71-VP1抗体免疫组织化学染色阳性者,小血管内皮细胞胞浆、小血管周围炎症细胞胞浆、血管周围脑组织胶质细胞胞浆可见ICAM-1阳性表达(图2B~D)。对照组、实验组所测得的平均光密度,经比较差异有统计学意义(表2)。
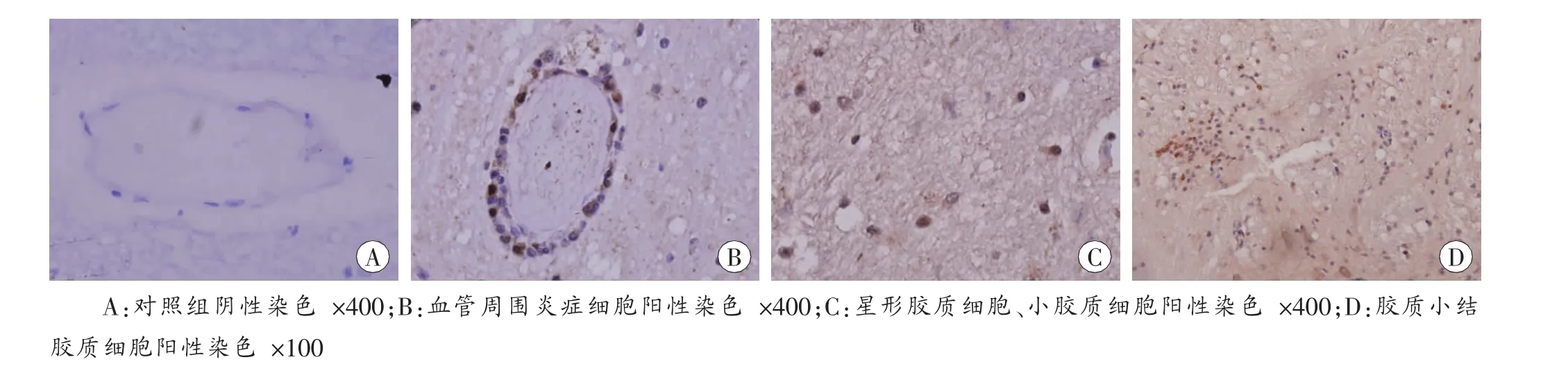
图2 ICAM-1免疫组织化学结果
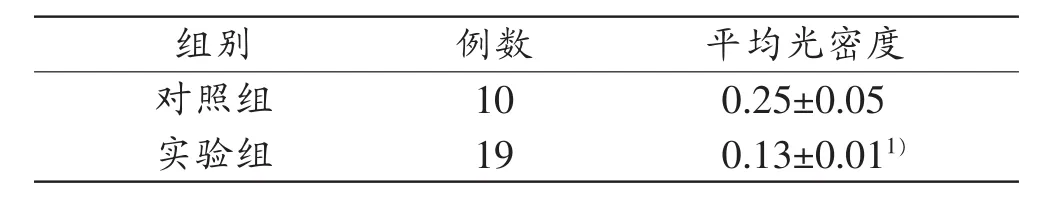
表2 对照组、实验组(EV71-VP1抗体阳性者)ICAM-1免疫组织化学染色结果
3 讨 论
EV71属于小核糖核酸病毒科肠道病毒属中人类A型肠道病毒的一种,基因组为单股正链RNA,长度约为7 400个核苷酸,仅含有一个开放读码框,编码的多聚蛋白约含2190个氨基酸。该多聚蛋白可进一步水解成P1、P2和P3前体蛋白,P1前体蛋白编码VP1、VP2、VP3和VP4结构蛋白,P2和P3编码7个非结构蛋白(2A~2C和3A~3D)。4种结构蛋白中除VP4包埋在病毒衣壳的内侧与核心紧密连接外,其他3种结构蛋白均暴露在病毒颗粒的表面,因而抗原决定簇基本上位于VP1~VP3上。EV71最早在加利福尼亚州有中枢神经系统症状的婴儿粪便中分离出,为HFMD最常见病原体之一,感染性强,致病率高,目前尚无针对性的治疗方法[1]。HFMD案例1980年在中国首次报道,此后每年都有一定数量案例报道[2]。2008年中国HFMD爆发,发病人数超过176000,至少40人死亡[3]。据广东省疾病控制中心统计数据,2009年仅广东省发病人数就有92749[2]。2008—2009年国家传染病信息管理系统统计数据显示HFMD轻度症状者EV71实验室检查阳性率为52.6%,重度症状者为83.5%,致死者为96.1%[4]。对于EV71致HFMD的发病及死亡机制,通过尸体解剖、动物模型研究,学者们推测EV71可能通过血源性、神经源性或其他途径感染中枢神经系统[5-6]。
致死案例病理学观察见中枢神经系统出现以炎性改变为主的损害[6-8]。EV71所致脑炎为典型的病毒性脑炎病理改变,中枢神经系统的损害形式固定,表现为脑组织小血管周围炎症细胞“袖套样”聚集、脑实质细胞间隙增宽、噬神经现象,部分脑实质内胶质小结形成,脑干部位较多受累[3,5,7]。Hsueh等[9]研究表明EV71单克隆抗体免疫荧光主要分布在细胞质及细胞核,但对于EV71主要侵袭的部位、侵袭的细胞类型未作说明。其他动物模型虽然可以模拟出EV71所致的临床、病理学表现,但对于病毒分布也未作明确说明[5-6]。Wong等[5]采用免疫组织化学、原位杂交技术研究7例EV71致死案例,发现EV71主要位于脑干、脊髓前角炎症明显区域的神经元及周围的炎症细胞,而非神经元细胞未见明显表达,从而推测EV71致病机制可能是通过外周神经逆向感染中枢神经途径。本研究中EV71-VP1多克隆抗体免疫组织化学结果显示EV71主要分布在星形胶质细胞胞浆、胞核,“袖套样”改变小血管周围胶质细胞胞浆、胞核内有少量分布;血管内皮细胞及周围炎症细胞胞浆、细胞核也有少量表达;神经元中有少量表达。这提示EV71并非亲神经元性的,而主要是亲胶质细胞性的。其原因可能是:星形胶质细胞的突起伸展充填在神经元胞体及其突起之间,在调节突触传递及神经元耦合方面起着重要作用,有些突起末端形成脚板,附在毛细血管壁上组成血脑屏障,或附着在脑和脊髓表面形成胶质界膜[10]。本研究免疫组织化学显示EV71亲星形胶质细胞性,说明其更倾向于通过与星形胶质细胞形成的脚板结合,进而透过血脑屏障到达神经中枢。
研究表明ICAM-1在颅内病毒感染炎症细胞聚集过程中发挥重要作用,提示ICAM-1与炎症细胞“袖套样”浸润密切相关[11-12]。ICAM-1属于黏附蛋白中的免疫球蛋白超家族成员之一,是与细胞膜结合的1型糖蛋白,在诱导白细胞移动、淋巴细胞的激活、其他免疫反应信号传导以及炎症反应中起着重要的作用,在多种细胞中都有表达,如大部分白细胞、血管内皮细胞、中枢神经系统中小神经胶质细胞、星形胶质细胞以及少突胶质细胞等[13-14]。免疫组织化学染色显示,EV71阳性样本中的ICAM-1主要表达于“袖套样”聚集的炎症细胞、星形胶质细胞、胶质小结胶质细胞。EV71主要侵染的星形胶质细胞是血脑屏障的重要组成部分,激活状态下星形胶质细胞ICAM-1表达增多,进一步促进了脑血管内皮细胞分泌黏附分子及炎症介质,破坏血脑屏障结构,使血脑屏障通透性增加,使白细胞向中枢神经系统聚集,并透过血脑屏障向脑实质的移动,聚集的炎症细胞可进一步表达ICAM-1[15]。实验组血管内皮细胞及血管周围的炎症细胞ICAM-1表达较对照组显著增多,因此,ICAM-1可能在EV71侵染引起炎症细胞聚集过程中起着重要的作用。
[1] Wu PC,Huang LM,Kao CL,et al.An outbreak of coxsackievirus A16 infection:comparison with other enteroviruses in a preschool in Taipei[J].J Microbiol Immunol Infect,2010,43(4):271-277.
[2] De W,Changwen K,Wei L,et al.A large outbreak of hand,foot,and mouth disease caused by EV71 and CAV16 in Guangdong,China,2009[J].Arch Virol,2011,156(6):945-953.
[3] Yang Y,Wang H,Gong E,et al.Neuropathology in 2 cases of fatal enterovirus type 71 infection from a recent epidemic in the People’s Republic of China:a histopathologic, immunohistochemical, and reverse transcription polymerase chain reaction study[J].Hum Pathol,2009,40(9):1288-1295.
[4] Zhang J,Sun J,Chang Z,et al.Characterization of hand, foot, and mouth disease in China between 2008 and 2009[J].Biomed Environ Sci,2011,24(3):214-221.
[5] Wong KT,Munisamy B,Ong KC,et al.The distribution of inflammation and virus in human enterovirus 71 encephalomyelitis suggests possible viral spread by neural pathways[J].J Neuropathol Exp Neurol,2008,67(2):162-169.
[6] Zhang Y,Cui W,Liu L,et al.Pathogenesis study of enterovirus 71 infection in rhesus monkeys[J].Lab Invest,2011,91(9):1337-1350.
[7] Ooi MH,Wong SC,Lewthwaite P,et al.Clinical features,diagnosis,and management of enterovirus 71[J]. Lancet Neurol,2010,9(11):1097-1105.
[8] Xu J,Qian Y,Wang S,et al.EV71:an emerging infectious disease vaccine target in the Far East?[J]. Vaccine,2010,28(20):3516-3521.
[9] Hsueh C,Jung SM,Shih SR,et al.Acute encephalomyelitis during an outbreak of enterovirus type 71 infection in Taiwan:report of an autopsy case with pathologic,immunofluorescence,and molecular studies[J].Mod Pathol,2000,13(11):1200-1205.
[10]Haydon PG,Carmignoto G.Astrocyte control of synaptic transmission and neurovascular coupling[J].Physiol Rev,2006,86(3):1009-1031.
[11]Dietrich JB.The adhesion molecule ICAM-1 and its regulation in relation with the blood-brain barrier[J].J Neuroimmunol,2002,128(1-2):58-68.
[12]Sharma A,Bhomia M,Honnold SP,et al.Role of adhesion molecules and inflammation in Venezuelan equine encephalitis virus infected mouse brain[J].Virol J,2011,8:197.
[13]Hu X,Barnum SR,Wohler JE,et al.Differential ICAM-1 isoform expression regulates the development and progression of experimental autoimmune encephalomyelitis[J].Mol Immunol,2010,47(9):1692-1700.
[14]Miklossy J,Doudet DD,Schwab C,et al.Role of ICAM-1 in persisting inflammation in Parkinson disease and MPTP monkeys[J].Exp Neurol,2006,197(2):275-283.
[15]Constantin G.Chemokine signaling and integrin activation in lymphocyte migration into the inflamed brain[J]. J Neuroimmunol,2008,198(1-2):20-26.
2011-10-12)
(本文编辑:刘宁国)
Distribution of Human Enterovirus 71 in Brainstem of Infants with Brain Stem Encephalitis and Infection Mechanism
HAO Bo1,GAO Di1,TANG Da-wei1,WANG Xiao-guang1,LIU Shui-ping1,Kong Xiao-ping2,LIU Chao3, HUANG Jing-lu1,BI Qi-ming1,QUAN Li1,LUO Bin1
(1.Department of Forensic Medicine,Zhongshan Medical College,Sun Yat-sen University,Guangzhou 510080, China;2.Panyu Branch of Guangzhou Public Security Bureau,Guangzhou 511400,China;3.Institute of Criminal Science and Technology,Guangzhou Public Security Bureau,Guangzhou 510030,China)
Objective To explore the mechanism that how human enterovirus 71(EV71)invades the brainstem and how intercellular adhesion molecules-1(ICAM-1)participates by analyzing the expression and distribution of human EV71,and ICAM-1 in brainstem of infants with brain stem encephalitis.Methods Twenty-two brainstem of infants with brain stem encephalitis were collected as the experimental group and 10 brainstems of fatal congenital heart disease were selected as the control group.The sections with perivascular cuffings were selected to observe EV71-VP1 expression by immunohistochemistry method and ICAM-1 expression was detected for the sections with EV71-VP1 positive expression.The staining image analysis and statistics analysis were performed.The experiment and control groups were compared.Results(1)EV71-VP1 positive cells in the experimental group were mainly astrocytes in brainstem with niggerbrown particles,and the control group was negative.(2)ICAM-1 positive cells showed nigger-brown.The expression in inflammatory cells (around blood vessels of brain stem and in glial nodules)and gliocytes increased.The results showed statistical difference comparing with control group(P<0.05).Conclusion The brainstem encephalitis can be used to diagnose fatal EV71 infection in infants.EV71 can invade the brainstem via hematogenous route.ICAM-1 may play an important role in the pathogenic process.
forensic pathology;hand,foot and mouth disease;enterovirus;intercellular adhesion molecules-1
DF795.1
A
10.3969/j.issn.1004-5619.2012.02.002
1004-5619(2012)02-0085-04
国家自然科学基金资助项目(39700167)
郝博(1984—),男,河北邢台人,硕士研究生,主要从事法医病理学研究;E-mail:15820224411@163.com
罗斌,男,主任法医师,硕士研究生导师,主要从事法医病理学研究;E-mail:luobin@mail.sysu.edu.cn
