米曲霉发酵制备大豆肽的分离纯化与抗氧化性研究
2012-11-17郁晓敏吴娴静董德坤朱丹华
郁晓敏 吴娴静 董德坤 朱丹华
(浙江省农业科学院作物与核技术利用研究所,杭州 31002)
米曲霉发酵制备大豆肽的分离纯化与抗氧化性研究
郁晓敏 吴娴静 董德坤 朱丹华
(浙江省农业科学院作物与核技术利用研究所,杭州 31002)
利用辐照诱发米曲霉孢子突变,筛选得到酶活力强且特异性高的米曲霉诱变菌株。利用米曲霉诱变菌株对豆腐皮加工后的剩余豆浆(下浆水)进行发酵,制备大豆肽的发酵液,发酵液经超滤和凝胶过滤进行分离纯化,采用铁离子还原抗氧化剂能力测定法(FRAP法)和二苯基苦基苯肼法(DPPH法)研究不同相对分子质量大豆肽的抗氧化能力。结果表明,相对分子质量在1 000~10 000范围内的大豆肽具有很好的抗氧化活性,其中抗氧化性和稳定性最好的大豆肽组分的相对分子质量在1 200~1 400之间。
大豆肽 米曲霉 抗氧化性
大豆肽,又称大豆活性肽或大豆功能多肽,是大豆蛋白水解产生的具有生理活性的小分子短肽链,通常由3~10个氨基酸组成,相对分子质量在300~3 000范围内[1-2]。与大豆蛋白相比,大豆肽无豆腥味,不产生蛋白变性,抗氧化活性显著,易被消化吸收,具有更丰富的营养特性和生理功能[3-4]。从发展前景看,大豆蛋白水解生产大豆肽是大豆蛋白深加工的一个重要方向。
米曲霉(Aspergillus oryzae)是一种需氧真菌,稳定性高,易培养,能产生酸性蛋白酶、中性蛋白酶和碱性蛋白酶,其中中性蛋白酶和碱性蛋白酶,能将大分子蛋白质降解成多肽和氨基酸[5]。大豆加工豆腐皮的过程中产生大量剩余豆浆——下浆水,平均每生产1.5吨的豆腐皮就产生1吨的下浆水。下浆水中的大豆蛋白和低聚糖含量丰富,其含粗蛋白约为5%[6]。利用米曲霉可降解下浆水开发高附加值的肽类新产品,通过米曲霉在发酵过程中利用原料中的糖分、纤维等物质作为营养,分泌产生的蛋白酶水解下浆水中的大豆蛋白,分解产生较小分子质量的肽和氨基酸,提高利用价值。
本研究利用60Co辐照诱变对米曲霉菌株进行筛选,将米曲霉诱变菌株A-9应用于大豆肽发酵生产;选用豆腐皮加工制作过程中剩余的豆浆(下浆水)为发酵原料;运用超滤技术和凝胶过滤技术分离纯化经米曲霉发酵下浆水的发酵液,得到大豆肽溶液;采用铁离子还原抗氧化剂能力测定法(FRAP法)和二苯基苦基苯肼法(DPPH法)测定大豆肽的抗氧化活性,以期增加大豆肽在食品、医药保健品、饲料添加剂等领域的应用,为大豆低值蛋白的加工利用提供新途径。
1 材料与方法
1.1 材料
菌种:米曲霉 Asp 3.042(Aspergillus oryzae 3.042)。原始种由浙江省农业科学院植物保护与微生物研究所提供,经义乌市丹溪酒业有限公司单胞分离的优良菌株。
原料:下浆水(控制固形物质量分数为15%),麸皮,蔗糖。
1.2 主要仪器及试剂
Labscale TFF System:美国 Millipore公司;AKTATM Prime Plus:GE Healthcare公司;Bacitracin(杆菌肽):上海鼎国。
1.3 菌种的诱变筛选
米曲霉菌种的诱变筛选参照胡杰等[6]的方法,蛋白酶活力、氨基酸含量、粗肽含量的测定参照郭继平等[7]的方法。
1.4 大豆肽的制备
米曲霉分级培养与大豆肽发酵生产参照吴娴静等[8]的方法,发酵液经6 000 r/min离心,取上清液制得大豆肽提取液。
1.5 大豆肽的分离
超滤分离:用10 000、5 000、1 000 u的超滤膜依次分离,收集相对分子质量1 000以下、1 000~5 000、5 000~10 000以及10 000以上的发酵液(调节超滤进出溶液的流速,注意超滤膜进出口的压力大小)。
凝胶色谱分离:凝胶过滤色谱分离参照周媛媛等[9]的方法。
1.6 抗氧化活性测定
FRAP(ferric reducing antioxidant power)法:铁离子还原抗氧化剂能力(T-AOC)测试盒(南京建成);DPPH(2,2-diphenyl-1-picrylhydrazyl)法:参照张东杰等[10]的方法。
2 结果与讨论
2.1 菌种诱变筛选
在不同辐照强度下米曲霉孢子液的致死率试验中,随着辐照强度的增加,米曲霉孢子的致死率逐渐升高(表1)。当辐照强度达到625 Gy时,孢子全部都被辐照灭活;而当辐照强度达500 Gy时,孢子致死率为92.5%。致死率超过90%后,菌株的突变频率增加,诱变产生的特异性菌株增多,较容易筛选到目标性状。因此,本研究中选用辐照强度500 Gy作为诱变条件,诱发米曲霉孢子突变,筛选酶活力强、特异性高的米曲霉诱变菌株。
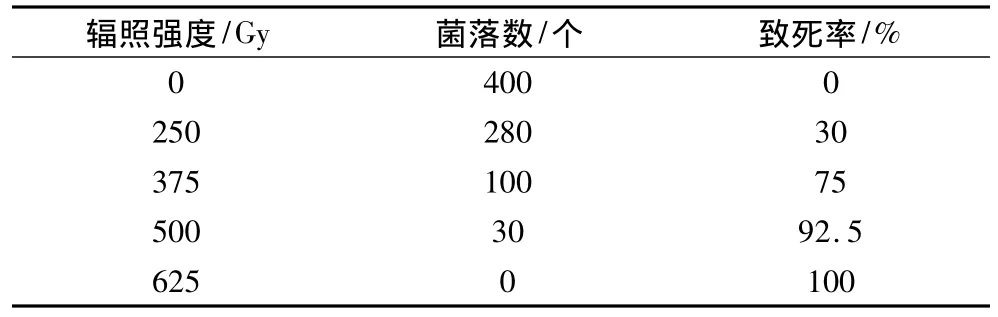
表1 不同辐照强度下米曲霉孢子液的致死率
在辐照强度为500 Gy的条件下,对米曲霉原始菌株Asp3.042孢子液进行诱变,以HE值(透明圈直径/菌落直径)作为筛选指标,筛选获得17个透明圈较原始菌株大的诱变菌株,分别为 A-1、A-2、A-3、……、A-17(表2)。对筛选得到的诱变菌株进行连续10代的接种培养,17个菌株均没有发生菌种衰退,遗传稳定性好。
对初筛得到的17个诱变菌株,接种下浆水发酵培养基,在相同条件下进行摇瓶培养。除A-2外的16个诱变菌株,其发酵4 d的蛋白酶酶活力和发酵8 d的粗肽含量均比原始菌株Asp3.042高(表2)。其中,A-9菌株菌落质地疏松,生长初期呈白色,后期变为淡绿褐色;生长较快,形成绿色孢子体,呈光滑球形;其发酵4 d的蛋白酶活力比原始菌株 Asp 3.042提高20%,发酵8 d得到的粗肽质量分数提高19%;其形态学特征与原始菌株相同,连续培养稳定性良好。因此,本研究确定米曲霉A-9菌株为最优发酵菌株,进行下一步的大豆肽发酵生产。
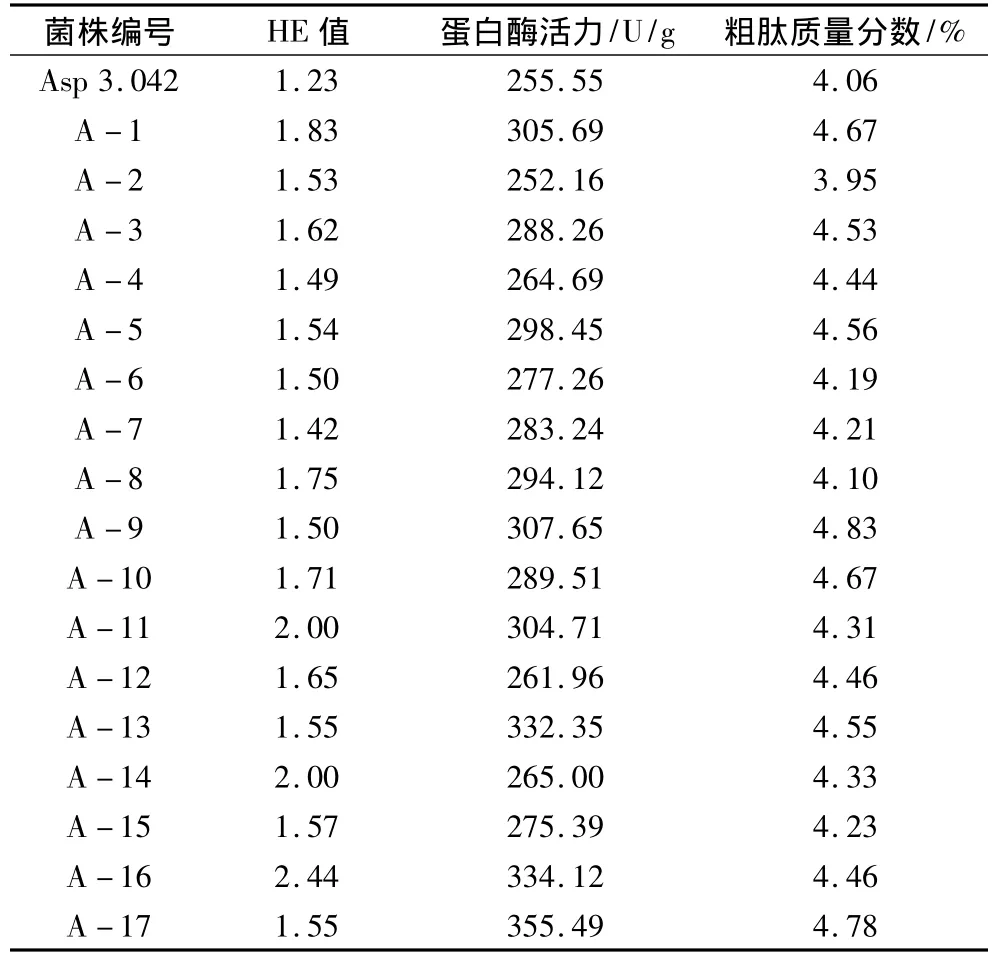
表2 米曲霉诱变菌株的筛选
2.2 超滤分离大豆多肽及抗氧化活性分析
经米曲霉A-9发酵下浆水的发酵液,通过离心沉淀收集上清液,得到大豆肽提取液。利用超滤技术[11-12]对收集的提取液进行逐步分离,得到相对分子质量大小不同的4个截留液(相对分子质量<1 000的截留液Ⅰ、1 000~5 000的截留液Ⅱ、5 000~10 000的截留液Ⅲ、>10 000的截留液Ⅳ)。截留液I的主要成分是短肽和游离氨基酸;截留液Ⅱ、Ⅲ的成分以多肽和短肽为主;截留液Ⅳ包含未被充分分解的蛋白质、糖类以及悬浮颗粒等。下浆水中的大豆蛋白被米曲霉发酵过程中产生的蛋白酶分解成多肽和短肽等,使蛋白结构中具有抗氧化能力的基团(如巯基、咪唑基、酚羟基等)暴露出来;这些基团具有清除自由基,抑制氧化降解的作用,从而使大豆肽表现出抗氧化活性。
抗氧化活性主要表现在抑制氧化降解、清除自由基、抑制促氧化剂和还原能力等方面[13-15]。本研究对4个截留液(截留液Ⅰ、Ⅱ、Ⅲ、Ⅳ)进行抗氧化活性分析,分别测定其铁离子还原抗氧化剂能力(FRAP法)和DPPH自由基清除能力(DPPH法)(表3)。结果表明,米曲霉发酵所制的大豆肽具有显著的还原能力和自由基清除能力,其中截留液Ⅱ和Ⅲ的铁离子还原抗氧化剂能力和DPPH自由基清除率均显著高于截留液Ⅰ和Ⅳ。
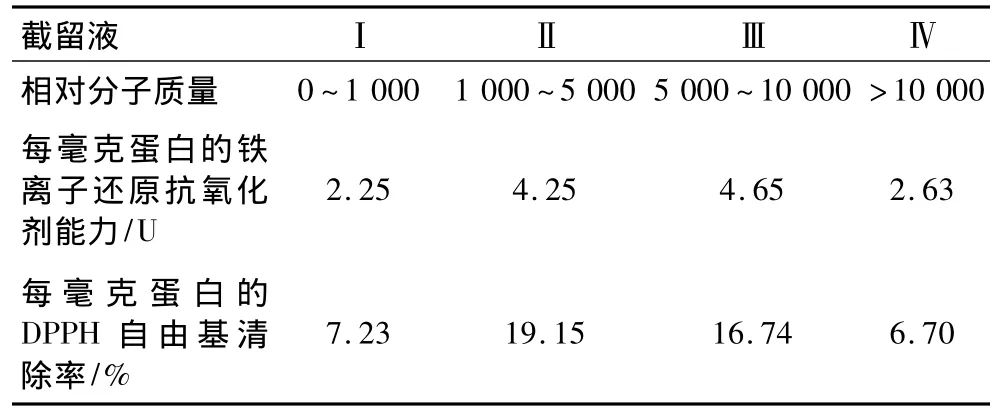
表3 发酵液中不同分子质量大小的截留液抗氧化活性比较
由于FRAP法和DPPH法测定抗氧化活性的原理不同,这两种方法的测定结果也有差异[11];张东杰等[10]研究经凝胶过滤色谱分离的不同分子质量大豆肽的抗氧化活性,结果表明其中两个肽组分(SP2和SP3)的DPPH自由基清除率和还原能力不一致。本研究中,截留液II和III的DPPH自由基清除率和铁离子还原氧化剂能力也不一致。截留液Ⅱ(1 000~5 000)每毫克蛋白的铁离子还原抗氧化剂能力为4.25 U,DPPH自由基清除率为19.15%;而截留液Ⅲ(5 000~10 000)每毫克蛋白的铁离子还原抗氧化剂能力为4.65 U,DPPH自由基清除率为16.74%。与截留液Ⅲ相比,截留液II中所含的多肽(或短肽)分子由于肽链较短,与DPPH自由基的结合能力可能更强,自由基清除量也可能更大;而在低pH条件(pH 3.6)下,截留液II所含的多肽分子中的巯基等基团不一定能完全有效地还原Fe3+,以致其铁离子还原氧化剂能力低于截留液Ⅲ。
将截留液放置3~5 d后,截留液II保持淡黄色澄清溶液,未出现沉淀,溶液较稳定;截留液Ⅲ则出现蛋白质凝聚,并产生沉淀,稳定性较差。根据抗氧化活性高并且溶液稳定性好的标准,截留液Ⅱ能更好地达到应用目标。
2.3 凝胶色谱分离大豆肽及抗氧化活性测定
采用Sephadex G-25凝胶柱(柱子尺寸2.6 cm×100 cm),进样量3 mL,流速3 mL/min,对截留液 II(相对分子质量1 000~5 000)进行层析分离及紫外吸收光谱分析。分离过程中,柱压稳定,洗脱中溶液基线平稳。经紫外光谱检测,截留液Ⅱ(1 000~5 000)中主要存在3个波峰(图1),其中第2个波峰(保留时间约115 min)的紫外吸收值最大,收集这个峰的洗脱液。在相同的凝胶色谱条件下,杆菌肽(相对分子质量1 422)的保留时间约为95 min(图1)。洗脱按分子质量大小逐渐分离,分子质量较大的大豆肽先被洗脱出来。因此,洗脱液中多肽的相对分子质量在1 200~1 400之间。
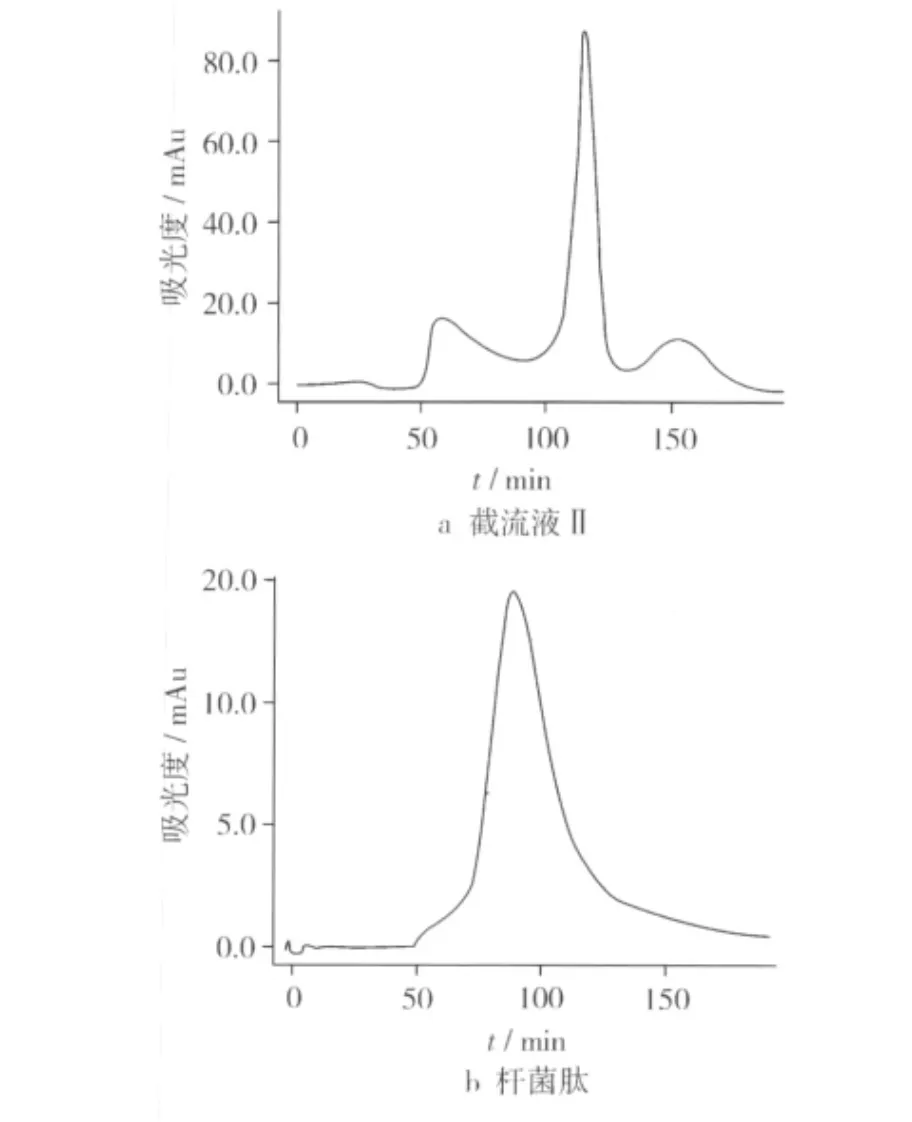
图1 截留液II和杆菌肽的凝胶过滤色谱
对分离收集的洗脱液进行抗氧化活性分析,该组分中每毫克蛋白的铁离子还原抗氧化剂能力是4.92 U,DPPH自由基清除率是19.67%。与截留液II相比,经凝胶过滤分离后,洗脱液的抗氧化活性有了提高。结果显示,在凝胶分离的过程中,截留液中的物质得到分离和纯化,其活性随着纯化的进行而不断提高。洗脱得到的最终组分中,肽成分较纯但含量较低,粗肽含量仅为0.16 μg/mL。若能利用制备型高效液相色谱对该组分进行进一步分离回收,然后分析和鉴定大豆肽的氨基酸序列和结构,将更好地促进抗氧化多肽的开发和制备。
3 结论
通过60Co辐照诱变,本研究筛选得到米曲霉诱变菌株A-9,该菌株经连续培养未出现衰退,遗传稳定性好,其蛋白酶活力和发酵产物粗肽含量比原始菌株分别提高20%和19%,适合应用于大豆肽的生产实践。
由米曲霉发酵所制的大豆肽提取液中,存在着相对分子质量大小不同的物质,包括未经分解的大豆蛋白、降解得到的大小不一的多肽和短肽、以及游离氨基酸等。大豆肽提取液具有抗氧化活性,通过超滤分离,相对分子质量在1 000~5 000和5 000~10 000的截留液抗氧化活性强于其他区间(<1 000或>10 000)的截留液,其中1 000~5 000的截留液呈淡黄色,溶液放置稳定性好,适合应用于抗氧化多肽的开发与生产。
对截留液(1 000~5 000)进行凝胶过滤分离,洗脱收集具有最大吸光值(保留时间约115 min)的组分,其相对分子质量在1 200~1 400之间。该组分的抗氧化活性比截留液(1 000~5 000)有所提高,说明进一步的分离纯化有利于增强其抗氧化活性,使大豆肽具有更为广阔的应用发展前景。
[1]李善仁,陈济琛,胡开辉,等.大豆肽的研究进展[J].中国粮油学报,2009,24(7):142 -147
[2]Yu Bo,Lu Zhaoxin,Bie Xiaomei,et al.Scavenging and antifatigue activity of fermented defatted soybean peptides[J].European Food Research and Technology,2008,226:415 -421
[3]Moure A,Dominguez H,Parajo J C.Antioxidative properties of histidine-containing peptides designed from peptide fragments found in the digests of a soybean protein[J].Journal of Agricultural and Food Chemistry,2006,41:447 -456
[4]杨彩艳,宋俊梅.大豆肽研究进展[J].粮食与油脂,2009(1):43-45
[5]刘丽萍,刘丽华.米曲霉研究进展与应用[J].中国调味品,2008,33(4):28 -32
[6]胡杰,潘力,罗立新,等.米曲霉孢子原生质体复合诱变及高活力蛋白酶菌株的选育[J].食品工业科技,2007(5):116-122
[7]郭继平,马莺.紫外诱变选育米曲霉高产蛋白酶菌株[J].微生物学通报,2007,34(2):246 -250
[8]吴娴静,姜莹,董德坤,等.米曲霉发酵腐皮产后余浆生产大豆肽的条件优化[J].食品与发酵工业,2010,36(4):64-69
[9]周媛媛,周瑞宝.大豆多肽的分离纯化与抗氧化活性研究[J].中国油脂,2008,33(5):34 -36
[10]张东杰,马中苏.凝胶过滤色谱分离大豆抗氧化肽活性的研究[J].中国酿造,2010(6):41-44
[11]孙月梅,李杨,江连洲.超滤技术在抗氧化大豆肽制备中的研究[J].食品工业科技,2009,30(2):94-96
[12]邓成萍,薛文通,孙晓琳,等.超滤在大豆多肽分离纯化中应用[J].食品科学,2006,27(2):192-195
[13]王会,郭立,谢文磊.抗氧化剂抗氧化活性的测定方法(一)[J].食品与发酵工业,2006,32(3):92 -98
[14]王会,郭立,谢文磊.抗氧化剂抗氧化活性的测定方法(二)[J].食品与发酵工业,2006,32(3):98 -102
[15]张莉莉,严群芳,王恬.大豆生物活性肽的分离及其抗氧化活性研究[J].食品科学,2007,28(5):208 -211.
Purification and Antioxidant Activity Determination of Soybean Peptide Fermented from Soy Film By-Products by Aspergillus oryzae
Yu Xiaomin Wu Xianjing Dong Dekun Zhu Danhua
(Institute of Crop and Nuclear Technology Utilization,Zhejiang Academy of Agricultural Sciences,Hangzhou 310024)
Aspergillus oryzae with strong enzyme activity and high specificity was screened from spore mutation through irradiation.Soybean peptides were made by soy milk remained from soy film by-products and fermented by Aspergillus oryzae.Purification of soybean peptides was then done through ultrafiltration and gel filtration.Antioxidant activity of purified soybean peptides with different molecular weight was determined using FRAP(ferric reducing antioxidant power)and DPPH(2,2 - diphenyl-1 - picrylhydrazyl)methods.The results showed that the sample with molecular weight between 1 000 and 10 000 had better antioxidant activity.The molecular weight of sample that had best antioxidant activity and stability was between 1 200 and 1 400.
soybean peptide,Aspergillus oryzae,antioxidant activity
TQ936
A
1003-0174(2012)03-0020-04
2011-06-24
郁晓敏,男,1979年出生,助研,大豆品质改良
朱丹华,男,1957年出生,研究员,大豆遗传育种
