颅内温控射频消融的热损伤有限元分析
2012-11-16洪焦李鹏高宏建吴水才
洪焦,李鹏,高宏建,吴水才
北京工业大学 生命科学与生物工程学院,北京 100124
颅内温控射频消融的热损伤有限元分析
洪焦,李鹏,高宏建,吴水才
北京工业大学 生命科学与生物工程学院,北京 100124
目的 运用有限元方法模拟颅内温控射频消融过程中的温度场分布,建立临床常用的激励模型,以提高射频消融治疗颅内病灶的效果。方法 基于2种激励分布来建立3种有限元模型,并对其温度变化、热损伤范围进行对比分析。结果 消融区域在消融开始60s内增长迅速,60s后增长缓慢,且固态介质模型的消融面积>相应液态模的消融面积。结论 恒温激励源的设计可用于模拟温控射频消融治疗。
射频消融仪;脑病灶;射频消融;有限元法(FEM);热模型
1 研究背景
射频消融术(Radio Frequency Ablation,RFA)已广泛用于治疗心律失常[1]、肝脏肿瘤[2]和脑部病变。颅内病灶 (苍白球(帕金森病)[3]、海马-杏仁核(颞叶癫痫)、肿瘤[4]等)的射频消融治疗是将射频消融针(频率460 kHz)通过脑立体定向、颅骨钻孔插入病灶部位作为热源,在数分钟内产生局部高温(>50℃),使病灶组织凝固变性,达到原位毁损病灶的目的。合理有效地利用热消融治疗,可明显提高对常规放、化疗不敏感肿瘤的控制率,改善治愈率和生存率。同时,热疗还可在不降低现有治疗手段和疗效的基础上,有效缓解症状,改善全身状况,增加机体免疫功能[5]。目前,射频消融治疗中加热功率和时间的确定还依赖于医生的经验,人为因素影响很大。因此,对射频消融热损伤区域(组织温度≥50℃区域)进行仿真分析、实现术前的手术规划具有重要的临床意义。
影响射频消融温度场模拟结果的因素:
(1) 水循环冷却的影响。水冷循环的加入可增加有效消融时间,增大消融范围[6]。
(2) 血液灌流的影响。血液灌流对模型电特性影响不大,但在一定程度上降低了模型消融温度。
(3) 生物组织热电参数随温度变化的影响。变化的热电参数在一定程度上改变热传导率和射频能量吸收率,从而改变消融温度[7-9]。
目前,针对脑部病灶射频消融的离体实验中多使用体模或动物脑。由于动物脑组织存在体积小、消融区不均匀并且离体后容易变质等因素,消融实验效果不佳。因此,研究者更倾向于使用体模进行消融实验。Eriksson等人[10-11]制造了一种透明、均匀、可重复使用的混合白蛋白体模,其热物性参数与人脑组织相近,但其性质为液态,实际消融过程中热对流作用带走较多热量。针对这种情况J. Wren等人[12-13]在液态体模中混合明胶,使其在室温下可保持胶状,屏蔽了对流作用的影响。本文针对以上两种不同情况设计了两种能量分布,利用有限元方法计算恒温激励下蛋白质体模和脑组织消融温度分布规律,比较消融温度场以及热损伤区的变化。
2 原理与方法
2.1 恒温激励模型
目前,临床脑病灶射频消融仪大多为温度控制型,即实际手术过程中医生只需要规定消融温度和时间,医生只能根据经验来判定消融效果,因此消融能量不宜过高,但这可导致消融不彻底、易复发等结果。
研究结果表明:由于消融针的电导率比白蛋白体模以及脑组织的电导率大很多,使射频能量大部分集中于消融针外部,而消融针内部不会得到射频能量,其升温主要是通过热传导;消融针周围组织获得的射频能量正比于1/r4,其中r为针半径,这说明射频能量主要集中于消融针周围,且径向上能量衰减非常快。对于温控射频消融仪,治疗初始10 s左右即可达到设定温度。由于射频能量不恒定,很难通过射频能量的有限元分析来模拟温度变化。
本研究设计了两种恒温能量刺激模型,模拟针尖附近能量分布规律,以期找到合适的模型。其能量激励分布区域,见图1。图1(a)用于模拟存在热对流时的消融情况,其能量主要分布于针尖两侧;图1(b)用于模拟不存在热对流时的消融情况,其能量包裹在针尖四周,且绝缘杆与针尖连接处能量较强。根据不同材料,设计了3种有限元计算模型:白蛋白溶液(模型I,激励分布a);凝胶状白蛋白(模型II,激励分布b);脑灰质(模型III,激励分布c)。
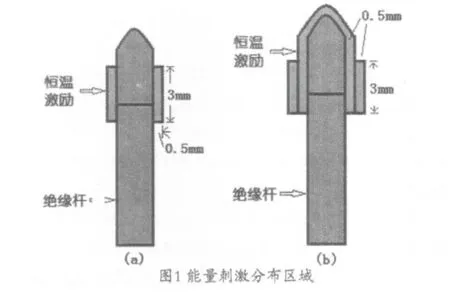
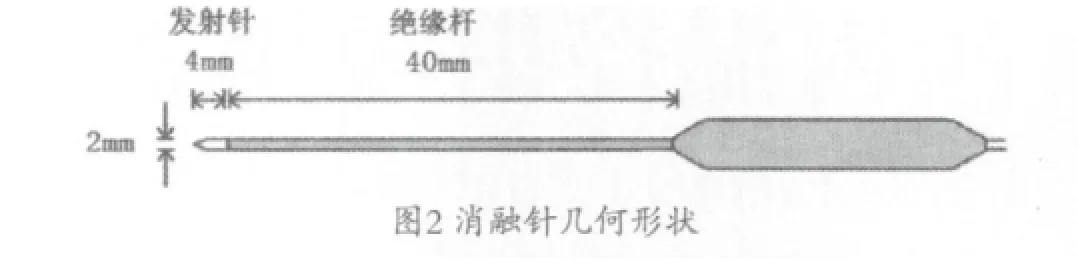
2.2 射频针与消融区模型
脑病灶射频消融中所用的射频针结构,见图2。消融针总长44 mm,直径2 mm;前段金属发射部分为医用合金,长4 mm;绝缘杆为聚氨酯,长40 mm。
消融区组织模型,见图3。模型半径30 mm,高度60 mm。组织边界条件如下:组织初始温度Tu=37 ℃,恒温能量激励温度:Tc=90 ℃。射频针和组织材料的热电参数,见表1。脑灰质密度和比热来自Duck[14]的数据,导热率来自Chato[15]的文献数据,射频针和绝缘杆的参数来自Louay Chachati等人[16]的文献。

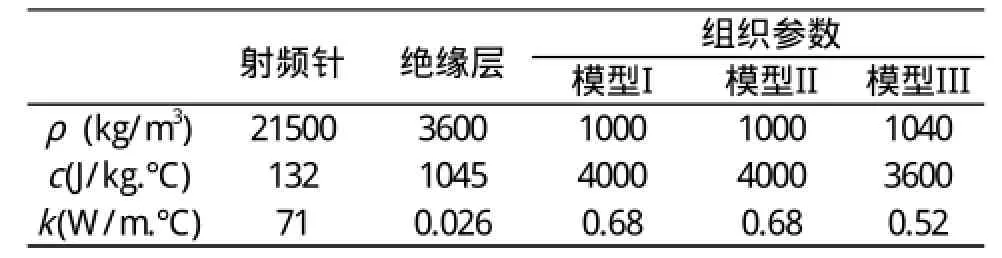
表1 射频针和组织材料的热电参数
2.3 模型边界条件
考虑3种恒温激励源的有限元模型特点,运用有限元分析软件ANSYS 13.0求解,模拟使用轴对称分析和瞬态热传导模块。使用的射频针,发射针长4 mm,绝缘杆长30 mm,探针直径2 mm。脑组织为30 mm×60 mm区域,记录A(0.5 mm)、B(2.5 mm)、C(5 mm)三点的温度变化,其中A点位于针内部,距中轴线0.5 mm,B、C两点位于针外部,距中轴线距离分别为2.5 mm、5 mm,见图4。记录消融开始后60 s和120 s时刻的温度分布和热损伤区域大小(以50 ℃为边界的椭圆为参考,超过50 ℃后组织变性坏死)。模型初始和边界条件如下:① 脑组织初始温度为37 ℃。② 激励源温度设定为90 ℃。③ 假设消融时间为120s。④ 假设脑组织为脑灰质,且均匀。⑤ 忽略血液灌流对消融效果的影响。⑥ 忽略组织代谢产热对消融效果的影响。

3 结果与讨论
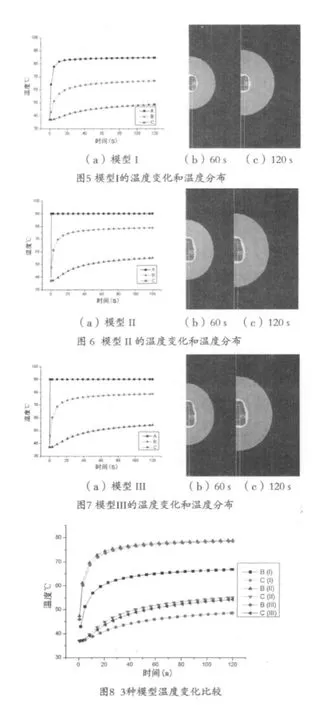
图5~7(a)记录了3种模型的A、B、C 3点处的温度时间变化曲线,从图中可以看出,由于医用金属的热传导率远大于脑组织,因此,A点可视为激励源处温度变化;B点较C点更靠近激励源,初始时刻升温迅速,随着时间的推移升温幅度减小直至基本不变;而C点处温升缓慢,升温速度基本保持恒定。图5~7(b)和(c)分别为3种模型消融60 s和120 s时刻的温度场分布,从中可以看出,消融区域近似为椭球形,并且消融前60 s热损伤区域增长迅速,60~120 s时间段里损伤区的增长变得平缓。
比较模型I、II、III的B点和C点温度随时间的变化,见图8。三种模型B、C点的温升趋势相似,但是模型II和III的温度明显高于模型I。说明白蛋白溶液体模存在的热对流作用对消融结果影响较大。同时对比相同能量激励下的模型II和III,可见模型II的温度和消融区域要稍大于模型III,主要原因是其材料热物性参数存在差异,明胶状白蛋白体模对热量的吸收能力(k/ρc)要大于脑灰质。3种模型60 s和120 s时刻热损伤区域大小(以50 ℃为消融边界),见表2。其中X为消融区短半轴,Y为消融区长半轴,S为椭圆消融区的面积。可见模型II和III的消融面积分别较模型I大84.9%和68.8%,模型II的消融面积比模型III大9.2%。消融开始60 s内消融区增长迅速,60 s之后增长缓慢。比较3种模型60 s和120 s两时刻消融区域大小,其增长率分别为21.5%、26.8%、20.6%。
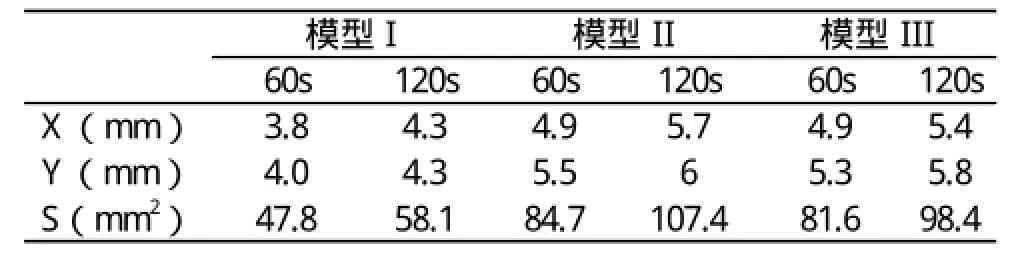
表2 3种模型热损伤区域大小
4 结论
射频消融过程中,为了有效控制热损伤区域的大小,温度监控变得异常重要。实际的射频消融仪只能通过探针内部的热电偶测量温度,无法测量探针外部温度,也无法检测实际消融区的大小。同时随着消融能量和介质热物性参数的变化,消融结果存在较大差异,临床医生多数情况下只能根据经验判断消融能量和时间。因此,这就需要利用有限元分析工具对特定环境下的热计量进行评估。
本研究对脑病灶射频消融热损伤区进行了有限元仿真。通过模拟临床常用温控射频消融仪的工作机制设计出两种能量分布,然后利用ANSYS软件模拟液态白蛋白体模、凝胶白蛋白体模和脑灰质的射频消融情况,并比较消融温度、温度场分布和热损伤区大小(边界温度超过50 ℃区域)。研究结果表明:液态体模(如蛋清和白蛋白溶液)内部存在的热对流作用对消融结果影响较大,实验中要尽量避免使用液态体模;介质材料的热物性参数对热剂量的计算至关重要;初始时刻介质对能量的吸收能力强,热损伤范围迅速扩大,消融后1/2段吸收能力下降,热损伤区域形成缓慢。
[1]Tungjitkusolmun S,Woo EJ,Cao H,et al.Finite element analyses of uniform current density electrodes for radio-frequency cardiac ablation[J].IEEE Trans Biomed Eng,2001,47(1):32-40.
[2]Goldberg SN.Radiofrequency tumor ablation:principles and techniques[J].Eur J Ultrasound,2001,13(2):129-147.
[3]Cosman E.Radiofrequency lesions.In:Gildenberg PL,Tasker R (eds) Textbook of stereotactic and functional neurosurgery[C]. Quebecor Printing, Kingsport,1996:973-985.
[4] 王启弘,杨富明,杨世春.射频毁损脑深部肿瘤的应用研究[J].功能性和立体定向神经外科杂志,1997,10(4):14-16.
[5]王梅.肿瘤热疗的研究进展[J].海南医学院学报,2010, 16(2):245-247.
[6]徐晓菲,白景峰,陈亚珠.水冷式射频消融过程中水冷温度对热损伤的影响[J].北京生物医学工程,2008,27(4):393-395.
[7]Isaac Chang. Finite element analysis of hepatic radiofrequency ablation probes using temperature-dependent electrical conductivity[J].BioMed Central. Bio Medical Engineering OnLine,2003.
[8] 范晓筠,白景峰,陈亚珠.单针水冷式射频消融过程中组织热损伤区域的有限元分析[J].中国医学物理学杂志,2007,24(3):197-199.
[9]侯惠亮,郑小溪.热疗过程体温监测器的研制[J].中国医疗设备,2011,26(8):32-35.
[10] Eriksson O,Wardell K,Bylund N,et al.In vitro evaluation of brain lesioning electrodes using a computer-assisted video system[J].Neurological Res,1999,21(1):89-95.
[11] Eriksson O,Wren J,Loyd D,et al.A comparison between in vitro studies of protein lesions generated by brain electrodes and finite element model simulations[J].Med Biol Eng Comput,1999,37: 737-741.
[12]J Wren I O,Eriksson z K,W&rdell z D.Loyd 1.Analysis of temperature measurement for monitoring radio-frequency brain lesioning [J].Med.Biol.Eng.Comput,2001,39:255-262.
[13]J.Wren.On modelling and simulation of perfused tissue during thermal treatment-thermal analysis of blood perfusion and lesioning during ablative neurosurgery[M].Lic.Eng.Thesis, LinkGpings Univeristet,2000.
[14] Duck AF.Physical properties of tissue [M].The University Press, Cambridge,1990.
[15] Chato JC.Selected thermophysical properties of biological materials[M].In:Shitzer Eberhart eds.Heat Transfer in Medicine and Biology.Newyork;plenum press,1985,2:413-418.
[16] Louay Chachati,Andrew S.Wright,David M.Mahvi.Hepatic radiofrequency ablation with internally cooled probes:effect of coolant temperature on lesion size[J].IEEE Transactions on Biomedical Engineering,2003,50(4):493-500.
Finite Element Analysis of Encranial Thermal Injury Region with Temperature-controlled Radio Frequency Ablation
HONG Jiao, LI Peng,GAO Hong-jian, WU Shui-cai
College of Life Science and Bioengineering, Beijing University of Technology, Beijing 100124, China
Objective This paper introduces f nite element application of themerature-controlled radio frequency ablation(RFA) to simulate the temperature distribution of intracranial lesion and build the excitation models found in clinical practice, thus to improve the treatment effectiveness. Methods Three f nite element models with two different exitations were f rst bulit, and then the key parameters including temperatures range and thermal injury were compared. Results The ablation regions grew fast in the f rst 60 seconds, then it became slow. In addition, the ablation regions of solid medium models were much larger than those of liquid models. Conclusion The design of homeothermal excitation may be effective for simulating temperature-controlled radio frequency abltion.
radio frequency ablation device; brain lesions; radio frequency ablation(RFA); f nite element methods(FEM); thermal model
R318
A
10.3969/j.issn.1674-1633.2012.08.009
1674-1633(2012)08-0037-03
2012-03-01
北京市自然科学基金(3112005)资助。
本文作者:在读硕士研究生。
吴水才,教授,博士生导师。
作者邮箱:15810948582@139.com
