明日叶中总黄酮的微波辅助提取工艺和检测方法研究
2012-11-15邹毓兰高桂余吕海涛
邹毓兰,单 虎,高桂余,吕海涛,*
(1.青岛农业大学化学与药学院,山东青岛266109;2.青岛农业大学动物科技学院,山东青岛266109)
明日叶中总黄酮的微波辅助提取工艺和检测方法研究
邹毓兰1,单 虎2,高桂余1,吕海涛1,*
(1.青岛农业大学化学与药学院,山东青岛266109;2.青岛农业大学动物科技学院,山东青岛266109)
对明日叶中总黄酮的提取工艺和检测方法进行了研究。采用微波法,利用单因素和正交实验对明日叶中总黄酮的提取工艺进行了优化,分别通过AlCl3和Al(NO3)3显色法,建立了明日叶中总黄酮的分光光度检测方法。结果表明,AlCl3显色法的最佳提取条件为:乙醇浓度85%、提取3次、料液比1∶25(g/mL)、微波功率600W、提取80s,样品中总黄酮的得率为1.48%;Al(NO3)3显色法的最佳提取条件为:乙醇浓度40%、提取3次、料液比1∶25(g/mL)、微波功率700W、提取80s,样品中总黄酮的得率为1.67%。另外,对两种显色方法的显色稳定性进行了初步探讨。
明日叶,总黄酮,正交实验,微波辅助提取
明日叶原产地在日本著名健康长寿之乡八丈岛,属于伞科多年生草本耐寒植物[1]。明日叶被誉为“21世纪的健康食品”,富含特有成分查尔酮和香豆素及人体需要的多种成分。具有抗溃疡、抗血栓、抗癌、降血压、降胆固醇的作用,并能够预防肝硬化、动脉硬化,改善胃肠道功能、改善睡眠、改善视力、提高人体免疫力[2-6]。黄酮类化合物又叫做生物总黄酮,具有增强心血管功能、抗肿瘤、增强免疫力、抗菌消炎、抗辐射、延缓衰老以及治疗慢性前列腺炎等作用[7-10],是包括明日叶在内的许多中草药的有效成分。目前,国内对明日叶的开发尚处于初级阶段,对明日叶中总黄酮的提取工艺及检测方法的研究尚未见报道[11-13],具有极大的开发潜力。与常规提取方法相比,微波提取具有选择性高、快速高效、溶剂消耗少、活性成分提取率较高、不产生噪音、适合于热不稳定物质的提取等优点。本文利用微波法对明日叶中黄酮的提取进行了研究,并对其测定方法进行了探讨,为开发和利用明日叶中的黄酮类成分提供理论参考。
1 材料与方法
1.1 材料与仪器
明日叶样品 购于本地药店,已干燥至恒重;芦丁标准品 购于Sigma公司;乙醇、硝酸铝、亚硝酸钠、氢氧化钠、氯化铝等试剂 均为分析纯。
紫外-可见光分光光度计 日本岛津;CASCADA超纯水系统 Pall Corporation;AR2140电子天平 上海奥豪斯国际工贸公司;50~200μL P200移液器、200~1000μL P1000移液器 北京吉尔森科技有限公司;循环水真空泵SHB-B88 郑州长城科工贸有限公司;RE-52AA旋转蒸发仪 上海亚荣生化仪器厂;微波合成萃取仪 北京祥鹄科技有限公司。
1.2 实验方法
1.2.1 明日叶总黄酮含量的测定
1.2.1.1 对照品溶液制备 精密称取芦丁对照品5.0mg,用60%乙醇定容于50mL的容量瓶中,即得0.10mg/mL芦丁对照品溶液。
1.2.1.2 AlCl3显色法 精密量取对照品溶液1.0mL,置于10mL容量瓶中,加入4.0mL 80%乙醇,摇匀,再加入4mL 1%AlCl3溶液,用80%乙醇定容,摇匀,放置10min,在300~600nm波长范围内进行扫描,得到最大吸收波长为409nm。
精密量取芦丁对照品溶液0.5、1.0、1.5、2.0、2.5、3.0mL,分别加入80%乙醇补至5mL,按照上述操作,在409nm下测其吸光度。以芦丁对照品溶液的浓度为横坐标,吸光度为纵坐标,绘制标准曲线,得到线性回归线方程为:y=0.0271x-0.0393,相关系数为0.9981。1.2.1.3 Al(NO3)3显色法 精密量取对照品溶液4.0mL,置于25mL容量瓶中,加入80%乙醇6.0mL、5%NaNO2和10%Al(NO3)3溶液各1mL,静置5min,加入4%NaOH溶液5mL,摇匀,放置5min,用80%乙醇定容,在400~700nm波长范围内进行扫描,得到最大吸收波长为500nm。
精密量取芦丁对照品溶液1.0、2.0、3.0、4.0、5.0、6.0mL,置于25mL容量瓶中,分别加入80%乙醇补至6.0mL,按照上述操作,在500nm下测其吸光度。以芦丁对照品溶液浓度为横坐标,吸光度为纵坐标,绘制标准曲线,得到线性回归方程为:y=0.0085x+0.0085,相关系数为0.9953。
1.2.1.4 样品液的制备和总黄酮含量的测定 准确称量明日叶1g,置于250mL三口瓶中,加入一定量、一定浓度的乙醇溶液,在微波合成萃取仪中提取,控制微波功率和提取时间,提取结束后将三口瓶取出冷却至室温,抽滤;多次提取时,将滤渣转移到三口瓶中重复操作,合并滤液,用旋转蒸发仪旋蒸,用80%乙醇定容至100mL。分别用AlCl3显色法和Al(NO3)3显色法,按照上述操作测定其吸光度,由回归方程计算出总黄酮的含量,进而求出样品中总黄酮的得率。
1.2.2 单因素实验
1.2.2.1 提取时间的影响 称取1g明日叶,置于250mL三口瓶中,加入30mL 80%乙醇,微波功率设为700W,温度为80℃,提取时间分别为30、60、90、120、150s,分别利用AlCl3显色法和Al(NO3)3显色法测定出样品中总黄酮的得率。
1.2.2.2 微波功率对提取效率的影响 称取1g明日叶,置于250mL三口瓶中,加入30mL 80%乙醇,提取90s,温度为80℃,微波功率分别设为500、600、700、800、900、1000W,分别利用AlCl3显色法和Al(NO3)3显色法测定出样品中总黄酮的得率。
1.2.2.3 料液比对提取效率的影响 称取1g明日叶,置于250mL三口瓶中,微波功率设为600W,温度为80℃,乙醇浓度80%,提取90s,加入乙醇的量分别为10、15、20、25、30mL,分别利用AlCl3显色法和Al(NO3)3显色法测定出样品中总黄酮的得率。
1.2.2.4 温度对提取效率的影响 称取1g明日叶,置于250mL三口瓶中,加入25mL 80%乙醇,微波功率设为600W,提取90s,温度分别为40、50、60、70、80℃,分别利用AlCl3显色法和Al(NO3)3显色法测定出样品中总黄酮的得率。
1.2.2.5 乙醇浓度对提取效率的影响 称取1g明日叶,置于250mL三口瓶中,微波功率设为600W,提取90s,温度为80℃,溶剂分别为蒸馏水、20%乙醇、40%乙醇、60%乙醇、80%乙醇和无水乙醇,分别利用AlCl3显色法和Al(NO3)3显色法测定出样品中总黄酮的得率。1.2.3 正交实验 在单因素实验的基础上,选取乙醇浓度(A)、提取时间(B)、提取功率(C)、料液比(D)和提取次数(E)为考察因素,以样品中总黄酮的得率为考察指标,设计五因素四水平的正交实验(表1)。
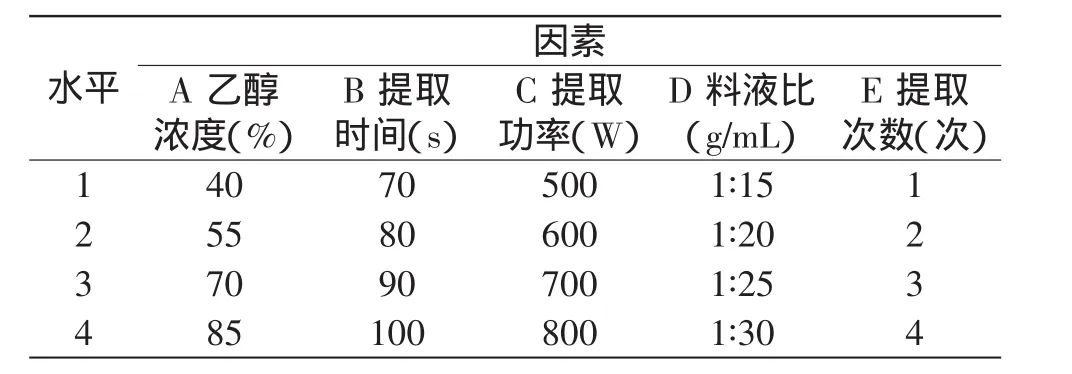
表1 因素水平表Table 1 Factors and levels of total flavonoids
1.2.4 显色稳定性实验 将制得的供试品溶液平均分成三份,一份在室温下、一份放置在冰箱中低温避光下保存、一份放置在阳光照射下,每隔一段时间,分别利用AlCl3显色法和Al(NO3)3显色法测供试品溶液的吸光度,以此来考察供试品溶液的稳定性。
2 结果与分析
2.1 单因素实验结果

图1 提取时间对样品总黄酮得率的影响Fig.1 Effect of extraction time on total flavonoids yield
2.1.1 提取时间对样品中总黄酮得率的影响 从图1可以看出,两种方法样品中总黄酮的得率都具有相同的变化趋势,总黄酮的得率随着提取时间的延长先增加后减小,当提取时间为90s时,总黄酮的得率达到最高;当提取时间大于90s时,总黄酮得率下降。这可能是因为在提取初期,黄酮在微波的作用下能较快地从基体中分离,能够快速溶出;但随着提取时间的增加,体系的温度会过热并出现爆沸的现象,一方面高温可能导致黄酮类物质分解;另一方面,爆沸也会引起部分药材被冲至容器壁上,影响液固两相的进一步接触,使得率降低[14-15]。
2.1.2 微波功率对样品中总黄酮得率的影响 从图2可以看出,两种方法样品中总黄酮的得率都具有相同的变化趋势,AlCl3显色法在500~700W时,功率对样品中总黄酮得率影响不大,两种显色方法总黄酮得率在600W时达到最大,功率大于700W之后,总黄酮得率趋于下降。

图2 微波提取功率对样品总黄酮得率的影响Fig.2 Effect of microwave power on total flavonoids yield
2.1.3 料液比对样品中总黄酮得率的影响 从图3可以看出,两种方法样品中总黄酮的得率都具有相同的变化趋势,随着提取溶剂的增多,样品中总黄酮得率逐渐增大,当料液比为1∶25时总黄酮得率达到最大。
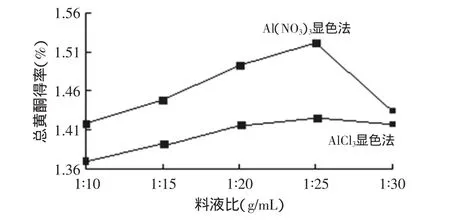
图3 料液比对样品总黄酮得率的影响Fig.3 Effect of material and liquid ratio on total flavonoids yield
2.1.4 温度对样品中总黄酮得率的影响 从图4可以看出,两种方法样品中总黄酮的得率都具有相同的变化趋势,总黄酮得率均随着温度的升高而逐渐增加。

图4 提取温度对样品中总黄酮得率的影响Fig.4 Effect of temperature on total flavonoids yield
2.1.5 乙醇浓度对样品中总黄酮得率的影响 从图5可以看出,两种方法样品中总黄酮的得率都具有相同的变化趋势,总黄酮得率均随着乙醇浓度增大而增大,在浓度为80%时的总黄酮得率最大,之后开始下降。

图5 乙醇浓度对样品中总黄酮得率的影响Fig.5 Effect of ethanol concentration on total flavonoids yield
2.2 正交实验结果

表2 正交实验结果Table 2 Orthogonal test results
由表2正交实验直观分析可知,AlCl3显色法中各因素对总黄酮得率的影响顺序为:A>E>D>C>B。由表3方差分析可知,从统计学的角度而言,五个因素均为不显著性因素,得出最佳提取条件为A4B2C2D3E3,即:乙醇浓度85%,提取3次,料液比1∶25(g/mL),提取功率600W,提取80s。
由表2正交实验直观分析可知,Al(NO3)3显色法中各因素对总黄酮得率的影响顺序为:A>E>B>C>D。由表3方差分析表可知,从统计学的角度而言,五个因素均为不显著性因素,得出最佳提取条件是A1B2C3D3E3,即:乙醇浓度40%,提取3次,料液比1∶25(g/mL),提取功率700W,提取80s。
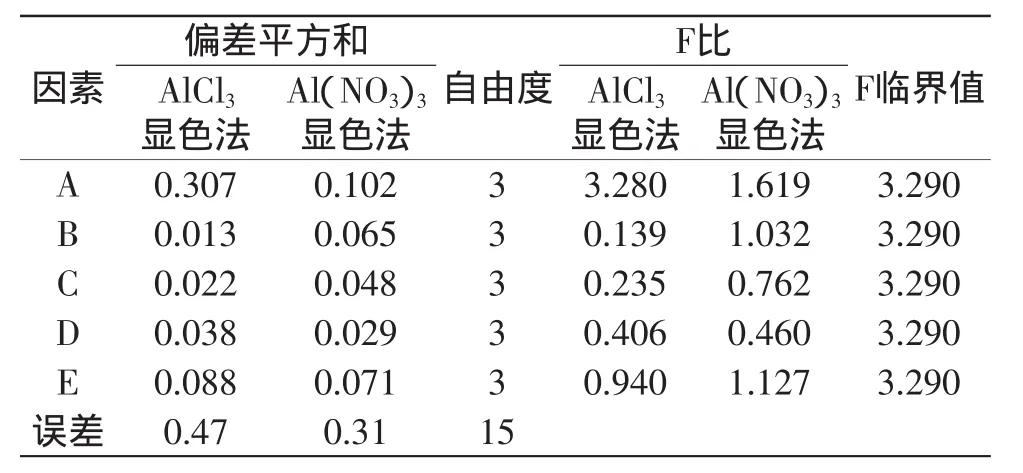
表3 AlCl3显色法总黄酮得率方差分析表Table 3 Intiutive analysis result of total flavonoids yield
2.2.1 最佳工艺条件的验证 在最佳提取工艺条件下提取,用相同方法检测,重复5次,AlCl3显色法检测的样品中总黄酮的平均得率是1.48%,RSD%=0.67,Al(NO3)3显色法检测的样品中总黄酮的平均得率是1.67%,RSD%=2.59,均与正交表的最高得率基本一致。表明利用两种显色方法测定,提取的总黄酮含量高,工艺稳定。
相比较而言,Al(NO3)3显色法测得的总黄酮的含量比AlCl3显色法测得的含量要相对高一些,文献中关于总黄酮的检测方法大多用Al(NO3)3显色法,因为在中性或者碱性的条件下,黄酮类化合物会与铝盐形成螯合物,Al(NO3)3显色法对于某些非黄酮类化合物在500nm处也有吸收,致使测得的含量比AlCl3显色法要高,提取工艺更稳定。
2.2.2 加标回收率实验 最佳提取工艺条件下的样品,加入芦丁标准品,分别用AlCl3和Al(NO3)3显色法检测出加标后样品中总黄酮含量,计算加标回收率,结果见表4。结果表明,两种显色方法的加标回收率均比较高而且比较稳定,从而说明总黄酮的两种显色法检测结果均准确、可靠。
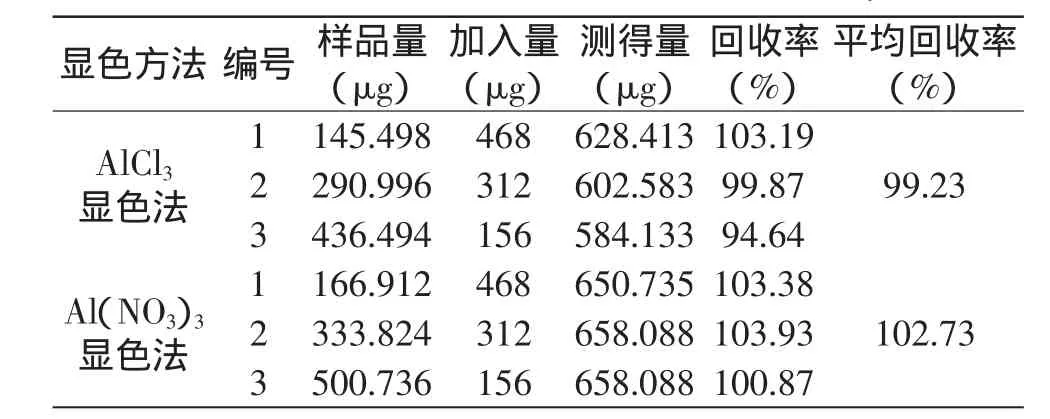
表4 加标回收率测定结果Table 4 Rusult of standard addition recovery
2.3 显色稳定性实验

图6 低温下稳定性实验Fig.6 Results of the stability in the refrigerator with 4℃

图7 室温下稳定性实验Fig.7 Results of the stability in room temperature

图8 阳光照射下稳定性实验Fig.8 Results of the stability under sunlight
如图6~图8所示,在低温(4℃)、室温和阳光照射下两种显色法供试品溶液吸光度随时间的延长虽有所变化,但总体变化不大,说明两种显色法是比较稳定的。
3 结论
本实验探究了明日叶中总黄酮的微波提取工艺,AlCl3显色法的最佳提取工艺为:乙醇浓度85%,提取3次,料液比1∶25(g/mL),提取功率600W,提取80s,样品中总黄酮得率为1.48%;Al(NO3)3显色法的最佳提取工艺为:乙醇浓度40%,提取3次,料液比1∶25(g/mL),提取功率700W,提取时间80s,样品中总黄酮得率为1.67%,工艺合理、简单、稳定性好。
同时,探究了AlCl3和Al(NO3)3两种显色方式的分光光度法检测明日叶中的总黄酮,两种显色检测方法简单、可靠,Al(NO3)3显色法测得的总黄酮得率要稍高于AlCl3显色法。显色溶液在室温下、阳光照射下、低温避光下具有良好的稳定性。
[1]赵国平,新关稔,石川隆二,等.中日当归属药用植物ITS序列分析[J].中草药,2006,37(7):1072-1076.
[2]Akihisa T,Tokuda H,Ukiya M,et al.Chalcones,coumarins and flavanones from the exudate of Angelica keiskei and their chemopreventive effects[J].Cancer Lett,2003,201:133-137.
[3]孟扬,钟进义,孙赫.明日叶查尔酮对小鼠肝癌细胞PCNA和BCL-2蛋白表达的影响[J].毒理学杂志,2011,23(1):50-53.
[4]邓良利,丁汉平,刘斌.明日叶保健茶的毒性及致突变和致畸性[J].现代预防医学,2003,30(1):26-28.
[5]Wang Y,Chan FL,Chen S,et al.The plant polyphenol butein inhibits testosterone-induced proliferation in breast cancer cells expressing aromatase[J].Life Sci,2005,77(1):39-51.
[6]Tuchinda P,Reutrakul V,Claeson P,et al.Antiinflammatory cyclohexenyl chalcone derivatives in Boesenbergia pandurata[J]. Phytochemistry,2002,59(2):169-173.
[7]王倩,常丽新,唐红梅.黄酮类化合物的提取分离及其生物活性研究进展[J].河北理工大学学报:自然科学版,2011,33(1):110-115.
[8]陈季武,朱振勤,杭凯,等.八种天然黄酮类化合物的抗氧化构效关系[J].华东师范大学学报:自然科学版,2002(1):90-94.
[9]沈玥,张永忠.红三叶草异黄酮抗氧化活性的研究[J].食品与发酵工业,2009,35(11):112-124.
[10]Meings JB,Larson MG,Fox CS,et al.Association of oxidative stress,insulin resistance and diabetes risk phenotypes:the Framingham offspring study[J].Diabetes Care,2007,30(10):2529-2535.
[11]赵二劳,赵小花,范建凤.金莲花黄酮微波辅助提取及其抗氧化性[J].食品与生物技术学报,2009,28(1):81-85.
[12]刘树兴,齐香君,庞振.芦笋中芦丁的提取及其鉴定[J].食品工业科技,2001,22(4):39-41.
[13]颜流水,黄智敏,胡臻恺,等.藜蒿中黄酮类化合物的微波辅助萃取研究[J].分析实验室,2006,25(3):66-69.
[14]孙晓海,郑媛虹,胡雪,等.微波辅助提取墨旱莲总黄酮的工艺优化[J].南京工业大学学报:自然科学版,2011,33(2):70-73.
[15]杨兵,余明,吴晓蕾,等.微波萃取蒲公英中总黄酮工艺的优化[J].安徽农业科学,2011,39(8):4559-4561.
Study on microwave-assisted extraction and determination of total flavonoids from Angelica Keiskei Koidzumi
ZOU Yu-lan1,SHAN Hu2,GAO Gui-yu1,LV Hai-tao1,*
(1.College of Chemistry and Pharmaceutical Sciences,Qingdao Agricultural University,Qingdao 266109,China;2.Department of Animal Science and Technology,Qingdao Agricultural University,Qingdao 266109,China)
The extraction and determination techniques of total flavonoids in Angelica Keiskei Koidzumi were investigated.The microwave-assisted extraction progress of total flavonoids was studied to get the optimum conditions by single factor and orthogonal experiments.The content of total flavonoids was determined by ultraviolet-visible spectrophotometer with AlCl3and Al(NO3)3developing methods,respectively.The optimum conditions of AlCl3developing method were 85%ethanol concentration,extraction 3 times,600W microwave power,1∶25 of material to liquid ratio,80 seconds extraction time.Under these conditions,the total flavonoids yield was 1.48%.The optimum conditions of Al(NO3)3developing method were 40%ethanol concentration,extraction 3 times,700W microwave power,1∶25 of material to liquid ratio,80 seconds extraction time.Under these conditions,the total flavonoids yield was 1.67%.The preliminary study for the stability of chromogenic solution was also investigated.
Angelica Keiskei Koidzumi;total flavonoids;orthogonal test;microwave-assisted extraction
TS201.1
B
1002-0306(2012)05-0201-05
2011-06-14 *通讯联系人
邹毓兰(1986-),女,在读硕士研究生,研究方向:天然产物化学及其应用研究。
国家十二五科技支撑课题(2011BAD34B03);青岛农业大学重点项目(610608)。
