荔枝干微生物菌落分析及其霉菌的分离鉴定
2012-11-15杨韦杰徐玉娟唐道邦吴继军肖更生
杨韦杰,徐玉娟,唐道邦,吴继军,肖更生,*
(1.江西农业大学生物科学与工程学院,江西南昌330045;2.广东省农业科学院蚕业与农产品加工研究所,广东省农产品加工重点实验室,广东广州510610)
荔枝干微生物菌落分析及其霉菌的分离鉴定
杨韦杰1,2,徐玉娟2,唐道邦2,吴继军2,肖更生2,*
(1.江西农业大学生物科学与工程学院,江西南昌330045;2.广东省农业科学院蚕业与农产品加工研究所,广东省农产品加工重点实验室,广东广州510610)
为了研究荔枝干贮藏销售期内普遍存在的微生物超标及霉变问题,对市场零售的散装荔枝干样品进行了微生物数量的测定,并对散装和真空包装的荔枝干样品中的霉菌进行了分离、纯化、鉴定。结果表明:20%样品菌落总数>750cfu/g,80%样品霉菌总数>50cfu/g,抽样合格率为20%;从荔枝干样品中分离得到5株霉菌,通过形态学观察鉴定为黄曲霉、黑曲霉、烟曲霉、红曲霉和黑绿青霉,并确定曲霉属菌株为荔枝干表面霉菌的优势菌群。
荔枝干,霉变,霉菌,鉴定
荔枝(Litchi Chinensis Sonn)是我国华南地区的大宗特色水果,果实风味独特,营养丰富。由于其成熟于盛夏季节、产期集中和不耐贮藏运输等特点,新鲜荔枝如不及时销售,短期内就会失去经济价值。荔枝干加工对新鲜原料处理量大,同时可以延长果实货架期、降低储运成本,是解决季节性供需矛盾的有效途径,现已成为荔枝加工的主要形式,占加工总量的80%以上[1]。荔枝干加工多采用日晒法、火焙法和热风干燥法,加工工艺粗放,技术水平参差不齐,品质差异很大。成品一般不经过后杀菌技术,包装方式简陋。因此,荔枝干在贮存销售过程中存在发霉、微生物指标超标等风险,这不但给生产者和中间商带来经济损失,更重要的是对消费者身体健康构成潜在威胁[2]。目前,学者们对荔枝干制加工过程的研究主要集中在干燥加工工艺和理化性质变化方面,对荔枝干食品安全控制研究较少。本文从微生物学角度,通过荔枝干霉变微生物的分离鉴定,研究荔枝干霉腐微生物的优势菌群和种类,以期获得荔枝干贮藏销售过程中控制霉变,保证其安全卫生的有效途径和方法。
1 材料与方法
1.1 材料与设备
实验共采集8份荔枝干(整果)样品 1~5号样品购自广东广州市天平架水果交易市场,包装方式散装,6~8号样品采自广东惠州市四季鲜绿色食品有限公司,已出现霉变特征,包装方式真空包装;细菌、放线菌、酵母和霉菌计数培养基 分别采用营养琼脂培养基(NA)、高氏一号培养基、麦氏培养基和孟加拉红培养基;分离、纯化真菌用培养基 马铃薯葡萄糖琼脂培养基(PDA);鉴定用培养基 察氏琼脂培养基(CA),以上培养基均121℃灭菌20min备用,配制方法见文献[3];乳酸苯酚棉兰固定液 苯酚10g,乳酸10g,甘油20g,棉兰0.05g,蒸馏水10mL,将苯酚置于水浴中加热至结晶溶解,然后加入乳酸、甘油和棉兰[4],以上试剂均为国产分析纯。
DMLB2显微镜 德国LEICA公司;ALC-210.4电子天平 德国ACCULAB公司;SW-CJ-1F垂直净化工作台 上海阳光实验仪器有限公司;YXQ-LS-50SⅡ立式压力蒸汽灭菌锅、SPX-250B-Z生化培养箱 上海博讯实业有限公司;其他为常规实验仪器。
1.2 实验方法
1.2.1 荔枝干表面微生物的菌落计数 称取25g完整无破壳荔枝干样品(约5粒)置于盛有225mL无菌生理盐水的带玻璃珠锥形瓶中,振荡摇匀,制成1∶10的样品匀液,按常规方法进行平板稀释分离,细菌于37℃倒置培养2d,放线菌、霉菌和酵母于28℃倒置培养4~7d,计数观察。
1.2.2 霉菌分离纯化 采用平板划线分离法。无菌条件下,挑取霉菌单菌落划线于PDA平皿上,于28℃倒置培养4~6d,待菌种纯化后用于形态观察接种。若菌落菌体不纯,含有杂菌时,可重新划线分离,直至菌体纯化为止。
1.2.3 菌种鉴定培养 采用标准培养条件培养菌种,用于形态观察。无菌条件下,用接种针挑取纯化分离平皿中的单菌落孢子,对称3点接种于倒置拿取的CA平皿,接种时应避免孢子散落于平皿其他位置[5]。于25℃倒置培养7d后进行菌种鉴定,鉴定方法依照参考文献[6-9]。
1.2.4 菌落形态观察 用肉眼直接观察平皿上的菌落大小、颜色、质地、渗出物等形态特征。
1.2.5 显微形态观察 使用载片培养法[7]观察菌丝体分支、子实体着生状态和分生孢子头的大致情况;使用插片培养法[10]观察青霉帚状枝分支状况;使用乳酸苯酚棉兰固定液制成的临时装片,观察霉菌各器官的细节。
2 结果与分析
2.1 荔枝干样品中主要微生物及其数量
通过平板稀释分离,对1~5号荔枝干样品中的细菌、放线菌、酵母和霉菌的数量进行了测定,结果见表1。5个样品中,细菌数占微生物总数的21.43%~61.54%,酵母菌数占微生物总数的20.00%~53.57%,霉菌数占微生物总数的5.77%~26.07%。所有样品均未分离到放线菌,可能是由于荔枝干果壳表面营养物质和较低的水分活度不适合放线菌的生长。
由荔枝干表面各微生物检测结果分析,各类菌群的检测值都较低,但样品总合格率仅为20%。荔枝干标准NY/T 709-2003中规定:成品荔枝干菌落总数≤750cfu/g,霉菌数≤50cfu/g。随着贮藏期的延长,1~5号样品中除5号样品微生物总数超标外,其他样品菌落总数均在标准规定范围内;只有2号样品的霉菌数量在标准规定范围内,其余样品均超标,可见荔枝干霉菌数量超标是其微生物菌落总数超标的重要原因。
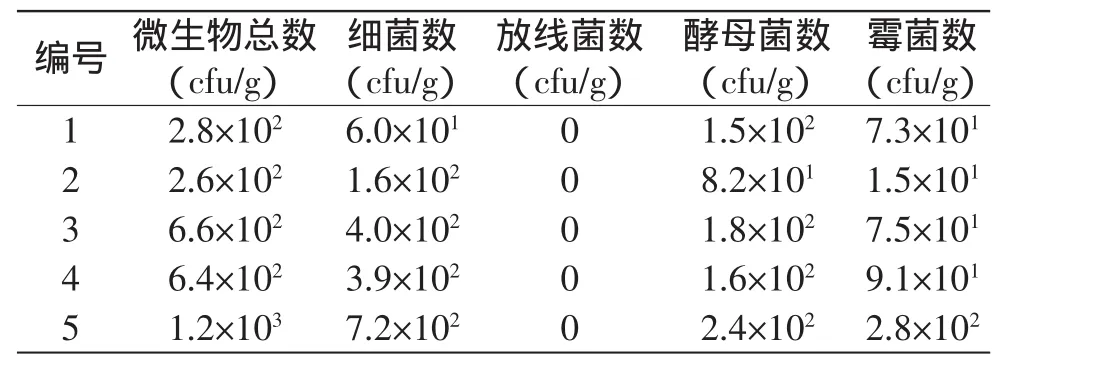
表1 荔枝干样品表面微生物的种类及数量Table 1 Species and amount of microbes on the surface of dried litchi
2.2 样品中霉菌种类特征
1~8号荔枝干样品霉菌种类特征的分析可知8个样品中分离到的霉菌有曲霉属(Aspergillus)、青霉属(Penicillium)和红曲霉属(Monascus)共3个属,结果见表2。其中曲霉属在8个样品中均分离得到,检出率为100%,说明曲霉属的菌株为荔枝干表面霉菌的优势菌群。6~8号样品采自真空包装后,具霉变特征的荔枝干样品,结果更具代表性。曲霉属真菌是自然界分布最普遍的腐生菌之一。多种曲霉与谷物、食品、饲料、药材、烟草等商品的劣化有密切关系,在湿热条件下尤为严重。
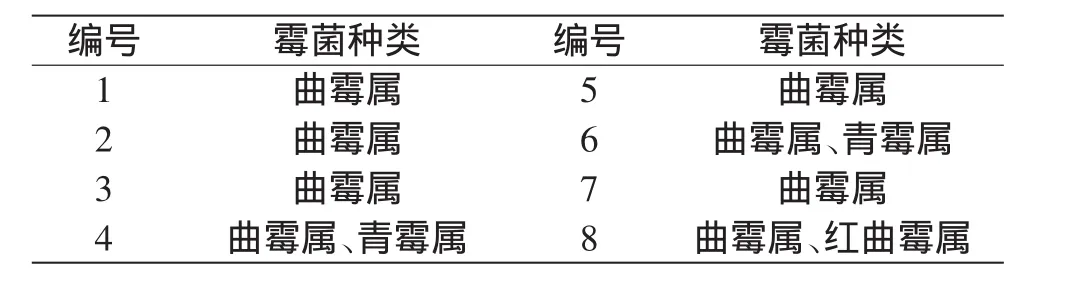
表2 荔枝干样品中所含霉菌种类Table 2 Genus of mould on the surface of dried litchi
2.3 样品中霉变真菌的鉴定
从8个样品中共分离纯化出5株霉菌,分别编号为L1、L2、L3、L4和L5,鉴定结果如下:
L1菌株:菌落在CA培养基上生长较快,25℃培养7d,直径38~45mm;质地丝绒状,中央部分絮状;分生孢子结构大量,初为淡黄色,渐变为黄绿色,老后色泽变暗,反面无色或稍带褐色;菌落平坦,具不明显放射状皱纹;分生孢子头幼为球形,后呈疏松放射状。分生孢子梗生于基质,粗糙;顶囊近球形或烧瓶形,大部分表面可育,极少者仅上部可育;小梗双层,偶见单层;分生孢子球形,光滑。该菌株鉴定为:半知菌亚门、丝孢纲、丝孢目、丛梗孢科、曲霉属、黄曲霉群,形态特征如图1和图2所示。

图1 L1菌株菌落形态Fig.1 Colonial morphology of strains L1

图2 L1菌株分生孢子头形态(640×)Fig.2 Conidial head structure of strains L1(640×)
L2菌株:菌落在CA培养基上生长迅速,25℃培养7d,直径55~60mm;质地呈致密丝绒状;分生孢子结构大量,呈黑色或炭黑色,反面无色或淡黄色;菌落平坦,具规则放射状沟纹;渗出液少量,无色;分生孢子头幼时球形,老后呈辐射状;分生孢子梗生于基质,平滑;顶囊球形,全部表面可育,小梗双层;分生孢子球形,壁粗糙具突起。该菌株鉴定为:半知菌亚门、丝孢纲、丝孢目、丛梗孢科、曲霉属、黑曲霉群,形态特征如图3和图4所示。
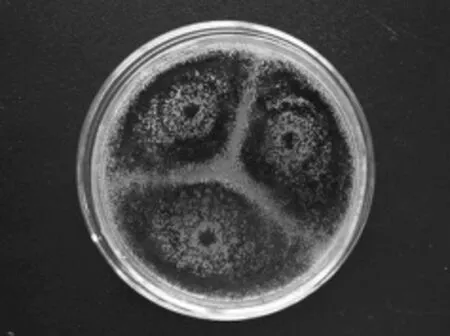
图3 L2菌株菌落形态Fig.3 Colonial morphology of strains L2

图4 L2菌株分生孢子头形态(640×)Fig.4 Conidial head structure of strains L2(640×)
L3菌株:菌落在CA培养基上生长迅速,25℃培养7d,直径50~55mm;质地丝绒状兼有少量絮状;分生孢子结构较少,浅灰绿色,老后颜色加深,反面无色或浅绿色;菌落平坦,渗出液少量,无色;具轻霉味;分生孢子头呈短柱状;分生孢子梗生于基质;顶囊烧瓶形,全部表面部分可育,小梗单层;分生孢子近球形,粗糙。该菌株鉴定为:半知菌亚门、丝孢纲、丝孢目、丛梗孢科、曲霉属、烟曲霉群,形态特征如图5和图6所示。
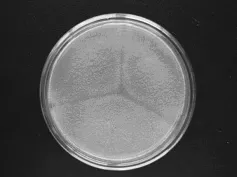
图5 L3菌株菌落形态Fig.5 Colonial morphology of strains L3

图6 L3菌株分生孢子头形态(640×)Fig.6 Conidial head structure of strains L3(640×)
L4菌株:菌落在察氏琼脂培养基(CA)生长较慢,25℃培养7d,直径15~18mm;质地絮状;菌丝初为白色,老后转为褐色,反面红褐色,偶有鲜红色色素;气生菌丝生于基质,与培养基结合较紧密。菌丝有隔,分支繁杂,多核,规律性缢缩,出现菌丝节;无明显分化的分生孢子梗;分生孢子串生,3~9个成链,球形或梨形;闭囊壳球形,无孔口,子囊球形。该菌株鉴定为:真子囊菌亚纲、曲霉目、曲霉科、红曲霉属,形态特征如图7和图8所示。
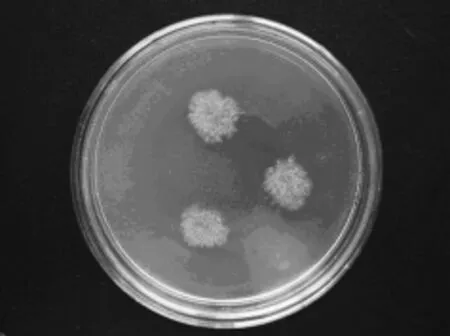
图7 L4菌株菌落形态Fig.7 Colonial morphology of strains L4
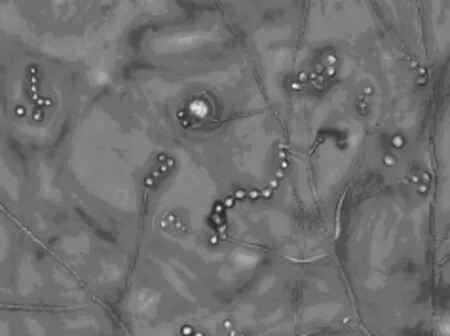
图8 L4菌株分生孢子形态(400×)Fig.8 Conidium morphology of strains L4(400×)
L5菌株:菌落在CA培养基上25℃培养7d,直径26~28mm;质地绒状;分生孢子结构大量产生,分生孢子面中央部分暗绿色,边缘蓝绿色,反面棕褐色;菌落平坦,中间有脐状突起,幼时菌落外延可见同心环纹,老后不明显;菌丝体白色,无渗出液;分生孢子梗生于基质,与培养基结合不紧密;菌丝有隔;帚状枝三轮生,紧密;瓶梗呈瓶状至披针形;分生孢子近球形,光滑。该菌株鉴定为:半知菌亚门、丝孢纲、丝孢目、丛梗孢科、青霉亚属、扩展青霉系、黑绿青霉,形态特征如图9和图10所示。
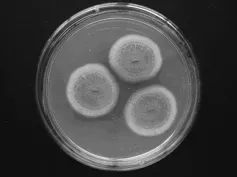
图9 L5菌株菌落形态Fig.9 Colonial morphology of strains L5

图10 L5菌株帚状枝形态(640×)Fig.10 Penicillus morphology of strains L5(640×)
3 结论与讨论
荔枝干表面各类微生物的菌落计数结果表明,市场上销售的散装荔枝干卫生状况较差。80%样品的霉菌总数>50cfu/g,少数未达标产品的霉菌总数为标准规定范围的5.6倍(2.8×102cfu/g),污染严重;通过对荔枝干表面霉菌的分离、培养和鉴定,发现黄曲霉、黑曲霉、烟曲霉、红曲霉和黑绿青霉等多种霉菌可能与荔枝干贮藏销售期产生的霉变损失有关,其中曲霉属菌株是引起荔枝干霉变的优势菌群。由于曲霉属不少菌株具有适高温和高渗透压的特性,这种特性可能是其能够适应荔枝干果壳表面干燥环境,并成为霉菌优势菌群的一个重要原因[11-12]。
成品荔枝干的水分含量≤25%,含糖量高、水分活度(Aw)较低,不适合多数微生物的生长[13],但由于荔枝干成品缺乏科学有效的后杀菌技术和简陋的贮藏条件,再加上荔枝干加工多集中于广东、广西、福建等气候湿润、年平均气温较高的省份。随着贮藏期的延长,成品缓慢吸水致水分含量逐渐升高,挤压碰撞导致的破壳果数量不断上升,使得霉变的风险不断加大。个别处理不当的情况下,荔枝干经过3~4个月的时间可有60%以上有虫害或发霉现象[14]。
市场上荔枝干成品包装多采用散装形式,产品直接与空气接触,贮藏销售过程中由美拉德反应引起的非酶褐变导致果皮、果肉颜色不断加深,这些不但造成氨基酸、糖类等营养物质的损失,而且使得产品的竞争力和消费者的购买欲下降。真空包装的荔枝干虽然在一定程度上解决了成品色泽加深的问题,但有学者研究表明,采用真空包装的荔枝干产品的保存期较短[15]。本实验部分霉菌分离自真空包装内发生霉变的荔枝干,也证明了上述说法的合理性。这可能是由于真空包装不能做到绝对真空,包装内的氧气含量导致部分好氧性微生物无法生长,破坏了原本微生物群落各菌群间的拮抗作用,使得少数适应性较强的霉菌逐渐繁殖,导致霉变的发生。
随着社会的发展,消费者对健康的要求越来越高,对产品的质量要求日益严格,荔枝干加工产业的科技化投入需不断加强。首先应从高效合理的干燥技术和工艺研究入手,并将HACCP引入荔枝干生产,以提高产品的质量和安全;其次应探求科学合理的杀菌技术、贮藏条件和包装技术手段,进一步提高产品的质量档次。
[1]蔡长河,张爱玉,袁沛元,等.半干型荔枝干的加工技术研究[J].福建果树,2003,127(4):32-33.
[2]蔡长河,张爱玉,袁沛元,等.HACCP在荔枝干、龙眼干加工生产中的应用[J].食品科学,2003,24(8):73-74.
[3]沈萍,范秀容,李广武.微生物学实验[M].北京:高等教育出版社,1999:214-218.
[4]黄霞云,刘晶杰.真菌染色新方法的探索[J].实用医技杂志,2006,13(11):1862-1863.
[5]Klich M A.Identification of common Aspergillus species[M]. Netherlands:Ponsenamp;Looijen,2002:5-10.
[6]魏景超.真菌鉴定手册[M].上海:上海科学技术出版社,1979:58-274.
[7]中国科学院微生物研究所常见与常用真菌编写组.常见与常用真菌[M].北京:科学出版社,1973:250-254.
[8]齐祖同.中国真菌志-曲霉属及其相关有性型[M].北京:科学出版社,1997.
[9]孔华忠.中国真菌志-青霉属及其相关有性型属[M].北京:科学出版社,2007.
[10]熊有枝,王展.采用微生物培养法制片观察菌体形态[J].武汉工业学院学报,2004,23(1):28-29.
[11]许大凤.储烟霉菌生物学特性及霉变控制措施研究[D].合肥:安徽农业大学,2005.
[12]王春红.柿饼霉变及其防霉技术研究[D].西安:陕西师范大学,2010.
[13]唐道邦,张友胜,徐玉娟,等.荔枝干颗粒重与果肉水分活度、微生物等指标相关性分析[J].广东农业科学,2010(10):29-30.
[14]蔡长河,张爱玉,袁沛元,等.荔枝干、龙眼干安全食品的加工[J].中国南方果树,2004,33(2):34-35.
[15]罗树灿,李远志,彭伟睿,等.热风和微波结合干燥荔枝加工工艺研究[J].现代食品科技,2006,22(3):10-13.
Analysis of microorganism colonies and isolation,identification of microorganism causing mold damage from dried litchi
YANG Wei-jie1,2,XU Yu-juan2,TANG Dao-bang2,WU Ji-jun2,XIAO Geng-sheng2,*
(1.College of Bioscienceamp;Bioengineering,Jiangxi Agricultural University,Nanchang 330045,China;2.Guangdong Key Laboratory of Agricultural Product Processing,Sericulture and Farm Product Processing Research Institute,Guangdong Academy of Agricultural Sciences,Guangzhou 510610,China)
In order to study the microbiological control and mold damage of dried litchi in storage period,the colony counts of microorganism from dried litchi sample in bulk and the fungi causing mold damage from vacuum and bulk packaging of sample were analyzed.The result indicated that total microbial count of 20% sample was greater than 750cfu/g,total fungi count of 80%sample was greater than 50cfu/g,and the eligibility rate was 20%.Five strains of mould include Aspergillus flavus,A.niger,A.fumigatus,Monascus and Penicillium atramentosum were separated and purified from vacuum and bulk packaging of dried litchi and the dominate microorganism of mould were identified as Aspergillus.
dried litchi;mildew;mould;identification
TS201.3
A
1002-0306(2012)05-0152-04
2011-05-16 *通讯联系人
杨韦杰(1985-),男,在读硕士研究生,研究方向:食品生物技术。
广东省科技计划项目(2009A020101002);广东省科技计划项目(2010B080100026);广东省现代农业产业技术体系建设专项。
