红衣组分对花生分离蛋白及其酶解产物理化和抗氧化性质的影响
2012-11-15杨晓泉刘远洋任晓鸣
顾 炜,杨晓泉,*,刘远洋,郭 健,任晓鸣
(1.华南理工大学轻工与食品学院,食物蛋白工程研究中心,广东广州510640;2.黑龙江八一农垦大学食品学院,黑龙江大庆163319)
红衣组分对花生分离蛋白及其酶解产物理化和抗氧化性质的影响
顾 炜1,杨晓泉1,*,刘远洋2,郭 健1,任晓鸣1
(1.华南理工大学轻工与食品学院,食物蛋白工程研究中心,广东广州510640;2.黑龙江八一农垦大学食品学院,黑龙江大庆163319)
以花生为原料,研究了花生红衣组分对花生分离蛋白及其酶解产物理化和抗氧化性质的影响。研究结果表明:含红衣的分离蛋白酶解速度低于不含红衣的;相同水解度条件下,含红衣的表面疏水性小于脱红衣的;GPC分布中,含红衣的峰值大于脱红衣的;红衣组分能够提高花生分离蛋白及其酶解产物的溶解性、乳化稳定性、乳化活性;在相同水解度条件下,含红衣的水解产物多酚含量显著高于脱红衣的,多酚含量的差异与花生分离蛋白及其水解产物的抗氧化性具有正相关性。
红衣,花生分离蛋白,水解产物,理化性质,抗氧化活性
花生粕作为花生加工的副产物,在我国产量较为丰富,每年在花生榨油后,可得到约125万t的花生粕[1],花生粕含蛋白质40%以上[2],在植物蛋白资源中,花生蛋白居第三位,占蛋白总量的11%,是较理想食用蛋白资源[3]。多酚类物质广泛存在于植物体内,对植物蛋白的理化、营养及结构性质有着不容忽视的影响。国外文献报道,多酚类物质能够提高蛋白的溶解性[4]、乳化性和起泡性[5]、热稳定性[6];多酚类物质能够提高蛋白的抗氧化性[7],因此,系统地比较研究多酚对蛋白各方面性质的影响,对于植物蛋白改性、深加工都有重要意义。花生衣是花生产品的副产物,资源丰富,价格低廉,含有多种黄酮类多酚物质、具有抗氧化,阻碍蛋白糖化反应的作用[8-9],从中提取的花生衣红色素营养价值和医用价值都很高,而且还具有良好的抗氧化能力,因此在食品、医药等行业中将有良好的应用前景[10]。本文以花生为原料,研究了花生红衣组分对花生分离蛋白及其水解产物理化和抗氧化性质的影响,为植物蛋白理化功能性质的改善提供数据支持,对植物蛋白的深加工和相关的保健品开发都有积极的意义。
1 材料与方法
1.1 材料与仪器
花生 购于广州市五山金莎超市;碱性蛋白酶 诺维信生物技术有限公司;所用化学试剂 均为分析纯。
CR22G高速冷冻离心机 日本日立公司;Master2000粒度分布仪 英国Malvern公司;高效液相色谱仪Waters1525 美国Waters公司;荧光分光光度计F-7000 日本日立公司;紫外-可见分光光度计2501PC 日本岛津公司;高压微射流纳米均质机M-110EH 美国Microfluidics公司。
1.2 实验方法
1.2.1 花生分离蛋白的制备 将脱红衣和不同红衣的花生用正己烷脱脂后,所得花生粕打粉,以1∶15(w/v)加入蒸馏水后调pH至9.0,室温缓慢搅拌2h过筛,离心(6500×g,20min,25℃),取上清液调pH至4.5,离心(6500×g,20min,25℃),取沉淀以1∶10加水调pH至7.5透析,冷冻干燥得到花生分离蛋白样品。
1.2.2 花生浓缩蛋白的限制性水解 配制浓度为2%的花生分离蛋白分散液于恒温水浴中,加入一定量的碱性蛋白酶进行水解,根据pH-stat法[11-12],用0.5N NaOH调节pH,绘制水解曲线。根据水解曲线,确定水解度为DH5、DH10和DH15的水解时间。
1.2.3 表面疏水性(H0) 表面疏水性的测定采用ANS荧光探针法[13]。将待测蛋白样品溶于10mmol/L磷酸缓冲液(pH7.0)中,蛋白质浓度为1.5%(w/v)。向含4mL磷酸缓冲液的塑料离心管中分别添加10、20、30、40、50μL 1.5%的蛋白质溶液,在测试前添加20μL 8mmol/L ANS储液,振荡均匀,在8~15min内采用天美荧光分光光度计检测样品的荧光强度(FI)。激发和发射波长分别为390nm和470nm,激发和发射狭缝宽均为5nm。样品的荧光强度值扣除试剂空白值即为蛋白的相对荧光强度值。以相对荧光强度对蛋白质浓度作图,其初始段的斜率作为蛋白质的表面疏水性指数(H0)。
1.2.4 分子量分布的测定 采用凝胶过滤色谱(GPC)方法。用50mmol/L磷酸盐缓冲液(pH7.2)将样品配制成质量浓度为5‰的溶液,搅拌1.5h,1000r/min离心,上清液过0.2μm过滤器,上样量10μL,过G2000SWXL凝胶过滤柱,上样后用50mmol/L磷酸盐缓冲液(pH7.2)洗脱,Waters1525高效液相色谱控制流速0.7mL/min,测定280nm波长处的吸光度。
1.2.5 溶解度曲线的测定[14]称取8份100mg蛋白样品分别分散于10mL的去离子水中,室温下磁力搅拌30min,然后用1mol/L NaOH或HCl溶液调节溶液的pH到2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0,再搅拌30min后,在20℃离心(12000×g,20min)。上清液经过适度稀释后,采用Lorry法[15]测定蛋白质含量,以牛血清白蛋白(BSA)为标准物做标准曲线。蛋白质的溶解度表示为上清液蛋白浓度占总蛋白浓度的百分比。
1.2.6 乳液粒度分布的测定 向10mmol/L磷酸盐缓冲液(pH7.0)中添加0.5%蛋白,10%油,通过微射流处理制备乳液,采用粒度分布仪测定乳液中粒子大小及其分布,计算表面积平均粒径d3,2。
1.2.7 多酚(黄酮)含量的测定 参考Carbonaro等[16]的方法。用0.1mol/L的NaOH溶液配制1mg/mL的样品溶液,充分振荡混匀,10000×g离心15min,于328nm处测定吸光度A1(总多酚),之后加入5%质量分数的三氯乙酸(TCA),沉淀蛋白质,10000×g离心15min,于328nm处测定吸光度A2(游离多酚),A1-A2即为结合多酚对应的吸光度值。多酚含量以“g芦丁当量/100样品”为单位,通过以芦丁为标样的标准曲线计算。
1.2.8 DPPH·清除能力的测定 参考Shimada等[17]的方法。配制浓度为1mg/mL蛋白贮液,稀释成浓度为0、0.1、0.2、0.4、0.6、0.8、1.0mg/mL的样品溶液各2mL,加入0.2mmol/mL的DPPH乙醇溶液(现配)2mL,振荡摇匀,在室温下放置30min后,以无水乙醇为空白,于517nm处测定吸光值。DPPH·清除率(%)=[1-(AS/Ab)]×100%,式中,AS为样品溶液对应吸光度值;Ab为蒸馏水对应吸光值。
2 结果与讨论
2.1 红衣组分对花生分离蛋白水解产物理化性质的影响
2.1.1 红衣组分对花生分离蛋白水解曲线的影响 水解度(DH)变化曲线如图1所示,在水解开始的1h内,DH增加最快,但是在3h到4h之间,随着时间的增加,DH增加速度明显减小。随着E/S比例的提高,水解度DH增速在25min内明显提高,在180min以后,增速明显减小。比较脱红衣、含红衣的水解曲线,相同E/S比例、相同时间下,不含红衣的水解度明显高于含红衣的水解度,说明经脱红衣处理的分离蛋白更易被碱性蛋白酶水解。因为红衣成分主要是多酚类物质,脱红衣处理减少了多酚与蛋白的反应,使碱性蛋白酶的作用位点保持活性;同时较低的酚含量也降低了多酚与蛋白酶相互作用的几率,Sripad[18]等研究表明多酚的存在对蛋白的酶水解有一定的抑制作用。
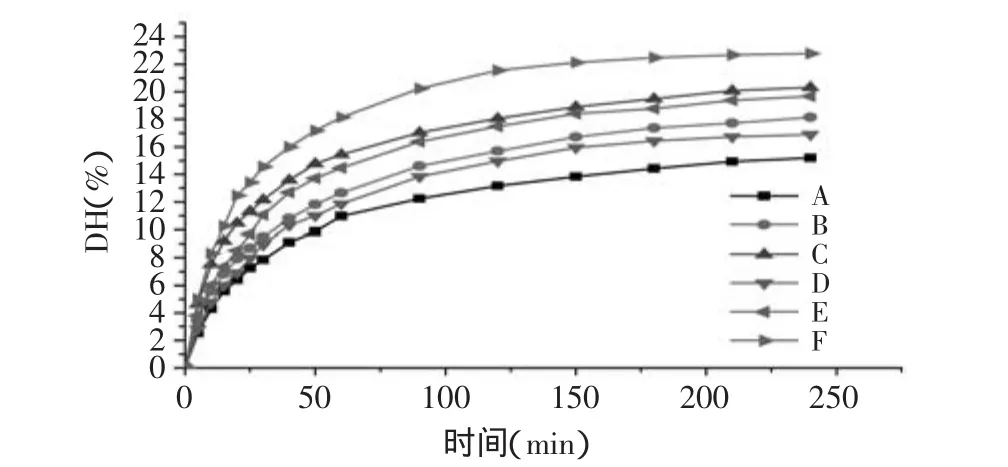
图1 红衣组分对花生分离蛋白水解曲线的影响Fig.1 Effect of peanut red skin on the hydrolysis curve of PPI at different E/S ratio
考虑到限制性酶解的可控性,若按E/S 2∶100或者4∶100进行酶解,在短时间内就达到DH5,不利于酶解时间的控制;同时为了节约酶制剂的使用量,本研究采用E/S 1∶100的水解度曲线进行限制性酶解,根据水解度曲线,分别酶解脱红衣、含红衣花生分离蛋白,以制备DH5、DH10、DH15的水解产物。
2.1.2 红衣组分对水解产物表面疏水性的影响 图2表明,水解产物的表面疏水性明显减小,可能的原因是:酶解将球蛋白或者聚集体中的表面疏水基团降解了;灭酶过程中同样会去除一些酶解产生的疏水性肽段或蛋白片段。图中,DH15的疏水性指数大于DH5和DH10的疏水性,可能是随着深度酶解的进行,酶解产生了更稳定的小分子量疏水性肽段。

图2 花生分离蛋白及其水解产物的表面疏水性指数Fig.2 Surface hydrophobicity of PPI and its hydrolysates
比较脱红衣、含红衣分离蛋白及其水解产物的表面疏水性,相同水解度条件下,含红衣的表面疏水性小于脱红衣的,因为红衣里面多酚类物质跟部分表面疏水基团结合,从而降低了表面疏水性。
2.1.3 红衣组分对水解产物GPC的影响 图3中,花生分离蛋白及其水解产物的分子量分布结果表明,酶解以后分子量明显减小,分离蛋白在9min处的吸收峰完全消失,而在17min处有一个较分离蛋白更大的吸收峰出现,说明酶解使得分离蛋白中的大分子变成了小分子,同时,随着水解度的增大,17min处的峰也增大,说明水解度增大,小分子物质增多。

图3 花生分离蛋白及其水解产物的分子量分布(GPC)Fig.3 GPC of PPI and its hydrolysates
不同样品的上样量均为10μL,相同水解度条件下,含红衣分离蛋白及其水解产物的峰值大于脱红衣,可能是因为图4中含红衣的溶解度大于脱红衣的,样品经离心处理后,含红衣样品中蛋白浓度大于脱红衣的,从而导致在相同上样量的条件下峰值也相应增大。
2.1.4 红衣组分对水解产物溶解性的影响 文献[19]报道花生多肽溶液能在较宽的pH范围内保持溶解状态,图4显示,酶解产物溶解度明显高于花生分离蛋白,而且随着水解度的增大,水解产物的溶解性也增大。相同水解度条件下,含红衣分离蛋白及其水解产物的溶解性好于脱红衣的,这跟文献[4]报道的多酚类物质与蛋白作用能够提高蛋白的溶解性相一致。
2.1.5 红衣组分对水解产物乳化性的影响 乳状液的粒度分布与表面积平均粒径(d3,2)可表征样品的乳化特性[20]。其中粒度分布在一定程度上可反映乳状液的稳定性;乳状液表面积平均粒径(d3,2)的大小可反映样品的乳化活性,一般d3,2较小则其乳化活性较好。
花生分离蛋白及其水解产物的乳状液粒度分布变化见图5,脱红衣PPI的粒度分布呈双峰分布,含红衣PPI的粒度分布呈单峰分布,且平均粒度小于脱红衣PPI,这表明红衣组分能够提高PPI的乳化稳定性。脱红衣、含红衣不同水解产物的粒度分布都呈双峰分布,但含红衣水解产物的平均粒度小于脱红衣的水解产物,这说明红衣组分也能够提高水解产物的乳化稳定性。

图4 花生分离蛋白及其水解产物溶解度的比较Fig.4 Solubility of PPI and its hydrolysates

图5 花生分离蛋白及其水解产物乳状液粒度分布的比较Fig.5 Particle size distribution of emulsions made with PPI and its hydrolysates

图6 乳状液表面积平均粒径的变化Fig.6 Mean diameter per particle surface area of emulsions made with PPI and its hydrolysates
从图6的表面积平均粒径变化来看,相同水解度条件下,含红衣水解产物的d3,2值小于不含红衣,3d以后,含红衣水解产物的d3,2增幅小于不含红衣的。这表明红衣成分能够提高水解产物的乳化活性,与文献[5]报道的多酚能够提高蛋白的乳化性相一致。
图6表明,DH5的d3,2值小于分离蛋白的d3,2值,说明DH5的乳化活性较强,这是因为限制性酶解将分离的刚性结果部分切割成柔性结构,使分子的结构变得柔软,具有更高的乳化活性,但是随着水解程度的进一步增大(DH10、DH15),水解蛋白分子变为更小的短肽,无法很好地在油水界面上形成具有一定粘弹性的界面膜以防止油滴聚集成大粒子,所以乳化活性与稳定性较差。
2.2 红衣组分对花生分离蛋白水解产物抗氧化性的影响
2.2.1 红衣组分对水解产物多酚含量的影响 图7比较了花生分离蛋白在酶解过程中多酚含量及结合方式的变化,包括总酚含量、共价结合酚以及以弱电作用结合的游离酚含量,花生分离蛋白总多酚含量、游离多酚含量最多,水解产物总多酚含量、游离多酚含量减少。但是随着水解度的增大,总多酚含量、游离多酚含量也增多。由于红衣富含多酚类物质,所以相同水解度条件下,含红衣的水解产物多酚含量显著高于脱红衣的。

图7 花生分离蛋白及其水解产物的多酚含量比较Fig.7 Polyphenol contents of PPI and its hydrolysates
2.2.2 红衣组分对水解产物DPPH·清除能力的影响图8中,以抗氧化剂BHT为参比,BHT在0.1mg/mL时的清除率达到86%,远高于同浓度下其他被测样品的抑制率。相同水解度条件下,含红衣水解产物的清除率明显高于脱红衣的,联系多酚含量的分析数据可知(图7),多酚含量的差异与花生分离蛋白及其酶解产物的DPPH·抑制率存在较大正相关性,较高的酚含量,尤其是游离酚含量有助于提高DPPH自由基清除率。

图8 花生分离蛋白及其水解产物清除DPPH·能力比较Fig.8 DPPH·radical scavenging activity of PPI and its hydrolysates
酶解之后,分离蛋白对应酶解产物的清除能力均有所减弱,酶解产物中DH15的清除能力最强,含红衣的样品浓度达到1.0mg/mL时,DH15的DPPH·抑制率为46.9%。
3 结论
本研究比较了红衣组分对花生分离蛋白酶解产物理化和抗氧化性质的影响,研究发现:红衣的存在对蛋白的酶解有一定的抑制作用,含红衣的分离蛋白酶解速度低于不含红衣的;相同水解度条件下,含红衣的表面疏水性小于脱红衣的,GPC分布中,含红衣的峰值大于脱红衣的;红衣组分能够提高花生分离蛋白及其酶解产物的溶解性、乳化稳定性、乳化活性;在相同水解度条件下,含红衣的酶解产物多酚含量显著高于脱红衣的,多酚含量的差异与花生分离蛋白及其酶解产物的抗氧化性具有正相关性,较高的酚含量,能提高DPPH自由基清除率。
[1]刘传富,张兆静.花生蛋白及其在食品中的应用[J].中国食物与营养,2005(1):24-25.
[2]杨伟强,禹山林,袁涛.碱提酸沉法制取花生分离蛋白工艺研究[J].花生学报,2008,37(4):12-17.
[3]Ramachandran S,Singh S K,Larroche C,et al.Oil cakes and their biotechnological applications:a review[J].Bioresource Technology,2007,98(10):2000-2009.
[4]Siebert K.Nature of polyphenol-protein interaction[J].Journal of Agricultural and Food Chemistry,1996,44:80-85.
[5]Sarker DK,Wi1de PJ,C1ark DC.Control of surfactant-induced destabilization of foams through polyphenol mediated proteinprotein interactions[J].Journal of Agricultural and Food Chemistry,1995,43:295-300.
[6]O'Connell JE,Fox PD,Tan-Kintia R,et al.Effect of tea,coffee,and cocoa extracts on the colloidal stability of milk and concentrated milk[J].International Dairy Journal,1998,8:689-693.
[7]Rohn S,Rawel HM,Kroll J.Antioxidant activity of proteinbound quercetin[J].Journal of Agricultural and Food Chemistry,2004,52(15):4725-4729.
[8]亦森.花生皮生理活性功能[J].粮食与油脂,2001(4):44-45.
[9]Yu Jianmei,Mohamed Ahmedna,Ipek Goktepel.Effects of processing methods and extraction solventson concentration and antioxidant activity of peanut skin phenolics[J].Food Chemistry,2005,90:199-206.
[10]霍婷,杨惠玲,薛文通,等.花生红衣色素的研究进展[J].食品工业科技,2008,29(11):289-290.
[11]Adler-Nissen J.Enzymic hydrolysis of food proteins[M]. London:Elsevier Applied Science Publishers,1986.
[12]袁斌,吕桂善,刘小玲.蛋白质水解度的简易测定方法[J].广西农业生物科学,2002(3):113-115.
[13]Kato A,Nakai S.Hydrophobicity determined by a fluorescence probe method and its correlation with surface properties of proteins [J].Biochemical et Biophysical Acta,1980(624):13-20.
[14]Petruccelli S,Anon MC.Relationship between the method of obtention and the structural and functional properties of soy protein isolates.1.Structural and hydration properties[J].Journal of Agricultural and Food Chemistry,1994,42:2161-2169.
[15]Lowry Oliver H,Rosebrough Nira J,Farr ALewis.Protein measurement with the folin phenol reagent[J].The Journal of Biological Chemistry,1951:265-275.
[16]Carbonaro M,Grant G,Cappelloni M,et al.Perspectives into factors limiting in vivo digestion of legume proteins:Antinutritional compounds or storage proteins[J].Journal of Agricultural and Food Chemistry,2000,48:742-749.
[17]Shimada K,Fujikawa K,Yahara K,et al.Antioxidative properties of xanthan on the antioxidation of soybean oil in cyclodextrin emulsion[J].Journal of Agricultural and Food Chemistry,1992,40:945-948.
[18]Sripad G,Rao MSN.Effect of methods to remove polyphenols from sunflower flour on the physicochemical properties of the proteins[J].Journal of Agricultural and Food Chemistry,1987,35:962-967.
[19]何雨青,石艳宾.花生多肽的研究进展[J].食品研究与开发,2008,29(5):171-174.
[20]胡晓,赵谋明,任娇艳,等.花生分离蛋白与蓝园鲹酶解物TGase交联产物的乳化特性[J].华南理工大学学报:自然科学版,2010,38(8):95-99.
Effect of peanut red skin on the physicochemical and antioxidant properties of peanut protein isolate and its hydrolysates
GU Wei1,YANG Xiao-quan1,*,LIU Yuan-yang2,GUO Jian1,REN Xiao-ming1
(1.Research and Development Centre of Food Protein,College of Light Industry and Food Science,South China University of Technology,Guangzhou 510640,China;2.College of Food Science,Heilongjiang August First Reclamation University,Daqing 163319,China)
Peanut was used as raw material,the effects of peanut red skin on the physicochemical and antioxidant properties of peanut protein isolate(PPI)and its hydrolysates were studied.The results showed that:the hydrolysis speed of PPI with peanut red skin was slower than PPI without peanut red skin;under the conditions of the same value of DH,surface hydrophobicity of PPI with peanut red skin was less than PPI without peanut red skin;in the distribution of GPC,the peak of PPI with peanut red skin was greater than PPI without peanut red skin;peanut red skin could improve the solubility,emulsion stability and emulsifying activity of PPI and its hydrolysates;under the conditions of the same value of DH,content of polyphenol of hydrolysates of PPI with peanut red skin was significantly increased,content of polyphenol had a positive correlation with antioxidant properties of PPI and its hydrolysates.
peanut red skin;peanut protein isolate;hydrolysates;physicochemical properties;antioxidant activities
TS201.2+1
A
1002-0306(2012)03-0106-05
2011-05-16 *通讯联系人
顾炜(1986-),男,硕士,研究方向:蛋白质化学与工程。基金项目:广东省重大科技专项(2009A080209001)。
