枣果皮结合酚的大鼠体内吸收及抗氧化能力研究
2012-11-15朱春秋蔡晓菲姜微波
朱春秋,程 代,蔡晓菲,姜微波
(中国农业大学食品科学与营养工程学院,北京100083)
枣果皮结合酚的大鼠体内吸收及抗氧化能力研究
朱春秋,程 代,蔡晓菲,姜微波*
(中国农业大学食品科学与营养工程学院,北京100083)
为了解枣果皮结合酚(JPBP)在体内的吸收情况及其对大鼠血浆总抗氧化能力的影响,用JPBP(500mg/kg·bw)对大鼠进行灌胃处理,分别在灌胃后5、10、15、25、40、60min抽取血样,检测血浆的总抗氧化能力,并用高效液相色谱分析血浆中JPBP的吸收情况。结果显示:灌胃JPBP后5~60min内,大鼠血浆总抗氧化能力均显著提高(p<0.05);在大鼠血浆中检测到了JPBP的主要成分--香豆酸;并发现在灌胃后15~25min之间,香豆酸在血浆中达到最大浓度。实验结果表明,枣果皮结合酚能够被大鼠通过消化道吸收,并具有良好的体内抗氧化能力。
枣果皮,结合酚,总抗氧化能力,吸收
枣(Ziziphus jujube Mill)是中国的传统果品之一,具有很高的营养与药用保健功效,是天然的药食同源食品[1],植物多酚是植物体内次生代谢的中间产物,由于其特殊的结构和生物活性,具有很好的抗氧化功效[2],研究表明枣果中含有丰富的多酚类物质[3],其中枣果皮中酚类物质的总量至少为枣果肉中的五六倍以上[4]。然而,在实际生产中,枣果皮往往被废弃掉,因此,研究枣果皮中酚类物质的生物活性将有助于枣果的进一步开发利用,提高枣果附加值。薛自萍等研究表明,枣果皮中酚类物质具有铁还原能力和清除DPPH·、ABTS·+自由基的能力,说明枣果皮中酚类物质具有很强的抗氧化能力[5],然而,鲜有文献报道枣果皮中酚类物质体内抗氧化能力方面的研究。本文探讨了枣果皮结合酚(JPBP)对大鼠血浆总抗氧化能力(T-AOC)的影响,并用高效液相色谱(HPLC)技术分析了枣果皮结合酚在大鼠血浆中的吸收情况。
1 材料与方法
1.1 材料与仪器
冬枣 采购于北京市海淀区西北旺镇唐家岭果园;健康清洁级Wistar大鼠12只 体重(180±20)g,由解放军军事科学院实验动物中心提供,许可证号:SCXK-(军)2007-004,饲养于SPF级动物房,环境温度(22±2)℃,环境湿度65%±5%,分笼饲养,自由进食和饮水;没食子酸标准品、原儿茶素标准品、儿茶素标准品、香豆酸标准品 Sigma公司,分析纯;肝素钠、甲醇、丙酮、乙酸乙酯、无水乙醚、盐酸、NaOH等 北京化学试剂公司,分析纯;总抗氧化能力测定试剂盒 购于南京建成生物技术公司。
SK8200H超声波发生器 上海科导超声仪器有限公司;旋转蒸发仪RE-52 上海亚荣生化仪器厂;SHB-3循环水式多用真空泵 郑州长城科工贸有限公司;TGL-16C离心机 上海安亭科学仪器厂;QL- 901漩涡混合器、MTN-2800D氮吹仪 上海泉岛科贸公司;T6-新世纪紫外可见分光光度计 北京谱析通用仪器有限责任公司;高效液相色谱仪LC-20A/ SPD-M20A 日本岛津公司。
1.2 实验方法
1.2.1 材料的制备 选取大小均匀、无机械损伤、无病虫害的冬枣,迅速用不锈钢刀分开果皮(厚度1mm)和果肉,将果皮放于-80℃冰箱以待实验。
1.2.2 枣果皮结合酚的提取 枣果皮中结合酚的提取参照文献[6],略有修改。准确称取200.0g枣果皮,加入甲醇-丙酮-水(体积比7∶7∶6)提取剂6L,于室温下超声20min提取三次[7],所得滤渣加入4mol/L NaOH溶液1L,于室温下避光水解4h,冰浴中用6mol/L HCl调整溶液的pH至2,用3L的乙酸乙酯-无水乙醚混合液(1∶1)萃取3次,合并萃取液,于30℃下真空浓缩至干,用去离子水定容至10mL得结合酚。
1.2.3 酚含量的测定 参照Singleton和Rossi[8]的方法,以没食子酸为标准品,制作标准曲线,计算枣果皮结合态的酚含量,表示为每克果皮的结合酚含量(mg/g)。
1.2.4 动物实验方法 大鼠随机分为两组:对照组,JPBP组,每组6只。禁食24h(自由采水)后,对照组经口灌胃2mL去离子水,JPBP组大鼠经口灌胃10mL/kg DW JPBP水溶液(含JPFP 50mg/mL),JPBP的灌胃计量为500mg/kg·bw。
各组大鼠于灌胃后5、10、15、25、40、60min用乙醚麻醉,眼底内眦静脉丛取血0.7mL,收集在肝素钠抗凝的离心管中,3000r/min离心8min。取上清210μL和100μL分装于2只离心管中,于-80℃冰箱中冻存,分别用于总抗氧化能力和高效液相色谱分析[9-10]。
将存有100μL血浆的离心管加入400μL甲醇涡旋2min混匀,15000r/min离心10min,取400μL上清于离心管中,50℃氮吹仪吹干,加入100μL甲醇涡旋2min后,取10μL高效液相色谱分析,外标法定量。
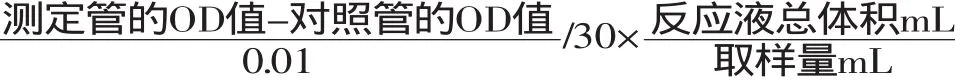
1.2.6 色谱条件 Waters C18反相色谱柱(5μm,4.6× 250mm);流动相A:1%(V∶V)的醋酸水溶液,流动相B:1%(V∶V)的醋酸甲醇溶液;总流速为0.8mL/min;检测波长为280nm;柱温为30℃;进样量为10μL;洗脱梯度:B相0~15min 10%~18%,15~35min 18%~25%,35~45min 25%~35%,45~60min 35%~50%,60~65min 50%~65%,65~75min 65%~95%,随后75~90min回落到起始浓度。
1.2.7 香豆酸标准曲线的制作 精确称取香豆酸标准物质10.0mg置于100mL容量瓶中,甲醇定容得浓度为0.1mg/mL的标准物质储备母液。将标准母液稀释成1、2、5、10、20μg/mL各浓度标准液,按1.2.6条件测定,以峰面积对浓度绘制标准曲线。
1.2.8 统计分析 结果表示为平均值±标准偏差(n=6),应用SPSS17.0软件对所有数据进行方差分析,并进行Duncans’差异显著性分析,p<0.05表示差异显著。
2 结果与讨论
2.1 灌胃枣果皮结合酚对大鼠血浆总抗氧化能力的影响
已有研究表明,枣果皮结合酚在体外具有优异的抗氧化能力[5],本实验旨在探讨枣果皮结合酚在大鼠体内的吸收情况以及吸收后对血浆总抗氧化能力的影响。根据总酚含量的标准曲线Y=0.0039X+0.0053,其中:Y—吸光值;X—浓度(μg·mL-1),计算出枣果皮中结合酚的含量为4.2mg/g,将此枣果皮结合酚水溶液稀释至含结合酚50mg/mL后灌胃予大鼠。
实验观察到,与对照组相比,灌胃500mg/kg[9]枣果皮结合酚后5~60min内,大鼠血浆总抗氧化能力均有显著提高(p<0.05),灌胃后10~25min期间的总抗氧化能力显著高于灌胃后5、40、60min时的总抗氧化能力。
机体总抗氧化能力取决于机体内的抗氧化剂,主要包括抗氧化酶类和非酶类抗氧化剂(如VC,多酚等)[11],抗氧化剂在维持体内氧化和抗氧化系统平衡中发挥重要的作用,主要是通过抑制自由基的产生或清除自由基,提高内源性抗氧化物质水平来完成[12],又有研究表明多酚能够诱导细胞内合成内源性抗氧化剂[13]。为了分析血浆抗氧化能力升高的原因,进而对血浆进行了HPLC分析。
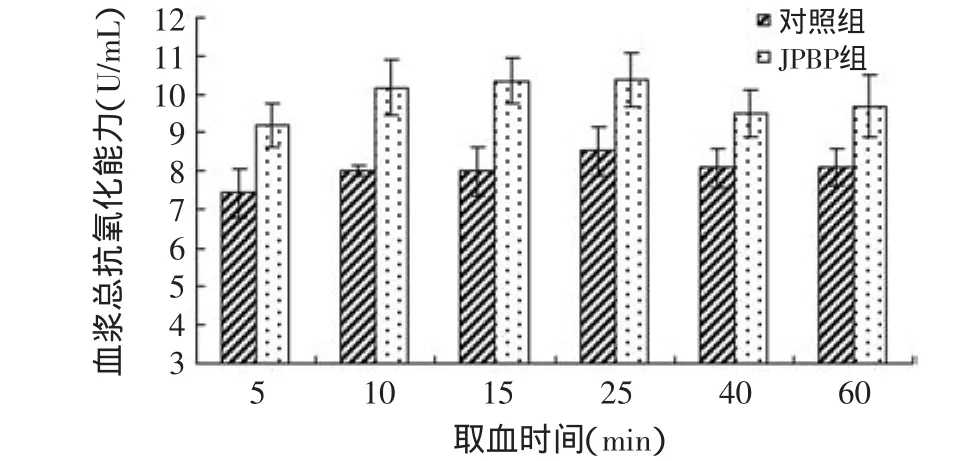
图1 灌胃枣果皮结合酚对大鼠血浆总抗氧化能力的影响Fig.1 Effect of JPBP on total antioxidant capacity in plasma
2.2 灌胃枣果皮结合酚对大鼠血浆HPLC谱图的影响
多酚以游离酚和结合酚的形式存在于植物体中[6],枣果皮中的酚类物质现已分析出的游离酚有儿茶素、表儿茶素[5]、没食子酸、原儿茶素[14],结合酚有香豆酸[5]。对枣果皮中可能存在的酚进行单一标准物质储备液的HPLC上样分析,结果表明,枣果皮结合酚HPLC谱图中37.52min处的峰与香豆酸标准物质的保留时间、峰形及峰的最大吸收波长相吻合,说明香豆酸是枣果皮结合酚成分之一。与对照组大鼠血浆的HPLC谱图相比,灌胃枣果皮结合酚后大鼠血浆的谱图中37.52min检测到了香豆酸的吸收,即枣果皮结合酚中的香豆酸吸收进入血液。
2.3 灌胃枣果皮结合酚后大鼠血浆中香豆酸的血药浓度与时间的关系
根据香豆酸标准曲线Y=(5e-005)X+0.4453,其中:Y—浓度(μg·mL-1);X—峰面积。可计算出不同取血时间下香豆酸的血药浓度,灌胃枣果皮结合酚后5min的大鼠血浆中即能检测到香豆酸的吸收,且在灌胃后15~25min之间血药浓度达到最大。
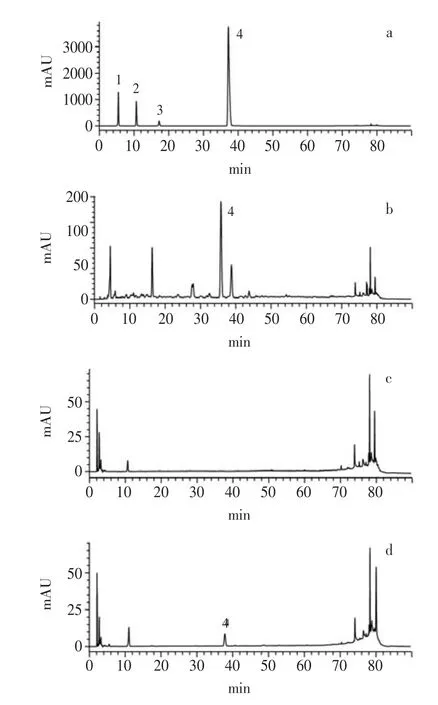
图2 灌胃枣果皮结合酚后对大鼠血浆的HPLC谱图的影响Fig.2 Effect of JPBP on HPLC spectrogram of plasma
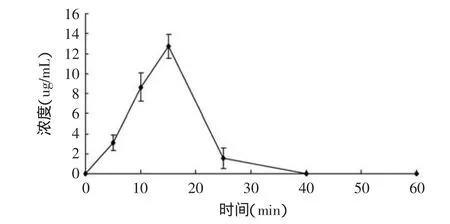
图3 香豆酸在大鼠体内的血药浓度-时间曲线Fig.3 The plasma concentration-time chart of p-Coumaric acid in rat
通过SPSS17.0软件对血浆总抗氧化能力的升高与血浆中香豆酸浓度进行相关性分析,得出R=0.738(皮尔逊,双尾检验)。证明血浆总抗氧化能力的升高与香豆酸的浓度具有一定相关性,由此推断灌胃枣果皮结合酚后大鼠血浆总抗氧化能力的升高的原因,一方面是由于枣果皮结合酚吸收入血后直接抑制了自由基的产生或清除了自由基;另一方面是其诱导细胞内合成内源性抗氧化剂,从而提高了血浆的总抗氧化能力。
3 结论
本实验通过分析灌胃枣果皮结合酚后大鼠血浆总抗氧化能力的变化及其在大鼠体内的吸收情况,证明了枣果皮结合酚能够被大鼠通过消化道吸收,并具有良好的体内抗氧化能力。
[1]苗明山,孙丽敏.大枣的现代研究[J].河南中医,2003,23(3):59-60.
[2]程春龙,李俊清.植物多酚的定量分析方法和生态作用研究进展[J].应用生态学报,2006,17(12):2456-2460.
[3]Hudina M,Liu M,Veberic R,et al.Phenolic compounds in the fruit of different varieties of Chinese jujube(Ziziphus jujuba Mill)[J].Journal of Horticultural Science and Biotechnology,2008,83(3):305-308.
[4]Xue ZP,Feng WH,Cao JK,et al.Antioxidat activity and total total phenolic contents in peel and pulp of Chinese jujube(ziziphus jujube mill)fruits[J].Food Biochem,2009,33:613-629.
[5]薛自萍,曹建康,姜微波.枣果皮中酚类物质提取工艺优化及抗氧化活性分析[J].农业工程学报,2009,25(1):153-157.
[6]Morimura S,Nagata H,Uemura Y,et al.Development of an effective process for utilization of collagen from livestock and fish waste[J].Process Biochemistry,2002,37:1403-1412.
[7]GB5009.5-85.食品中蛋白质的测定方法[S].1985.
[8]刘尊英,李八方,曾名勇.鳕鱼皮胶原蛋白胰蛋白酶控制水解动力学模型[J].食品科技,2008(2):74-78.
[9]Germanòa MP,D’Angeloa V,Biasinia T.Evaluation of the antioxidant properties and bioavailability of free and bound phenolic acids from Trichilia emetica Vahl[J].Journal of Ethnopharmacology,2006,105:368-373.
[10]Kountouri AM,Mylona A,Kaliora AC,et al.Bioavailability of the phenolic compounds of the fruits(drupes)of Olea europaea(olives):Impact on plasma antioxidant status in Humans[J]. Phytomedicine,2007,14:659-667.
[11]张英彪,李纯颖,李勇.甲醛和苯对小鼠睾丸总抗氧化能力和ATP酶及钙的影响[J].实用预防医学,2008,15(1):64-69.
[12]金惠铭,卢键.细胞分子病理生理学[M].昆明:云南科技出版社,1997:32-48.
[13]Jiao H,Ye P,Zhao B.Protective effects of green tea polyphenols on human HepG2 cells against oxidative damage of fenofibrate[J].Free Radical Biol,2003,35:1121-1128.
[14]Zhang H,Jiang L,Ye S,et al.Systematic evaluation of antioxidant capacities of the ethanolic extract of different tissues of jujube(Ziziphus jujuba Mill)from China[J].Food and Chemical Toxicology,2010,48:1461-1465.
Study on absorption of the bound phenolics from jujube peel in rat and its antioxidant activity
ZHU Chun-qiu,CHENG Dai,CAI Xiao-fei,JIANG Wei-bo*
(College of Food Science and Nutritional Engineering,China Agricultural University,Beijing 100083,China)
To examine absorption of the bound phenolics from jujube peel(JPBP)in vivo,the plasma samples were taken at 5,10,15,25,40,60min after the rats gavaged with JPBP(500mg/kg·bw),then were subjected for analysis of phenolics and total antioxidant capacity(T-AOC).T-AOC in the plasma was significantly increased(P<0.05)in 5~60min after the JPBP gavage.The p-Coumaric acid,one component of the major phenlics in JPBP,was observed by high-performance liquid chromatography analysis and its maximum level in the plasma was showed in 15~25min after the JPBP gavage.Our results indicated that JPBP could be abosorbed by rat and could enhance antioxidative activity in vivo in rat.
jujube peel;bond phenolic;T-AOC;absorption
TS201.4
A
1002-0306(2012)03-0352-03
2011-03-07 *通讯联系人
朱春秋(1986-),女,硕士,主要从事食品功能成分研究。
国家自然科学基金项目(30871763;30700645)。
