复合纳米微粒修饰丝网印刷电极的一次性过氧化氢生物传感器研究
2012-11-15张春梅肖志杰
张春梅,杨 欣,吴 峰,肖志杰
(1.怀化学院化学与化学工程系,湖南怀化418000;2.民族药用植物资源研究与利用湖南省重点实验室,湖南怀化418008)
复合纳米微粒修饰丝网印刷电极的一次性过氧化氢生物传感器研究
张春梅1,杨 欣2,*,吴 峰1,肖志杰1
(1.怀化学院化学与化学工程系,湖南怀化418000;2.民族药用植物资源研究与利用湖南省重点实验室,湖南怀化418008)
构建纳米金(Au)-石墨烯(GS)-辣根过氧化物酶(HRP)-Nafion纳米复合物修饰丝网印刷电极(SPCEs)的一次性过氧化氢生物传感器,并用于过氧化氢的测定。采用化学镀金方法于SPCEs表面形成Au,然后将GS、HRP和Nafion组成的复合物涂覆于SPCEs/Au表面,构建SPCEs/Au/GS/HRP/Nafion电极,采用扫描电镜(SEM)表征化学镀金、GS和电极的制备过程,采用循环伏安(CV)法和计时电流(i-t)法研究H2O2的电化学性质。在优化的实验条件下,该电极能实现HRP的直接电子传递,对H2O2有显著的电催化作用,在2.0×10-5~2.5×10-3mol/L浓度范围内对H2O2有良好的线性响应,线性相关系数为0.9994,检测限为1.2×10-5mol/L。该传感器灵敏快速、制备容易、样品用量少、可抛弃、抗干扰性强,有望用于食品中痕量H2O2残留的检测。
石墨烯,纳米金,辣根过氧化物酶,Nafion,丝网印刷电极,过氧化氢
过氧化氢(H2O2)在食品工业、环境分析等领域应用广泛,同时,它也是葡萄糖氧化酶、胆固醇氧化酶等一系列酶促反应的重要副产物[1-2]。因此,发展灵敏、快速、低成本的H2O2检测方法与仪器意义重要。目前,H2O2检测方法包括滴定法[3]、荧光法[4]、色谱法[5-6]及电化学法[7-12]。其中,电化学法,尤其是基于各种过氧化物酶[7-10]和血红蛋白[11-12]的电流型生物传感器研究最为广泛,因其具有操作简便、灵敏度高和选择性好等优点。然而,酶在电极表面易失活,圆盘电极检测时样品需要量大以及碳纳米管(CNTs)等电极修饰材料价格昂贵等因素,在一定程度上限制了该类传感器的应用。基于丝网印刷电极(SPCEs)的电化学生物传感器具有电极集成、成本低、一次使用可抛弃且能够实现批量生产等优点,为推动传感器走向廉价、大规模应用提供了一种具有前景的途径[13-14]。石墨烯(GS)是一种具有优良电化学性能的新型电极修饰纳米材料,相对CNTs,其制备和使用成本大大降低,大有取代CNTs的趋势,成为当今理论和实验界研究的热点[15-16];Nafion是一种全氟化高分子聚合物阳离子交换剂,能有效防止由于GS团聚而导致的电化学性能变差,已广泛用于石墨烯基生物传感器表面敏感膜构建[8,17]。纳米金(Au)由于其优良的导电性并能长久保持酶等生物蛋白的活性亦广泛应用于生物传感器的构建[18-19]。本研究采用化学镀方法于SPCEs表面生成Au,然后将GS、HRP和Nafion组成的复合物涂覆于SPCEs/Au表面,首次构建复合纳米微粒修饰SPCEs的H2O2现场快速检测用电化学生物传感器(SPCEs/Au/GS/HRP/Nafion)。
1 材料与方法
1.1 材料与仪器
辣根过氧化物酶(HRP,活性≥250U/mg) 上海国药集团;石墨 长沙格翎电池材料有限公司;过氧化氢(30%) 天津市富宇精细化工有限公司;Nafion溶液 上海河森电气有限公司;磷酸盐缓冲溶液(PBS,0.1mol/L) 用NaH2PO4、Na2HPO4和NaCl配制;氯金酸、葡萄糖、抗坏血酸及其它试剂 均为分析纯,上海国药集团;实验用水 均为二次蒸馏水。
CHI660D电化学工作站 上海辰华仪器有限公司;三电极集成的SPCEs西班牙DropSens公司,其中工作电极为复合纳米微粒修饰电极,参比电极为印刷Ag/AgCl电极,对电极为印刷碳电极;Hitachi S-3400N型能谱扫描电镜 日本Hitachi公司;DF-101S集热式恒温加热磁力搅拌器 巩义市予华仪器有限责任公司。
1.2 GS、GS/Nafion以及GS/HRP/Nafion复合物的制备
首先采用改进的Hummers和Offeman法[20-21]制得氧化石墨(Graphite oxide,GO)。将0.1g GO溶解于100mL蒸馏水,超声3h,成为均匀分散的黄色透明GO胶体溶液。将上述溶液置于250mL三颈瓶中,水浴80℃加热,加入50μL肼还原24h,最后得黑色絮状沉淀,洗涤、抽滤、真空干燥得到GS粉末。2.0mg GS加至1.0mL 0.5%Nafion溶液中并超声2h形成均一稳定的GS/Nafion复合物。再向上述复合物中加入含20mg/mL HRP的pH=6.5 PBS 1.0mL,得到GS/HRP/Nafion复合物。

图1 石墨(a)、氧化石墨(b)、石墨烯(c)以及石墨烯+Nafion(d)水溶液的电子照片Fig.1 Photographic images of(a)graphite,(b)GO,(c)GS and(d)GS+Nafion in water
GS制备过程的电子照片如图1所示,天然石墨不溶于水,在水中分散性很差,容器底部形成明显的沉淀(1a);GO胶体呈亮黄色,经过氧化后已在碳原子层之间引入大量的羧基、羟基等亲水性基团而易溶于水(1b);GS在水溶液中由于π-π共轭以及强的分子间作用力而容易团聚(1c);Nafion溶液的增溶作用明显改善了GS的水溶性,由于其带负电的磺酸基与石墨烯的负电荷相互排斥而有效防止了GS团聚,得到了分散性较好的GS/Nafion溶液(1d)。
1.3 不同电极的构建
SPCEs表面化学镀金参照文献[22]进行,将SPCEs电极浸入0.36mol/L乙二胺溶液中,室温反应3h取出,然后浸入1mmol/L氯金酸溶液反应2.5h,Au3+络合于-NH2表面,最后,浸入0.1mol/L硼氢化钠溶液还原5min,得到Au颗粒大小为30nm的SPCEs/Au电极。均匀滴加10μL GS/HRP/Nafion复合物上述电极表面,过夜干燥即得SPCEs/Au/GS/HRP/Nafion电极。采用上述类似涂覆方法制得SPCEs/Au/HRP/Nafion、SPCEs/GS/HRP/ Nafion电极作为对比。
1.4 传感器对H2O2的检测
将SPCEs/Au/GS/HRP/Nafion电极置于5.0mL pH= 6.5 PBS中,采用循环伏安(CV)法检测HRP的在电极表面的直接电子传递(Direct electron transfer,DET);在上述溶液中再加入不同浓度的H2O2,CV法检测电极对不同浓度H2O2的催化响应;采用计时电流(i-t)法进行H2O2定量分析。传感器检测系统及工作电极表面形貌见图2。CV法电位范围:0.4~0.8V,扫描速率:0.1V/s;i-t实验电位:-0.3V;实验前溶液通氮除氧15min,实验过程中保持氮气氛围。
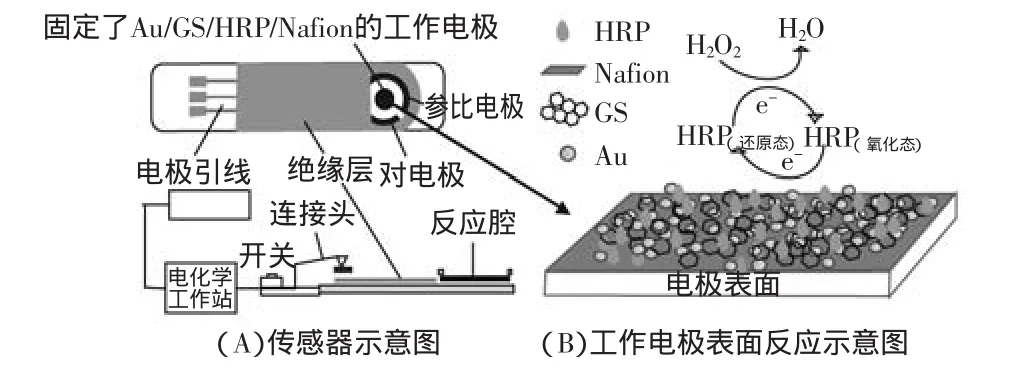
图2 传感器以及工作电极表面反应机理示意图Fig.2 Schematic diagram of the electrochemical biosensor apparatus(A)and the reaction mechanism on the surface of working electrode(B)
2 结果与讨论
2.1 传感器制作过程各阶段获得电极的表征

图3 SPCEs(a),SPCEs/Au(b),SPCEs/Au/GS/HRP/Nafion(c)电极表面形貌扫描电镜图Fig.3 SEM images of bare SPCEs(a),SPCEs/Au(b)and SPCEs/Au/GS/HRP/Nafion(c)electrode
采用扫描电镜(SEM)分别对SPCEs、SPCEs/Au/ Nafion及SPCEs/Au/GS/HRP/Nafion电极表面进行了表征。图3a显示SPCEs表面具有比较明显的块状石墨结构;在SPCEs表面化学镀Au以后(图3b),SPCEs/Au电极出现了许多分布均匀、粒径约为30nm的白色亮点,推测是由于Au反射光产生。根据文献[19]报道,这种均一的三维点状结构能使电极的有效面积增大、扩增响应电流。SPCEs/Au/GS/HRP/Nafion的SEM如图3c,出现了分散的褶皱状石墨烯片层结构,进一步说明已成功合成GS,在GS表面均匀分散着粒径约为200~400nm的纳米颗粒,比Au(30nm)粒径明显增大,与蛋白质粒径相似,这说明HRP包被在电极表面。
2.2 传感器制作过程中各阶段获得电极的电化学特性
在pH=6.5 0.1mol/L的PBS中,测定了不同电极的CV曲线(图4)。SPCEs/HRP/Nafion电极(a)没有出现HRP的氧化还原峰,推断是因为HRP的电化学活性中心被深深地包埋在蛋白质的核壳结构中,这使得酶的活性中心与电极表面之间的距离比电子能传递的有效距离远,而且,由于Nafion的不导电进一步阻碍了其电子的传递[7];SPCEs/Au/HRP/Nafion电极(b)以及SPCEs/GS/HRP/Nafion电极(c)均在-0.3V附近出现明显的还原峰电流,能明显观察到HRP的DET;与上述电极相比SPCEs/Au/GS/HRP/Nafion电极的还原峰电流最强,HRP的DET现象更为明显。实验考察得到不同浓度的H2O2在SPCEs/Au/GS/ HRP/Nafion电极上CV曲线的还原峰电流随着其浓度的增加而增大(图5),说明H2O2能被催化还原。
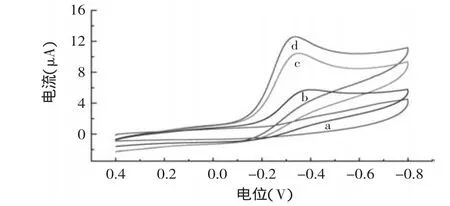
图4 SPCEs/HRP/Nafion(a),SPCEs/Au/HRP/Nafion(b),SPCEs/GS/HRP/Nafion(c),SPCEs/Au/GS/HRP/Nafion(d)在0.1mol/L PBS中的循环伏安图Fig.4 CVs of SPCEs/HRP/Nafion(a),SPCEs/Au/HRP/Nafion(b),SPCEs/GS/HRP/Nafion(c)and SPCEs/Au/GS/HRP/Nafion(d)in 0.1mol/L PBS at a scan rate of 0.1V/s
2.3 电极的制备及测定条件优化
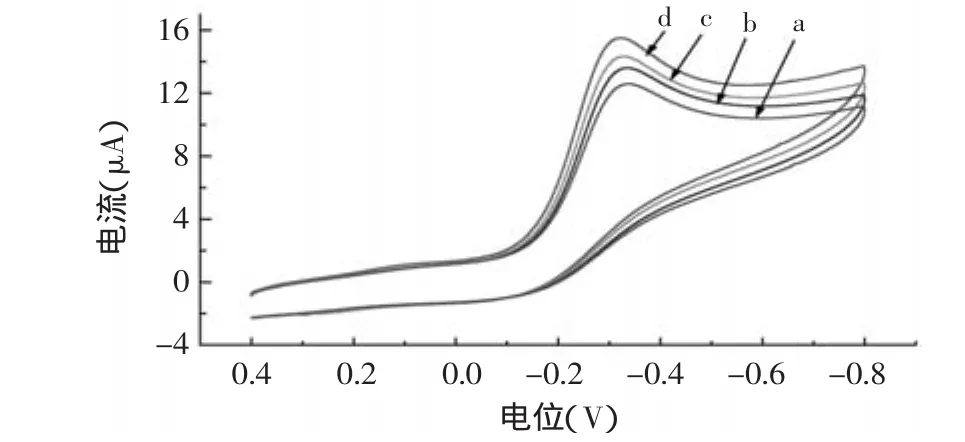
图5 SPCEs/Au/GS/HRP/Nafion电极对0mmol/L(a),0.1mmol/L(b),0.2mmol/L(c),0.3mmol/L(d)H2O2的循环伏安响应Fig.5 CVs of SPCEs/Au/GS/HRP/Nafion with successive addition of 0.1mmol/L H2O2in 0.1mol/L PBS at pH 6.5 at a scan rate of 0.1V/s
2.3.1 化学镀Au的粒径 Gu H Y等[23]研究发现,小尺寸的Au(大约30nm)能给予HRP等蛋白质等生物活性分子更多的取向自由度,从而增加辅基靠近金胶的机会,使电子方便地通过Au的传输通道,最大幅度地扩增响应电流。而我们化学镀合成的单分散Au粒径在30nm左右,故具有较好的电子传递性能,能较大幅度地扩增响应电流。
2.3.2 电极表面GS/HRP/Nafion的滴加量 电极表面GS/HRP/Nafion滴加量会影响H2O2的响应电流,由图6可见,0.5mmol/L H2O2的还原峰电流随着GS/HRP/Nafion滴加量的增加而变大,这是由于电极表面的催化活性位点随着GS和HRP的增加而增多,当用量超过10μL时,电流反而降低,这可能是因为电极表面不导致的Nafion增多反而阻碍了电子传递,故本实验选用10μL GS/HRP/Nafion复合物涂覆到SPCEs/Au电极表面。
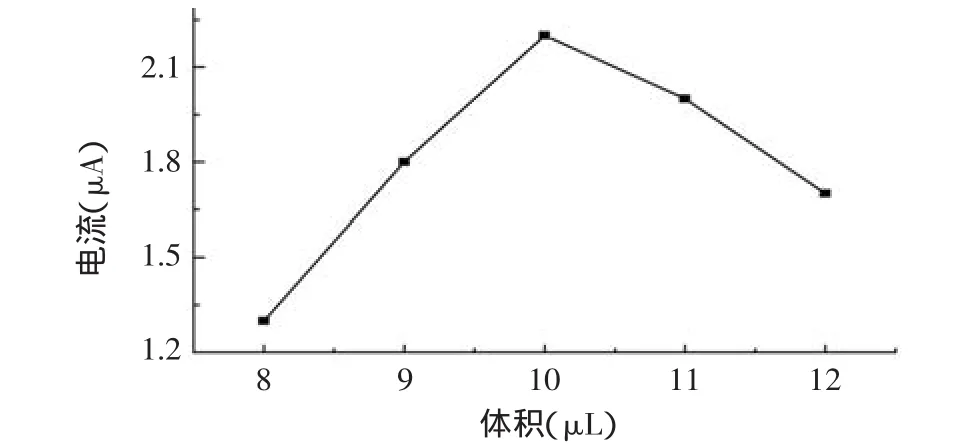
图6 GS/HRP/Nafion量对响应电流的影响Fig.6 Effect of the volume of GS/HRP/Nafion on CV current

图7 pH对响应电流的影响Fig.7 Effect of pH on CV current

图8 温度对响应电流的影响Fig.8 Effect of temperature on CV current
2.3.3 pH的选择 考察了缓冲溶液pH对0.5mmol/L H2O2响应电流的影响,如图7所示,当缓冲溶液的pH= 6.5时,修饰电极对H2O2的还原电流达到最大,推测是因为HRP活性在pH=6.5时保持最佳。因此,选择pH= 6.5的PBS作为检测实验的底液。
2.3.4 温度的选择 考察了酶电极在15~40℃范围内对0.5mmol/L H2O2的响应电流(图8),实验结果表明温度在25℃时响应电流达到最大,说明此时HRP活性最强,因此选择实验在25℃时进行。
2.4 H2O2的测定
在优化的实验条件下,采用i-t法研究了酶电极的电流响应与H2O2浓度之间的关系,结果如图9所示。在一直保持氮气氛围的搅拌底液中,每隔30s加入一定浓度的H2O2,酶电极所产生的稳态电流随H2O2的加入呈台阶状增加,电流响应迅速,在3s内可达到稳定响应,响应电极与H2O2浓度在2.0×10-5~2.5× 10-3mol/L浓度范围有良好的线性响应,线性相关系数为0.9994,检测限为1.2×10-5mol/L(S/N=3),线性回归方程为:i=2.2375×10-7+4.8179×10-6C(C单位:mmol/L),以上结果优于相关文献[2,11]的报道。
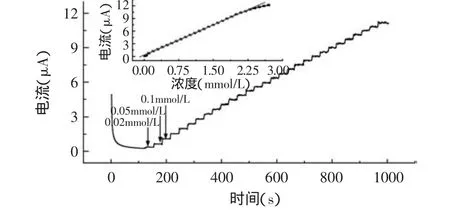
图9 SPCEs/Au/GS/HRP/Nafion电极对连续加入H2O2的电流-时间曲线Fig.9 i-t response of SPCEs/Au/GS/HRP/Nafion for successive addition of H2O2in pH=6.5 0.1mol/L PBS.Inset:Calibration curve between current and CH2O2 operating potential:-0.3V
2.5 电极的精密度、制备重复性、稳定性和抗干扰性
精密度:采用同一根电极分别测定0.5mmol/L H2O2五次,得到其组内变异系数分别为3.0%、3.2%和2.5%,说明该酶电极具有良好的精密度。
制备重复性:由于使用的SPCEs是同一批次印制,因此彼此结构完全相同(包括电极材料、面积和碳层厚度等),且只使用一次即抛弃。所以我们比较了采用5个同一批次制备的H2O2传感器,对0.5mmol/L的H2O2进行测定,获得组间变异系数为2.5%(n=3),说明该酶电极具有较好的制备重复性。
稳定性:酶电极在4℃冰箱中存放15d后对0.5mmol/L H2O2测定时的电流响应值为初始值的94%;存放30d后仅下降为原来的90%。表明制作的酶电极在30d内比较稳定,电极表面HRP的生物活性保持良好,这可能是由于Au具有优良的生物兼容性。
抗干扰性:于0.5mmol/L H2O2中分别加入1.0mmol/L葡萄糖、柠檬酸、抗坏血酸等干扰物质,结果发现这些物质对测定无干扰,说明电极具有良好的选择性。
2.6 实际样品检测
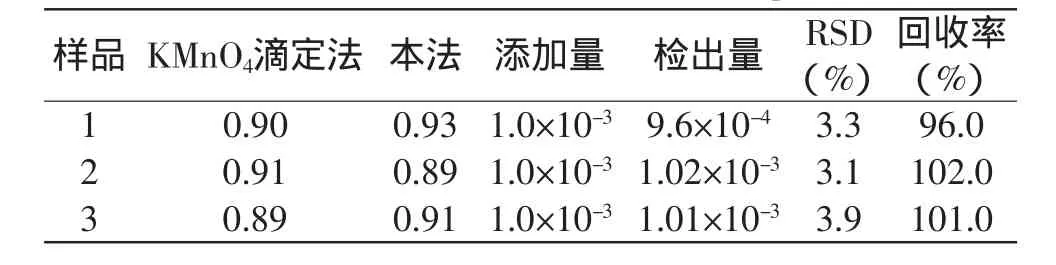
表1 实际样品中H2O2检测结果(N=6,mol/L)Table1 DeterminationresultsofH2O2inrealsamples(N=6,mol/L)
为验证本方法在实际检测中的可行性,对某双氧水隐形眼镜护理液中H2O2含量进行测定(表1)。采用传统的高锰酸钾滴定法测得其中H2O2含量为0.90mol/L。采用本实验构建的传感器,在最佳实验条件下采用i-t法测定5次,均值为0.91mol/L,样品回收率(检出量/加入量×100%)在96%~102%之间,说明本方法可用于实际样品中H2O2的现场快速测定。
3 结论
制作了SPCEs/Au/GS/HRP/Nafion一次性安培型酶电极,并对实际样品中痕量H2O2含量进行了检测,结果令人满意。与常规H2O2检测电极相比具有以下优势:该一次性电极廉价(成本<3元/片),小巧且集成度高(pH试纸大小且集成三电极),样品需要量少(μL级),用后可抛弃,避免了同一电极检测多个样本时交叉干扰问题,且同一批次制作的电极结果重现性良好;采用复合纳米微粒修饰电极,灵敏度提高,电极保存时间延长,电极表面的Nafion膜显著降低了带负电荷的抗坏血酸、多巴胺等的干扰。综上所述,本研究构筑的一次性电极是实现H2O2现场、快速、超灵敏检测可选用的最佳途径之一。本文构建的平台技术具有通用性,只要改变检测对象种类,即可进一步推广至葡萄糖等其它食品的检测并可以作为光谱、色谱等方法的有益补充,在食品分析方面具有重要的理论和实际价值。
[1]林倩,张菊,王晓芳,等.食品级过氧化氢的应用及其净化技术[J].食品科学,2006,27(10):626-629.
[2]宣婕,姜立萍,朱俊杰.基于三维有序大孔金电极的过氧化氢无酶传感器[J].分析化学,2010,38(4):513-516.
[3]黄伟坤.食品检验与分析[M].北京:中国轻工业出版社,1989:171.
[4]陈志兵,王鹏,李艳,等.功能性碲化镉纳米荧光探针荧光猝灭法测定过氧化氢[J].理化检验-化学分册,2009,45(4):413-416.
[5]YUE H F,BU X,HUANG M H,et al.Quantitative determination of trace levels of hydrogen peroxide in crospovidone and a pharmaceutical product using high performance liquid chromatography with coulometric detection[J].International Journal of Pharmaceutics,2009,375:33-40.
[6]陈易晖,刘艳,周建立,等.高效液相色谱-紫外检测法测定食品中的过氧化氢[J].光谱实验室,2009,26(2):414-417.
[7]ZHOU K F,ZHU Y H,YANG X L,et al.A novel hydrogen peroxide biosensor based on Au-graphene-HRP-chitosan biocomposites[J].Electrochimica Acta,2010,55:3055-3060.
[8]LU Q,DONG X C,LI L J,et al.Direct electrochemistrybased hydrogen peroxide biosensor formed from single-layer graphene nanoplatelet-enzyme composite film[J].Talanta,2010,82:1344-1348.
[9]丁建英,韩剑众,冯志梅,等.基于聚硫菫的一次性过氧化氢生物传感器的研究[J].食品科技,2010,35(4):265-268.
[10]邓祥,黄小梅.壳聚糖-碳纳米管复合物修饰的过氧化氢生物传感器[J].四川文理学院学报,2010,20(5):48-50.
[11]邓子峰,张洪伟,焦玉珠.基于细胞色素C/氧化锌的过氧化氢生物传感器[J].分析化学,2009,37(4):613-616.
[12]潘芊秀,王怀生,王桂香.壳聚糖/Nafion膜固定氯化血红素制备过氧化氢生物传感器[J].分析试验室,2010,29(1):91-94.
[13]徐肖邢.亚甲基蓝为介体的丝网印刷双酶修饰电极测定葡萄糖[J].食品科学,2007,28(4):249-251.
[14]RENEDO OD,ALONSO-LOMILLO MA,ARCOS MARTINEZ MJ.Recent developments in the field of screen-printed electrodes and their related applications[J].Talanta,2007,73:202-219.
[15]胡耀娟,金娟,张卉,等.石墨烯的制备、功能化及在化学中的应用[J].物理化学学报,2010,26(8):2073-2086.
[16]TAN L,ZHOU KG,ZHANG YH,et al.Nanomolar detection of dopamine in the presence of ascorbic acid at β-cyclodextrin/ graphene nanocomposite platform[J]. Electrochemistry Communications,2010,12:557-560.
[17]LU J,DRZAL LT,WORDEN RM,et al.Simple fabrication of a highly sensitive glucose biosensor using enzymes immobilized in exfoliated graphite nanoplatelets nafion membrane[J].Chemistry of Materials,2007,19:6240-6246.
[18]刘丽强,彭池芳,金征宇,等.纳米金技术的发展及在食品安全快速检测中的应用[J].食品科学,2007,28(5):348-352.
[19]WANG JW,WANG LP,DI JW.Electrodeposition of gold nanoparticles on indium/tin oxide electrode for fabrication of a disposable hydrogen peroxide biosensor[J].Talanta,2009,77:1454-1459.
[20]杨常玲,刘云芸,孙彦平.石墨烯的制备及其电化学性能[J].电源技术,2010,134(2):177-180.
[21]BAI H,XU YX,ZHAO L,et al.Non-covalent functionalization of graphene sheets by sulfonated polyaniline[J].Electrochemistry Communications,2009:1667-1669.
[22]KONG Y,CHEN HW,WANG YR,et al.Fabrication of a gold microelectrode for amperometric detection on a polycarbonate electrophoresis chip by photo directed electroless plating[J]. Electrophoresis,2006,27:2940-2945.
[23]GU HY,YU AM,CHEN HY.Direct electron transfer and characterization of hemoglobin immobilized on a Au colloid gold electrode[J].Journal of Electroanalytical Chemistry,2001,516(12):119-123.
Study on a disposable hydrogen peroxide biosensor based on Au-graphene-HRP-Nafion biocomposites modified screen-printed carbon electrodes
ZHANG Chun-mei1,YANG Xin2,*,WU Feng1,XIAO Zhi-jie1
(1.Department of Chemistry and Chemical Engineering,Huaihua College,Huaihua 418000,China;
2.Key Laboratory of Research and Utilization of Ethnomedicinal Plant Resources of Hunan Province,Huaihua University,Huaihua 418008,China)
A disposable biosensor for determination of hydrogen peroxide(H2O2)based on gold nanoparticles(Au)-graphene sheets(GS)-horseradish peroxidase(HRP)-Nafion biocomposites modified screen-printed carbon electrodes(SPCEs)was fabricated.To construct the H2O2biosensor,GS and HRP were co-immobilized into biocompatible Nafion,then the SPCEs was modified by the biocomposite,followed by electroless plating of Au on the surface to fabricate SPCEs/Au/GS/HRP/Nafion electrode.Different technologies were employed to study the synthesis of GS,construction processes and the electrochemical properties of the biosensor.Under the optimized experimental conditions,Cyclic voltammetry(CV)demonstrated that the direct electron transfer(DET)of HRP was realized,and the biosensor had an excellent performance in terms of electrocatalytic reduction towards H2O2.The linear response of the biosensor to H2O2was in the concentration range of 2.0×10-5~2.5×10-3mol/L(R2=0.9994)with a detection limit of 1.2×10-5mol/L.The proposed electrochemical biosensor was sensitive,quickly,disposable with low cost,fewer sample volume,easy preparation and strong anti-interference,which shows great promise for screen-determination of trace H2O2in real samples.
graphenesheet;goldnanoparticles;horseradishperoxidase;Nafion;screen-printedcarbonelectrodes;hydrogen peroxide
TS207.3
A
1002-0306(2012)03-0317-05
2011-02-14 *通讯联系人
张春梅(1968-),女,中级实验师,主要从事新型纳米材料制备研究。
湖南省教育厅科研基金(10C1059);湖南省高校“中药制剂工程与质量控制”产学研合作示范基地建设项目;怀化学院资助科研项目(HHUY2011-08)。
